A K-vitamin szerepe a lágyszövet meszesedésében 1
Absztrakt
Bevezetés
A gerinceseknél az extracelluláris testfolyadékok túltelítettek a kalciumhoz és a foszfáthoz képest, ami spontán kalcium-foszfát-kicsapódás tendenciáját eredményezi, amelyet gyakran kalcium × szervetlen foszfát termékként fejeznek ki (1). A kalcium-só kicsapásának és kristályosodásának hatékony gátlói ezért elengedhetetlenek a túléléshez, következésképpen alacsony és nagy molekulatömegű inhibitorok széles skálája található a keringésben. Az alacsony molekulatömegű inhibitorok közé tartozik a pirofoszfát és a citrát, míg a legerősebb inhibitorok a kis és közepes méretű fehérjék.
A tudás jelenlegi állapota
K-vitamin állapota és elégtelensége
Állatmodellek.
Az OC volt az első Gla fehérje, amelyről kiderült, hogy nem vesz részt a véralvadásban, és az első Gla fehérje, amelyet a májon kívül szintetizáltak (6–8). Figyelemre méltó, hogy az OC molekuláris szerepe homályos maradt> 30 évig. Tisztított OC-vel végzett in vitro kísérletek azt mutatták, hogy ez erősen gátolja a túltelített oldatokból történő kalcium-só kicsapódását (9). Az OC-hiányos állatoknál megnő a csontméret és magas a csont ásványianyag-tartalma (3). Ezért az OC-t negatív szabályozóként írták le a csontnövekedésről. Csak az inhibitorok kizárásával történő mineralizáció hipotézisének felvetése után derült ki, hogy az OC hogyan járulhat hozzá a hidroxi-apatit szabályozott lerakódásához a csontokban (5).
Az OC-vel ellentétben az MGP-hiányos egerek fenotípusa azonnal megmutatta az MGP funkcióját (4). Az MGP -/- állatok kisebbek voltak, mint heterozigóta alomtársaik, ami a hosszanti növekedést blokkoló epiphysis meszesedéséből származott. Sőt, az összes nagy artéria gyorsan meszesedett, ami a születés után 6–8 héten belül halált eredményezett. Az MGP szövetspecifikus expressziója a vaszkuláris simaizomsejtekben teljesen megakadályozta az artériás meszesedést; a máj MGP expressziója magas keringésben lévő MGP szintet eredményezett, az artéria meszesedésének megelőzését azonban nem (10). Ezek az adatok egyértelműen megmutatták, hogy az MGP a meszesedés helyi gátlója, és ezáltal kiegészíti a fetuin-A szisztémás hatását.
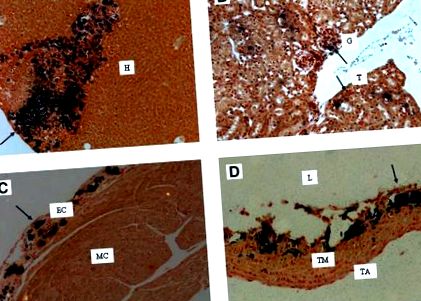
Az MGP-hiány hatásait utánozhatnánk úgy, ha rágcsálókat etetnénk warfarin és filokinon keverékét tartalmazó étrenddel. A warfarin + filokinon modell a filokinon májban történő előnyös eloszlásán alapul. A nagy dózisú warfarin és a viszonylag alacsony dózisú filokinon kombinálásával a véralvadási faktorok májszintézise fenntartható olyan szinten, amely megakadályozza a vérzést, és súlyos K-vitamin-hiányt váltanak ki minden extrahepatikus szövetben. Ennek a modellnek a fenotípusa összehasonlítható az epiphysis meszesedését és az súlyos artériás meszesedést mutató MGP-hiányos egerekével. Kezdetben a közölt modell napi injekciókat igényelt filokinonnal (11, 12), de laboratóriumunkban olyan rendszert dolgoztak ki, amelyben mind warfarin, mind filokinon adható az étrendben (13). A warfarin + filokinon étrenden lévő egerek meszesedéseit (fekete színnel, von Kossa festéssel vizualizálták) a 1.ábra . Az artériás meszesedések mellett súlyos meszesedéseket találtak más szövetekben, például a májban, a vesében és a szívben.
A warfarin + filokinon kezelés által kiváltott meszesedés. A meszesedések (von Kossa festéssel vizualizálták) DBA2 egér warfarinnal (3 mg/g) és filokinonnal (1,5 mg/g) 6 hétig táplálva. A, máj; B, vese; C, szív; D, aorta. A nyilak a meszesedés területeit jelzik. TA, tunica adventitia; EC, endocardium; H, hepatociták; G, glomerulus; L, lumen; MC, szívizom; T, tubulus; TM, tunika média. (C. Vermeer et al., VitaK, Maastrichti Egyetem, Hollandia, publikálatlan eredmények).
Az állatmodellek emberi megfelelői.
Az emberek MGP-hiányát Keutel-szindrómának nevezik, amely ritka autoszomális recesszív betegség, amelyet először 1971-ben írtak le (14). Az érintett alanyok súlyos porc-meszesedést, brachytelephalangizmust, perifériás tüdőartéria-szűkületet, halláskárosodást és arc-rendellenességeket mutatnak (azaz a középső felület hypoplasia és depressziós orrhídja). A Keutel-szindróma az MGP-t kódoló gén mutációihoz kapcsolódott, ami az MGP hiányához vagy nem funkcionális formáihoz vezetett (15, 16). Szembetűnő különbség az MGP-hiányos állatokkal szemben az, hogy az érrendszerre gyakorolt hatások kevésbé hangsúlyosak, és magyarázat lehet, hogy a GRP az MGP számára tartalék rendszert képez az emberekben, és nem az egerekben. A GRP-t a tokok porcában fedezték fel (17), de emlősökben is megtalálhatók, beleértve az embereket is (18). Funkcióját még nem állapították meg egyértelműen, de úgy tűnik, hogy összefügg a meszesedés gátlásával is (19).
Triage elmélet.
A filokinon preferenciális eloszlása a májban összhangban van a McCann és Ames által javasolt triage elmélettel (25). A természet biztosítja, hogy a nem optimális ellátásnál a vitaminokat és az ásványi anyagokat elsősorban a rövid távú túléléshez szükséges funkciókhoz használják. Mivel a leglényegesebb Gla-fehérjék karboxilezése a májban lokalizálódik, a kevésbé esszenciális Gla-fehérjéké pedig az extrahepatikus szövetekben, kialakult egy transzportrendszer, amely biztosítja a máj preferenciális célzását az alvadás megőrzése érdekében, ha az étrendi K-vitamin nem megfelelő. Csak a máj K-vitamin-elégtelensége, különösen a hosszú láncú menakinonok szállítják az extrahepatikus szövetekbe. Ezért a K-vitamin-elégtelenség első jeleit az extrahepatikus Gla fehérjék hiányos karboxilációjának tekintik. McCann és Ames arra a következtetésre jutottak, hogy a hosszú távú mikroelem-elégtelenségek kockázati tényezőt jelentenek az életkorral összefüggő betegségek sokféle kialakulásában, mint például az oszteoporózis, a szív- és érrendszeri betegségek (CVD) és a rák.
Az extracepatikus Gla fehérjék OC és MGP, amelyekre konformáció-specifikus teszteket fejlesztettek ki, jelentős alulkarboxilezést mutatnak olyan alanyokban, akik nem szednek K-vitamin-kiegészítőket. A közelmúltban leírták a karboxilezett GRP konformáció-specifikus tesztjét, amely megmutatta, hogy ez a fehérje részben nem karboxilezett formában is előfordul (M. Herfs, E. Smit, C. Viegas, S. Simes, C. Vermeer, VitaK, Maastrichti Egyetem, Hollandia, publikálatlan eredmények). Jelenleg nincs példa extrahepatikus Gla fehérje kimutatására, hogy teljes mértékben karboxilezett nem kiegészített egészséges egyéneknél. Arra a következtetésre jutunk, hogy a nyugati étrend nem tartalmaz elegendő K-vitamint az extrahepatikus szövetek, például a csont és az érfal követelményeinek megállapításához.
MGP, K-vitamin státus és meszesedés
Az MGP foszforilezési és/vagy karboxilezési állapota szerint különféle különféle fajokként létezik, ideértve a foszforilezett karboxilezett MGP-t (cGMP), a foszforilezett ucMGP-t (p-ucMGP), a dezfoszfo-karboxilezett mátrix Gla-fehérjét (dp-cMGP) és a dezfoszfo-karbonsav-észtert. Gla fehérje (dp-ucMGP). Sajnos jelenleg nincsenek rendelkezésre álló vizsgálatok az egyes keringő MGP fajok vagy akár a teljes keringő MGP készlet mérésére. A következőkben áttekintjük azokat a publikált cikkeket, amelyekben keringő MGP-fajokat - dp-ucMGP, dp-cMGP, összes karboxilálatlan mátrixú Gla-fehérjét (t-ucMGP) - használtak fel a lehetséges diagnosztikai hasznosságuk feltárására (lásd még: 1. és És2 2).
Asztal 1.
A keringő MGP (dp-ucMGP, dp-cMGP, t-ucMGP) és a meszesedés közötti összefüggések áttekintése 1
| Népesség, életkor | MGP fajok | MGP kategóriák | Meszesedési pontszám | Statisztika | ||
| 96 HT beteg, 53 év 2 | t-ucMGP (nmol/L) | 4361 ± 1111 | Érrendszeri meszesedés (a jelen pontozása/vese angiográfiával nincs jelen) | Korrelációs elemzés (P = 0,164) | ||
| 438 felnőtt, 68 éves (32) | dp-ucMGP (pmol/L) | 237 (52–330) 403 (335–462) 524 (464–599) 826 (604–2994) | 149 ± 50 263 ± 48 243 ± 49 235 ± 47 (CAC) | ANCOVA (P = 0,55) | ||
| 188 dializált beteg, 59 éves (29) | dp-cMGP (pmol/L) | 12% -kal alacsonyabb szint a magas pontszámú csoportban | 0–6 (alacsony) 7–15 (magas) Teljes meszesedés (medence + kéz + carotis) | t teszt (P = 0,011) | ||
| 36 HT beteg, 53 éves (30) | t-ucMGP (nmol/L) | 3471 (2031–4260) 4708 (4351–5215) 6126 (5416–9603) | 145 (0–1546) 111 (1–3866) 36 (0–5951) (CAC) | Kruskal-Wallis (NS) | ||
| 19 OAC-beteg, 48 éves (23) | dp-ucMGP (pmol/L) | 1439 ± 481 | Femoralis artéria meszesedése | Korrelációs elemzés (r = 0,59, P 3 (P 921 | 2,4 ± 2,9 4,4 ± 3,1 (AC) | t teszt (P4 OR = 0,73, P = 0,03) |
| 221 CVD-s beteg, DM-ben, 68 év (36) | t-ucMGP (nmol/L) | 3287 ± 1178 | Mitralis gyűrű alakú meszesedés | Logisztikai regresszió (OR = 1,29, P = 0,08; MV 4 OR = 1,89, P = 0,001) | ||
| 191 AVD-beteg, 71 éves (35) | t-ucMGP (nmol/L) | 320 400 | 1800 (OAC használat) 400 (OAC használat nélkül) (CAC) | ND | ||
| 40 HD beteg, 67 éves (34) | t-ucMGP (nmol/L) | 237 ± 66 174 ± 46 * 171 ± 66 ** | ≤103,0 (alacsony) 103,1–600,0 ≥600,1 (CAC) | Fisher pontos (* P = 0,022 és ** P = 0,021 az alacsony CAC pontszámhoz képest) |
2. táblázat.
A keringő MGP (dp-ucMGP, dp-cMGP, t-ucMGP) és a mortalitás közötti összefüggések áttekintése 1
| Népesség, életkor | MGP fajok | MGP kategóriák | Statisztika, CV halálozás | Statisztika, minden okból bekövetkező halálozás | |||
| 179 krónikus HF beteg, 56 év (28) | dp-ucMGP (pmol/L) | −2 SD −1 SD +1 SD +2 SD | Kaplan-Meier (P = 0,001) MV Cox regresszió 2 (HR = 5,62, P = 0,001) | Kaplan-Meier (P = 0,002) | |||
| 188 dializált beteg, 59 éves (29) | dp-cMGP (pmol/L) | 6139 | Kaplan-Meier (P = 0,003) MV Cox regresszió 3 (HR = 2,74, P = 0,015) | Kaplan-Meier (P = 0,008) MV Cox regresszió 3 (HR = 2,16, P = 0,027) | |||
| 147 AS beteg, 74 éves (27) | dp-ucMGP (pmol/L) | 950 | ND | Kaplan-Meier (P 4 (HR = 7,29, P = 0,002) | |||
| dp-cMGP (pmol/L) | 2400 | ND | Kaplan-Meier (P 3649 | Kaplan-Meier (NS 5) MV Cox regresszió 6 (HR = 0,65, NS 5) | Kaplan-Meier (P6 (HR = 0,48, P 921 | ND | Kaplan-Meier (P = 0,006) MV Cox regresszió 7 (HR = 1,57, NS) |
dp-ucMGP.
dp-cMGP.
Elméletileg ez a marker képezi a dp-ucMGP tükörképét, és 2 tanulmány jelent meg, amelyek a túléléssel való összefüggést vizsgálták. Ueland és mtsai. (27) megállapította, hogy az AS betegeknél, akiknél a dp-cMGP mediánszintje meghaladja, magasabb volt a kiigazítatlan halálozási arány, de a többváltozós modellben ezeknek az összefüggéseknek a jelentősége elveszett. Schlieper és mtsai. (29) 188 hemodializált (HD) beteg kohorszát vizsgálta, és fordított összefüggést talált a dp-cMGP és a kardiovaszkuláris (HR> 2), valamint az általános mortalitás (korrigált HR> 2) között. A keringő dp-cMGP szintje 12% -kal alacsonyabb volt a HD szabadalmakban, kiterjedtebb meszesedéssel (a teljes meszesedési pontszám 7–15), összehasonlítva a kevesebb meszesedéssel rendelkező HD betegekkel (a teljes meszesedési pontszám 0–6). Ezen adatok értelmezése során tisztában kell lenni azzal, hogy a dp-cMGP vizsgálat csak a közelmúltban vált elérhetővé, és csak korlátozott mértékben használták; érzékenysége is kisebb, mint a dp-ucMGP vizsgálaté.
t-ucMGP.
2 Használt rövidítések: AS, aorta stenosis; CAC, koszorúér-meszesedés; cGMP, karboxilezett mátrix Gla fehérje; CKD, krónikus vesebetegség; CVD, szív- és érrendszeri betegségek; dp-cMGP, dezfoszfo-karboxilezett mátrix Gla fehérje; dp-ucMGP, desfoszfo-karboxilálatlan mátrix Gla fehérje; GRP, Gla-ban gazdag fehérje; HD, hemodialízis; HF, szívelégtelenség; MGP, mátrix Gla fehérje; MK-7, menakinon-7; OC, osteocalcin; t-ucMGP, összes karboxilálatlan mátrix Gla fehérje; ucMGP, karboxilálatlan mátrix Gla fehérje; VKA, K-vitamin antagonista.
- Mit jelent a vitamin utáni levél az egészséges táplálkozás SF kapuja
- Mit csinál a B-vitamin
- Miért Ruth Bader Ginsburg az ALS példaképem - ALS News Today
- Miért Haley Lu Richardson szinte visszautasította; Öt láb távolságra; Szerep Hollywood Reporter
- Mi történik, ha allergiás a B12-vitaminra