A magas zsírtartalmú étrend megakadályozza az adaptív peripartummal összefüggő mellékvese plaszticitást és szorongást
Clara V. Perani
1 Magatartási és molekuláris neurobiológiai tanszék, Regensburgi Egyetem, Regensburg, Németország
2 Szülészeti és Magzati Orvostudományi Osztály, Kísérleti Feto-Anyai Orvostudományi Laboratórium, Egyetemi Orvosi Központ Hamburg-Eppendorf, Hamburg, Németország
Inga D. Neumann
1 Magatartási és molekuláris neurobiológiai tanszék, Regensburgi Egyetem, Regensburg, Németország
Stefan O. Reber
1 Magatartási és molekuláris neurobiológiai tanszék, Regensburgi Egyetem, Regensburg, Németország
3 Molekuláris Pszichoszomatika Laboratórium, Pszichoszomatikus Orvostudományi és Pszichoterápiás Klinika, Ulmi Egyetem, Ulm, Németország
David A. Slattery
1 Magatartási és molekuláris neurobiológiai tanszék, Regensburgi Egyetem, Regensburg, Németország
Társított adatok
Absztrakt
Az elhízás egyre növekvő közegészségügyi aggodalomra ad okot a modern társadalmakban 1, 2, és az anyák elhízása szerepet játszik a szülés utáni szorongás és a depresszió fokozott kockázatában 3, 4, 5. A megnövekedett fogékonyság hátterében álló mechanizmus azonban nem világos. A jelölt rendszer a hipotalamusz-hipofízis-mellékvese (HPA) tengely, amely a peripartum periódusában jelentős plaszticitáson megy keresztül. Tehát a terhesség és a szoptatás összefüggésben van a megnövekedett bazális glükokortikoid szintekkel (hiperkortikizmus; kortizol emberben; kortikoszteron patkányokban és egerekben), valamint az akut stresszorok 6, 7, 8, 9, 10 egyidejű hipo-válaszával. Úgy gondolják, hogy ezek az adaptációk evolúciós mechanizmusnak számítanak az anya megnövekedett energetikai igényeinek kielégítésére és az utódok védelmére a magas glükokortikoid szintektől. Sőt, feltételezik, hogy ezek az adaptációk hozzájárulnak a fokozott nyugalomhoz és a szorongás csökkenéséhez, amelyek a 11., 12. időszakra jellemzőek. A közelmúltban bebizonyosodott, hogy az elhízott anyáknál hiányzik ez a bazális plazma hiperkortikizmus 13, azonban az anyák elhízása és a peripartum HPA tengely adaptációja közötti kölcsönhatás fennáll-e, és hozzájárul-e a szülés utáni pszichiátriai rendellenességek fokozott kockázatához.
Eredmények
A mellékvesék plaszticitást mutatnak a peripartum időszakában
Annak eldöntésére, hogy a mellékvesék szerepet játszanak-e a HPA-tengely plaszticitásában a peripartum periódus alatt, összegyűjtöttük a plazma- és mellékvese-mirigyeket nulliparous patkányoktól és patkányoktól a peripartum periódusának különböző pontjairól. Először megerősítettük, hogy a reproduktív állapot mind a plazma ACTH-ra (F5,44 = 3,16, P = 0,017), mind a kortikoszteronra (F4,35 = 4,79, P = 0,004) hatott. Míg a bazális ACTH szint csak a laktációs napon (LD) 8 emelkedett (P 1a. Ábra), a kortikoszteron szint magasabb volt a vemhesség napjától (PD) 13-tól LD8-ig (P 1b. Ábra) a nullipáros patkányokhoz képest. Külön elemzésből kiderült, hogy a plazma kortikoszteron PD21-nél magasabb volt a nulliparous nőstényekhez képest (Mann Whitney U, P 1b. Ábra). A kortikoszteron szintjét az elválasztást követő 4 hetes (PW) csoportban külön kísérletben értékelték, és nem különböztek a nulliparous patkányoktól (jobb oldali panel 1b. Ábra). A nulliparus patkányok összehasonlítása a legnagyobb kortikoszteronszintet mutatta proestrousan, az ACTH változása nélkül (lásd az 1a. És b. Kiegészítő ábrát); megerősíti az átmeneti ACTH-kortikoszteron egyensúlyhiányt, amelyet a 20 esztikus ciklus során észleltek .
Mellékvese kérgi lipidcseppek (a) mennyiségét nulliparous (N) patkányokban és állatokban határoztuk meg a vemhesség napján (PD) 4, PD13, PD21, laktációs napon (LD) 8 és 4 héttel az elválasztás után (PW). Reprezentatív képek (b) beszámoltak festett mellékvese-szakasz N és LD8 állatokról (2,5 és 20-szoros nagyítás). Az adatok jelentik az átlagot + SEM (a zárójelben lévő számok az n számot jelentik). A statisztikai szignifikanciát egyirányú ANOVA alkalmazásával, majd Bonferroni post-hoc teszttel határoztuk meg. *** P 3a. És P 3b. Ábra), és azt mutatják, hogy a HFD (ACTH: F20,1 = 4,3, P = 0,05; kortikoszteron: F20,1 = 4,57, P = 0,045) eltörölte ezeket a hatásokat (ACTH: HFD-gát vs. NFD-gát P 3a. Ábra). Sőt, míg a stressz-ekvivalens intravénás (iv) ACTH injekció után 5 perccel elért csúcs ACTH-szintek a csoportok között nem különböztek egymástól (3c. Ábra), a kortikoszteronszintek érintettek voltak (faktorállapot × diéta: F1,18 = 4,94, P = 0,039). Részletesen, a HFD-gátak túlzott kortikoszteron-választ mutattak az NFD-gátakkal összehasonlítva (P 3d ábra) 5 perccel az iv. ACTH beadása után. Fontos, hogy azt is feltárhatnánk, hogy a HFD megakadályozta a laktációval összefüggő szorongásos reakciókat, de nem befolyásolta a szorongással kapcsolatos viselkedést a nullpáros állatoknál. Konkrétan, a laktáció által kiváltott szorongás-vizsgálatot megerősítették, mivel a reproduktív állapot befolyásolta a késést, hogy visszatérjen a világos-sötét doboz megvilágított kamrájába (F1,25 = 5,79, P = 0,024; 3e. Ábra), a megvilágított kamra számához. bejegyzések (F1,24 = 20,0, P 3f ábra), és a megvilágított kamrában történő nevelés (F1,25 = 5,17, P = 0,032; 3g ábra). Valóban, az NFD-gátak gyorsabban jutnak be a megvilágított kamrába (P ## P # P $ P ≤ 0,001 laktáló HFD vs. nulliparous HFD.
A HFD megváltoztatja a laktációval összefüggő mellékvesék plaszticitását
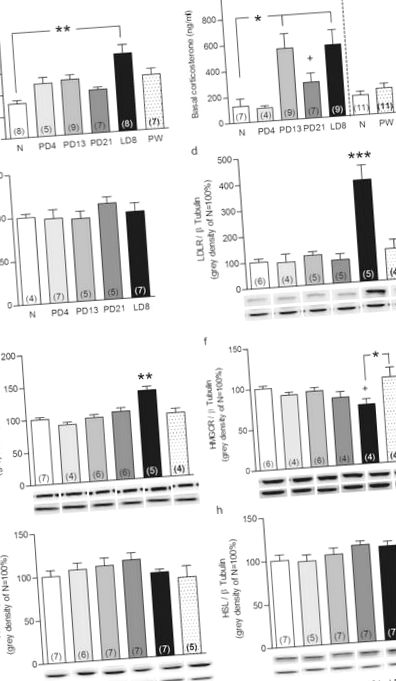
Annak eldöntésére, hogy a HPA tengely (újraktivitás) ezen HFD által kiváltott változásai tükröződtek-e a mellékvese szintjén, ezt követően értékeltük a HFD hatását a mellékvese plaszticitására LD8 esetén. Mindkét reproduktív állapot (F3,20 = 26,4, P 4a ábra). Pontosabban az LDLR fehérje laktáció által kiváltott növekedését újból megerősítették (NFD P 4a. Ábra). Az SRB1 fehérje expressziójának laktációval összefüggő növekedését azonban a HFD nem befolyásolta (F3,22 = 69,6, P 4b ábra). A HMGCR fehérje szintjének laktáció által kiváltott csökkenését (F3,23 = 5,26, P = 0,002; NFD, P 4c. Ábra) eltörölte a HFD is. Sem a reproduktív állapot, sem az étrend nem befolyásolta az ACTH-receptor kötődést, az ACAT vagy a HSL mellékvese fehérje expresszióját (lásd a 4a – c. Kiegészítő ábrát). A mellékvese lipidkészleteinek laktációval összefüggő csökkenése (faktorállapot × diéta: F3,25 = 19,9, P 4d, f ábra). Ezek az eredmények azt mutatják, hogy a HFD befolyásolja a normális mellékvese plaszticitását a laktáció közepén, és így feltételezhetően hozzájárul az in vivo HPA tengely (újra) aktivitásának megváltozásához.
Mellékvese LDLR (a), SRB1 (b), HMGCR (c) fehérje expresszió és kortikális lipid cseppek (d) semleges és szoptató patkányokban normális zsírtartalmú étrendet (NFD) és HFD-vel táplált patkányokat jelentettek. Az adatok jelentik az átlagot + SEM (a zárójelben lévő számok az n számot jelentik). Valamennyi fehérje sáv normalizálódott β-tubulinra ugyanabban a membránban. Reprezentatív blotok (e) az érdekes fehérjékről és a terhelés-ellenőrzésről, valamint a képekről (f) a festett mellékvese szakaszok (20-szoros nagyítás). A teljes hosszúságú blotokat a kiegészítő nem szerkesztett gélek 4. ábra fájljában mutatjuk be. A statisztikai szignifikanciát kétirányú ANOVA alkalmazásával határoztuk meg, amelyet Bonferroni post-hoc teszt követett. *** P ### P ≤ 0,001, szemben a szoptató NFD-gátakkal.
Vita
Jelen tanulmányban először arról számolunk be, hogy az a három út, amely a mellékvese szabad koleszterinellátásához vezet, vagyis a plazma lipoproteinekből való felvétel, a de novo szintézis és az intra-adrenalis raktárak mobilizációja, lényegesen alkalmazkodnak a peripartum időszakában . Ezen túlmenően ezen változások többségét, valamint a laktációval összefüggő bazális hiperkortikizmusokat, az akut stresszre adott válaszkészség csökkenését és az anyák szorongásos kezelését megakadályozzák a HFD-nek való kitettség. Ezek a változások a peripartum periódusra voltak jellemzőek, mivel a HFD nem befolyásolta ezeket a paramétereket nulliparous patkányokban. Összességében megállapításaink alátámasztják a mellékvese fő szerepét a HPA tengely működésének peripartummal összefüggő változásaiban, és hogy a mellékvese plaszticitásának megelőzése, például az elhízás, növelheti a szülés utáni pszichopatológiák, például a szorongás kialakulásának kockázatát.
Kimutatták, hogy a szteroidogén gének, köztük a Star és a Cyp11A1 mellékvese mRNS-expresszióját 60% -os HFD befolyásolja 23 egerekben, ami arra utal, hogy a HFD ezen a szinten zavarhatja a mellékvese működését. Míg azonban a Star, de a Cyp11A1, mRNS expressziójának átfogó reprodukciós státus-hatását találtuk, a HFD nem befolyásolta ezeket a paramétereket. Eredményeink arra utalnak, hogy a Star mRNS szintje magasabb a laktáció alatt, de post-hoc összehasonlítások nem értek el szignifikanciát. Ezért lehetséges, hogy a koleszterinellátás után a peripartum periódus alatt változások következnek be (Kiegészítő adatok és 2. táblázat), amelyeket a későbbi tanulmányokban értékelünk.
A viselkedés és a HPA tengely funkciójának változásai specifikusak voltak a szülés utáni időszakra, mivel a HFD nem befolyásolta ezen paraméterek egyikét semleges állatokban. Ezek a HFD által kiváltott változások együttesen a mellékvese koleszterin-hozzáférhetőségének általános növekedését jelzik, amely valószínűleg a bazális hiperkortikizmus hiányának tudható be, és részt vesz a HFD-gátakban észlelt fokozott akut stressz-válaszban.
Összefoglalva, bebizonyítottuk, hogy a mellékvesék plaszticitása meghatározó szerepet játszik az anya fiziológiájában. Valójában az ilyen plaszticitás HFD-vel történő megakadályozása megváltoztatja a bazális HPA tengely működését, a túlzott stresszválaszt és az anyai szorongás megszüntetését. Tehát, mivel a peripartum HPA tengely plaszticitása interferenciáról ismert, hogy szerepet játszik számos szülés utáni rendellenesség etiológiájában, anyai elhízással történő megelőzésük hozzájárulhat az elhízott nők fokozott fogékonyságához az ilyen rendellenességek iránt.
Anyagok és metódusok
Állatok
A Wistar nőstény patkányokat (200–250 g, Charles River, Sulzfeld, Németország) egy hétig zavartalanul hagyták a normál (3-4 patkány) csoportos tartási és környezeti (12 óra világos-12 óra sötét, a fények 06-kor világítottak) megérkezésük után.: 00, 22 ± 1 ° C, 60 ± 5% páratartalom). Az állatokat minden kísérlet során szokásos táplálékkal (normál táplálék - NFD; 10% zsír; Ssniff, Németország) etettük, kivéve a HFD vizsgálatokat, ahol az állatok NFD-t vagy HFD-t kaptak (45% zsír, Research Diets Inc., U 24) két héttel a párzást megelőzően kezdődik a kísérlet végéig. Az összes kísérleti eljárást, amelyet 08: 00–12: 00 között hajtottak végre, jóváhagyta az oberfalusi önkormányzat Állat-egészségügyi és Gondozási Bizottsága, és megfelelt az állatok etikai használatáról szóló nemzetközi irányelveknek.
Kísérleti eljárások
Az ösztrikus ciklushoz kapcsolódó adaptációk
Nulliparous patkányokat lefejeztek (08: 00–11: 00) négy napos egyszeri tartás után, és hüvelyi keneteket gyűjtöttek a három kísérleti csoport meghatározása céljából: di-/metestrous, proestrous és estrous; desztesztikus és metestros nőstényeket egyesítettük, mivel az ACTH és a kortikoszteron szintje már hasonlónak bizonyult ebben a két csoportban 20. A törzsvért és a mellékveséket összegyűjtötték és feldolgozták (lásd: Módszerek szakasz). Eleinte a testoldali specifikus mellékvese adaptációkat 25 értékelték; miután kimutatták, hogy a bal és a jobb mellékvese között egyetlen érdeklődési paraméter sem különbözik egymástól (lásd az 1. kiegészítő táblázatot), az ösztrikus ciklus vizsgálatát a bal mellékveseiben végezték el.
Peripartummal társult mellékvese-adaptációk
A patkányokat időzítettük (lásd: Módszerek szakasz), hogy a következő egyidejű patkánycsoportokat hozzuk létre: nulliparous (beleértve az észter ciklus kísérletéből származó di-/metestrous-ot), PD4, PD13, PD21, LD8 és 4 hetes PW. A koraszülött nőstényeket kizártuk, mivel az ösztrikus ciklus vizsgálata a bazális kortikoszteron markáns proestrózissal összefüggő növekedését tárta fel (lásd 1. kiegészítő ábra). A bal és a jobb mellékvese-méréseket minden csoportban összevontuk, mivel egyetlen paraméternél sem észleltünk mellékhatást. Az állatokat négy nappal a szövetgyűjtés előtt, az LD8 állatok kivételével, egyedül tartottuk, amelyeket négy nappal az előre jelzett szülés (PD17) előtt hoztunk, hogy lehetővé tegyük az utódok zavartalan születését és szoptatását. Az elválasztás után a PW-gátakat négy napig csoportos elhelyezésben tartották, mielőtt a mellékvesék és a törzs vére összegyűlt volna az előzőekben leírtak szerint 26 (lásd a Módszerek szakasz).
A HFD hatása a viselkedésre és a HPA tengelyre
A Nulliparous és az LD8 NFD-t és a HFD-t tesztelték a szorongással kapcsolatos viselkedés szempontjából a világos-sötét dobozban (lásd: Módszerek szakasz) az LD3-on és a HPA tengely (újra) aktivitását az LD8-on. Valamennyi állatot PD17-en, vagy azzal egyenértékűen, egynemű állatokban helyeztük el.
A HFD hatása a mellékvese plaszticitására
A mellékvesék plaszticitására gyakorolt HFD hatását nulliparous és LD8 NFD és HFD állatoknál vizsgálták. A törzsvért és a mellékveséket összegyűjtötték és feldolgozták (lásd: Módszerek szakasz). Valamennyi állatot PD17-en, vagy azzal egyenértékűen, egynemű állatokban helyeztük el.
Mód
Idő-párosítás és a terhesség ellenőrzése
Minden vizsgálatban nőstény patkányokat pároztunk (hímenként két-három nőstény), és a vemhességet hüvelyi kenetekkel (PD0 jelöléssel) igazoltuk. Az LD0-ként meghatározott szülés után a kölyköket négy nőstényre és négy hímre vetették ki alomonként, mivel bebizonyosodott, hogy az alom összetétele befolyásolhatja az anyai viselkedést 27 .
ACTH és kortikoszteron mérések
A plazmát a törzs véréből izoláltuk (5000 rcf, 10 perc, 4 ° C), alikvotokban -20 ° C-on tároltuk, míg az ACTH-t és a kortikoszteront kereskedelmi forgalomban kapható ELISA készletekkel (IBL International GmbH, Németország - kortikoszteronkészlet vizsgálati tartomány: 1,63) mértük. –240 nmol/L, ACTH kit assay érzékenység: 0,22 pg/ml).
Szervkészítés
Az ösztrikus ciklus minden egyes bal és jobb mellékveseit, valamint a peripartummal összefüggő mellékvese alkalmazkodási vizsgálatokat lemértük és félbevágtuk. Ezt követően az egyik felet védő fagyasztóközegbe (Tissue-Tek) ágyazottuk be, a másikat pedig folyékony nitrogénben gyorsfagyasztottuk, majd -80 ° C-on tároltuk krio-vágás vagy Western blot elemzés céljából. Beágyazás után a mellékvesék középső részéből származó, 16 μm-es krio-szakaszok sorozatát, amely tartalmazza mind a kéreget, mind a velőt, levágták, majd felolvasztva szerelték fel őket előre bevont tárgylemezekre (tárgylemezenként hat szakasz). Mivel az eddig leírt kísérletek során nem észleltek mellékkülönbségeket, a HFD vizsgálat bal mellékveseit fagyasztó közegbe ágyazta krio-metszés céljából, a jobb mellékveséket pedig fagyasztva fehérje izolálás céljából.
Olajvörös lipidfestés
A mellékvese krio-szakaszait olaj-vörös-O-val festettük a mellékvesék lipidcsepp-koleszterin készletének mennyiségi meghatározása céljából, a 18., 28. korábban leírtak szerint. Mellékveseenként hat metszetet festettünk, fényképeztünk és számszerűsítettünk. A mellékvese szakaszokat két képzeletbeli vonalon osztottnak tekintettük, amelyek a mellékvese közepén kereszteződtek 18, 28. Mindegyik területről 5x-es nagyítású mikroszkópos képet gyűjtöttünk a Leica V4 képgyűjtő program segítségével. Ezt követően állatonként a hat mellékvese szelet mindegyikéből egy képet elemeztek, és a statisztikai elemzéshez a hat mérésből számított átlagot használták. Az olajvörös pozitív területet (mm 2) a zona fasciculata és a zona reticularis belül, valamint e két kérgi zóna teljes területét (mm 2) a Leica FW4000 szoftver (Leika Microsystems, Németország) segítségével mértük, és a kettő közötti arányt számított. A mellékvese medulla és a glomerulosa, mindkettő könnyen megkülönböztethető a 29. szemmel, nem vették figyelembe ebben az elemzésben, mivel a kortikoszteron szintézisben részt vevő fő mellékvese zónák a fasciculata és a reticularis 30 .
ACTH receptor autoradiográfia
Az ACTH receptor autoradiográfiát állatonként hat mellékvese szakaszon végeztük, lineáris ACTH receptor antagonista [125 I] ACTH, (1–39) Tyr23 nyomjelzőként (PerkinElmer, USA), a korábban leírtak szerint 31. Részletesen, állatonként hat mellékvese szakaszt felolvasztottunk, szárítottunk és két percig fixáltunk 0,1% paraformaldehidben szobahőmérsékleten. Két 10 perces mosási lépés után 50 mM Tris-ben a metszeteket 60 percig kitettük a nyomjelző pufferbe (50 mM nyomjelző, 10 mM MgCl2, 0,1% BSA), majd háromszor mostuk Tris 50 mM, MgCl2 10 mM pufferben. A tárgylemezeket ezután vízbe mártottuk, levegőn szárítottuk és 90 napig Biomax MR filmeknek tettük ki.
ImageJ 1.47-et alkalmaztunk a receptor-kötődés mérésére, szürke sűrűségben kifejezve, és a háttérszignált kivontuk a nem-specifikus kötődés kontrollja érdekében.
Western blot elemzés
Szorongással kapcsolatos viselkedés
A világos-sötét dobozt a szorongással kapcsolatos viselkedés értékelése céljából LD3-on vagy azzal egyenértékűen nullapáros patkányokon végeztük, a 32., 33. korábban leírtak szerint. A kísérleti beállítás egy megvilágított (40 × 50 cm, 350 lux) és egy sötét (40 × 30 cm, 70 lux) rekeszből állt, amelyek egy kis nyíláson keresztül (7,5 × 7,5 cm) voltak összekötve, lehetővé téve az átmenetet a rekeszek között az 5 perc alatt tesztelje a patkányokat, amelyeket a megvilágított rekeszbe helyeznek a nyílással szemben. Az egyes rekeszek padlóit négyzetekre osztották (10 × 10 cm). A sötét kamra első bejegyzésének késleltetését, a megvilágított kamra első bejutásának késését, a megvilágított kamra bejegyzéseit és a háttértárakat használtuk a szorongással kapcsolatos viselkedés értékelésére. A vonalkeresztezések számát a mozgásszervi aktivitás mutatójaként mértük 32 .
Juguláris katéter és vérvétel
LD4-re juguláris véna katétert ültettek be izoflurán érzéstelenítésben, a 7., 34. leírás szerint, és vérmintát vettünk LD7-en vagy LD8-on. Két órával a világítás után, és legalább 90 perccel azután, hogy a katétert heparinizált sóoldattal (30 NE/ml) töltött csőhöz csatlakoztatták, egy alapmintát vettünk. 30 perccel később egy második alapmintát gyűjtöttünk biztonsági másolatként. Harminc perccel a második alapminta összegyűjtése után ACTH-t (0,1 ml, hogy a végső stressz-függő vérkoncentráció kb. 500 pg/ml legyen 35) iv-be injektáltuk a katéteren keresztül, és a vérmintákat 5, 15, 30, 60 és 120 percen keresztül gyűjtöttük be. injekció után. Minden mintához 0,25 ml vért vettünk, és azonnal helyettesítettük steril 0,9% -os sóoldattal. Módszertani problémák miatt egy nulliparous NFD és egy nulliparous HFD eltávolításra került a kortikoszteron analízisből.
Statisztika
Az eredményeket egy- vagy kétirányú ANOVA alkalmazásával elemeztük, ismételt mérésekkel vagy anélkül, adott esetben Bonferroni páros poszt-hoc összehasonlításokkal. A P statisztikai szignifikanciáját elfogadtuk (2,3M, pdf)
Köszönetnyilvánítás
A szerzők köszönetet mondanak Andrea Füchslnek és Nicole Uschold-Schmidtnek a kiváló technikai segítségért és a tudományos megbeszélésekért. Pénzügyi nyilvánosságra hozatal: A jelen munkát a Német Kutatási Alapítvány (DFG SL141/4-1: DAS, IDN; DFG RE2911/5-1: SOR) és a Bajor Kutatási Alapítvány (IDN; CVP) finanszírozta. A finanszírozóknak nem volt szerepük a tanulmányok tervezésében, adatgyűjtésben és elemzésben, a közzétételre vonatkozó döntésben vagy a kézirat elkészítésében.
- Az alacsony szénhidráttartalmú, magas zsírtartalmú étrend nem biztos, hogy a legjobb a terhességi cukorbetegség számára
- A magas zsírtartalmú étrend a zsírégetés titka The Independent The Independent
- Az anyák magas zsírtartalmú étrendjének hatása az anyagcsere-kihívásokhoz való alkalmazkodásra férfi és női fiatalkorúaknál
- A hőkezelt, magas zsírtartalmú étrend módosítja a bél mikrobiotáját és az anyagcsere markereit az apoe− egerekben Táplálkozás;
- Magas zsírtartalmú étrend antibiotikumokkal, amelyek a bél gyulladásához kapcsolódnak