Az anyák magas zsírtartalmú étrendjének hatása a metabolikus kihívásokhoz való alkalmazkodásra férfi és női fiatalkorú fiatalkorúakban
Cadence True
1 Kardiometabolikus Egészségügyi Osztály, Oregoni Nemzeti Prímkutató Központ, Beaverton OR
Tyler Dean
1 Kardiometabolikus Egészségügyi Osztály, Oregoni Nemzeti Prímkutató Központ, Beaverton OR
Diana Takahashi
1 Kardiometabolikus Egészségügyi Osztály, Oregoni Nemzeti Prímkutató Központ, Beaverton OR
Elinor Sullivan
2 Idegtudományi Osztály, Oregoni Nemzeti Prímkutató Központ, Beaverton OR és Humán Élettani Tanszék, Oregoni Egyetem, Eugene OR
Paul Kievit
1 Kardiometabolikus Egészségügyi Osztály, Oregoni Nemzeti Prímkutató Központ, Beaverton OR
Társított adatok
Absztrakt
CÉLKITŰZÉS
Határozza meg, hogy az anya zsírtartalmú étrendjének (HFD) fogyasztása nem emberi főemlősökben megváltoztatja-e az utódok képességét, hogy anyagcserében alkalmazkodjanak a tápanyag és a kalória kihívásaihoz.
MÓD
A kontroll étrenddel vagy a HFD-vel táplált japán makákó gátak utódait elválasztottuk egy kontroll étrendbe, két csoportot létrehozva: anyai HFD (mHFD, n = 18) és anyai kontroll étrend (mCTR, n = 12). A hím és nőstény utódokat 5 napos, 30% -os kalória-korlátozásnak és 35 napos magas zsírtartalmú étrendnek (HFD) tették ki, 16, illetve 24 hónapos korban. Mértük a kalóriabevitelt, a testsúlyt és az energiafelhasználást.
EREDMÉNYEK
Mindkét csoport utódai hasonló testtömeget, táplálékfelvételt és anyagcsere-alkalmazkodást mutattak az 5 napos kalóriakorlátozáshoz képest. az mHFD utódok fokozott táplálékfelvételt és korai súlygyarapodást mutattak válaszul egy 35 napos HFD-kihívásra; azonban a csoportos súlykülönbségek eloszlottak a kihívás során. Az mCTR állatokkal ellentétben az mHFD csoportban jelentősen megnőtt az éhomi inzulin az akut HFD expozíció után.
KÖVETKEZTETÉSEK
A jelenlegi eredmények azt mutatják, hogy az anyai HFD-nek kitett utódok nagyrészt hasonló metabolikus alkalmazkodást mutatnak a kalória-korlátozáshoz, mint az anyai kontroll étrendnek kitett utódok, de késleltetett alkalmazkodás akut HFD-kihívásnak kitéve.
Bevezetés
A gyermekkori elhízás hosszú távon káros hatással van az anyagcsere egészségére. Az elhízás kialakulása korai életkorban azt jelzi, hogy ezek az egyének valószínűleg életük jelentős részében metabolikus rendellenességektől szenvednek. Ezenkívül a súlycsökkentő beavatkozások többségének alacsony hatékonysága van, és a súly visszanyerése hosszú távon (1–3) gyakori, ami egy életen át tartó küzdelmet eredményez az elhízással. Számos tényező járul hozzá a gyermekkori elhízás növekvő gyakoriságához, többek között a magas zsírtartalmú és magas cukortartalmú étrend elérhetősége és a testmozgás csökkenése (4). Az anyák elhízását olyan tényezőként is felfogják, amelyek hozzájárulnak az utódok gyermekkori elhízásához (5–10). Tekintettel arra, hogy az Egyesült Államokban a nők 38% -a elhízott (11), az anyai elhízás valószínűleg jelentős és elterjedt kockázati tényezőt jelent a jövő generációi számára.
Mód
Állatok, anyai/szülés utáni étrend és testtömeg
Energia kiadások
Közvetett kalorimetriát végeztünk a kalória-korlátozás és a HFD-kihívások előtt és alatt, valamint a kalória-korlátozás után 7 nappal az előzőekben leírtak szerint (17, 23, 24). A majmokat 15 órán át akklimatizáltuk, majd 24 órán át metabolikus méréseket gyűjtöttünk. A majmokat reggel (0900h) banánnal etették, és délután (1400h) korlátlanul hozzáférhettek a szokásos étrendjükhöz; a víz ad libitum volt. Egy ismerős majmot helyeztek el a majommal szemben, amelynek anyagcsere-tesztje volt, hogy megakadályozzák a társadalmi elszigeteltséget. Az elemzéshez a hő (kcal/hr) és a légzési hányadosok (RQ, VC02/VO2) Oxymax szoftver számítását használtuk.
Kalória korlátozás kihívás
Az állatok kalória-korlátozáson esnek át körülbelül 16 hónapos korukban. A kísérlet előtt az állatokat egy éjszakán át éheztetett vérvétel céljából nyugtattuk és lemértük. Az állatokon először átesett a bazális közvetett kalorimetriás vizsgálat, és az elkövetkező öt napra az egyedi alapszintű kalóriabevitelük körülbelül 30% -ára korlátozták őket. Az ötödik és utolsó napon megismételtük a közvetett kalorimetriás tesztet. Az állatokat ezután ad libitum hozzáféréssel kapták az élelemhez, és 7 nap múlva újra tesztelték őket közvetett kalorimetriára, ami a „visszapattanás” időpontot jelöli.
HFD Challenge
Nagyjából 24 hónapos korban az állatoknak kiindulási vizsgálatokat végeztek, beleértve a glükóz tolerancia teszteket és az indirekt kalorimetriát. Öt napon át mértük a kiindulási CTR táplálékfelvételt, majd az állatokat átállítottuk a HFD-re, és az élelmiszer-fogyasztást mértük a 35 napos fertőzés első 15 napján. A HFD-fertőzés 15–35. Napja között ismét metabolikus intézkedéseket gyűjtöttünk, beleértve az anyagcsere-kamrában végzett indirekt kalorimetriát kb. 16–24. Napon a HFD-provokációban, és a glükóztolerancia-vizsgálatokat a HFD-provokációba bekövetkező 30–35. korábban (20).
Automatizált táplálékfelvétel mérések
A táplálékfelvételt a HFD-provokáció során egy automatizált élelmiszer-adagoló rendszer (Med Associates, Inc., St. Albans, VT) alkalmazásával mértük csoportosan elhelyezett utódokban, a korábban leírtak szerint (17). Az állatokat a csuklójukba korábban beültetett AVID mikrochipekkel azonosítottuk (Avid Identification Systems, Inc., Norco, CA). Feljegyeztük a karhúzások számát és az egyes húzásokhoz tartozó állatokat, és ezeket használtuk a kalóriabevitel kiszámításához. Ezt a módszert korábban validálták a csoportban elhelyezett NHP-kben (25), de ez közelítést jelent, mivel az állatok nem fogyaszthatják az egyes kiadott pelleteket. Az utódoknak CTR étrendet adtak elő [(TestDiet 5052, Primate Tablet # 1814687, 5AP7, Richmond, IN) vagy HFD (TestDiet TAD 5L0P, Primate Tablet # 1814863, 5ASN)] ad libitum.
Hormonvizsgálatok
Az inzulin és a leptin plazmakoncentrációit az Endocrine Technologies Support Core (ETSC) mértük az Oregoni Nemzeti Príma Kutatóközpontban (ONPRC) a GTT-nél gyűjtött éhomi vérmintákból. Az inzulin koncentrációit kemilumineszcencia alapú automatikus klinikai platform (Roche Diagnostics Cobas e411, Indianapolis, IN) alkalmazásával határoztuk meg; ezt a vizsgálatot korábban nem főemlősöknél alkalmazták (26). Az inzulin tartománya 0,2 - 1000 uIU/ml volt, az intra- és inter-assay variációk kevesebb, mint 7%. A leptin koncentrációkat radioimmun vizsgálattal (Millipore HL-81K, Billerica, MA) mértük, ahogyan azt a nem emberi főemlősökre korábban leírtuk (27). A vizsgálati tartomány 0,78–100 ng/ml, az intra- és az inter-assay variációk pedig 13,9% és 24,7% voltak.
Statisztika
Az adatokat SPSS-ben elemeztük, kivéve a görbe alatti területet, amelyet a Prism GraphPad-ban számítottunk ki. Az adatokat normalitás szempontjából ellenőriztük, és a log10-t átalakítottuk, hogy a normális korrekciót végezzük, amikor csak lehetséges. Egyetlen időpontra lineáris modellanalízist végeztünk az anyai étrend fő hatásának vizsgálatára. A longitudinális adatokat vegyes modellekkel, ismételt mérések elemzésével elemeztük, és elemeztük az anyai étrend főbb hatásait, az időt és azok kölcsönhatását. Annak érdekében, hogy megvizsgáljuk a dózis életkorának és súlyának a fogantatáskor, valamint az utód nemének az anyai étrend és az eredményváltozók közötti összefüggésre gyakorolt hatását, ezeket a változókat mindkét elemzési típusban potenciális kovariátorként értékeltük. A végső párhuzamos modellt a visszamenőleges kiválasztással határoztuk meg. Bármely kovariátot, amelynek fő hatása p-értéke kevesebb, mint 0,1, a modellben hagytak, és a szövegben jelentést tettek a jelentős megállapításokra. Az összes grafikon a Prism GraphPad alkalmazásban készült.
Eredmények
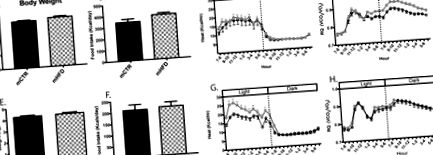
Alapvető anyagcsere-élettan 16 és 24 hónapos korban
Az mCTR és mHFD állatok metabolikus profilja 16 (A – D) és 24 (E – H) hónapos korban. A testtömeget (A, E), a táplálékfelvételt (B, F), a hőmennyiséget (kcal/óra; C, G) és a légzési hányadost (RQ, VCO2/VO2; D, H) mérték az indirekt kalorimetria során a 16. hónapban. életkor (felső panel) és 24 hónapos életkor (alsó panel) közvetlenül az anyagcsere-kihívások előtt. * Statisztikailag szignifikáns különbséget jelöl az mCTR és az mHFD éjszakai átlagos RQ között. mCTR n = 12, mHFD n = 16–18.
Kalória korlátozás kihívás
A kalória-korlátozás hatása a HFD-t fogyasztó utódokra. Az utódok külön csoportját mCTR vagy mHFD körülményeknek tették ki, majd az összes utódot elválasztás utáni időszakban HFD-re választották (pHFD). A BW (B) változásának meghatározása érdekében megmértük a kalória korlátozás előtti kezdeti testsúlyt (A), valamint a HFD kalória korlátozás utolsó napjának testtömegét. Az átlagos napi táplálékfelvételt a közvetett kalorimetriás kamrában mértük közvetlenül a kalória-korlátozás (kiindulási érték) előtt, a kalória-korlátozás utolsó napján és 7 nappal később (Rebound; C). A közvetett kalorimetriát az alapvonalon, a kalóriakorlátozás során, valamint a visszapattanás és az óránkénti grafikonok segítségével mutatjuk be a hő (kcal/óra, D – F) és a légzési hányados (RQ, G – I) értékét. * statisztikailag szignifikáns különbséget jelöl az mCTR alapvonaltól, # statisztikailag szignifikáns különbséget jelöl az mHFD kiindulási értéktől. mCTRpHFD n = 5–6, mHFDpHFD n = 5–9.
HFD Challenge
Körülbelül 24 hónapos korban az elválasztás utáni CTR utódokat 35 napig HFD-nek tették ki annak megállapítására, hogy az anyai HFD-fogyasztás növeli-e az érzékenységet a HFD-expozíció káros hatásaival szemben az élet későbbi szakaszaiban, ahogy azt rágcsálóknál megfigyelték (28, 29). Az első 15 napban a csoportosan tartott állatok automatizált táplálékbeviteli mérései az anyai HFD jelentős hatását mutatták ki a HFD kalóriafogyasztás növelésére (anyai étrend F1,26 = 8,02, p. 5A ábra). Az átlagos napi táplálékfelvételt azokra a napokra számították ki, amikor az összes állat mérése rendelkezésre állt, és hasonlóan a HFD-fogyasztás szignifikáns növekedését mutatta ki az mHFD csoportban (mCTR: 2,85 log kcal/nap n = 12, mHFD 3,01 log kcal/nap n = 18, p. 5B. ábra). Az mHFD csoportban a kalóriafogyasztás kezdeti mérsékelt növekedésével összhangban megnőtt a súlygyarapodás a kísérlet 8. napján (mCTR: 2,4%, n = 12; mHFD: 6,7%, n = 18, p = 0,02; 5C) és az anyai étrend általános hatásának tendenciája (anyai étrend F1,28 = 4,02, p = 0,06; vegyes modell a gát súlyához igazítva a fogantatáskor p 6. ábra). Az energiafogyasztási intézkedések változásainak nagysága azonban csoportonként kissé eltér. Az RMR emelkedett a kiindulási érték és a HFDC között az mHFD csoportban (mHFD: kiindulási érték 0,77 log kca/óra, HFDC 0,87 log kcal/óra, n = 18, p. 6A és B ábra), de mCTR állatoknál nem. Hasonlóképpen, a TEE nőtt az alapvonal és a HFDC között az mHFD csoportban (mHFD: kiindulási érték 344 kcal/nap, HFDC 387 kcal/nap, n = 18, p = 0,02; vegyes modell a nemhez igazítva p = 0,01; 6A és C ábra), de nem az mCTR csoport. A HFDC során mindkét csoport a nappali RQ csökkenését mutatta (mCTR: kiindulási érték 0,84, HFDC 0,81, n = 12, p 6D és E ábra; vegyes modellhez igazított nem p 6D és F ábra).
Energiafelhasználás és üzemanyag-oxidáció a HFD-kihívás (HFDC) során. Óránkénti hőérték a HFD-vizsgálat alatt (A) és a nyugalmi anyagcsere sebessége (átlag kcal/óra 0100–0500 között; B) és az összes energiafelhasználás (kcal/óra összege 0800–0700 között; C). Az RQ óránkénti értéke HFDC (D) alatt és az átlagos nappali (E) és éjszakai RQ (F) kiszámítása. * statisztikailag szignifikáns különbséget jelöl az mCTR alapvonaltól, # statisztikailag szignifikáns különbséget jelöl az mHFD kiindulási értéktől. mCTR n = 12, mHFD n = 18.
Intravénás glükóztolerancia teszteket (ivGTT) végeztek közvetlenül a HFDC (kiindulási érték) előtt és a 35 napos HFDC utolsó öt napja alatt (7. ábra). Az éhomi glükózszintek nem különböztek az mCTR és az mHFD csoportok között sem a kiindulási értéknél, sem a HFDC végén (7A. Ábra). Az éhomi inzulin szignifikánsan megemelkedett a kiindulási érték és a HFDC között az mHFD csoportban (mHFD: kiindulási 0,45 log ug/ml, HFDC 0,78 log ug/ml, n = 18, p. 7B. Ábra), de az mCTR csoportban nem, de nincs különbség a két csoportot bármelyik időpontban megfigyeltük. A HOMA-IR, az inzulinrezisztencia indexe mindkét csoportban szignifikánsan emelkedett a HFDC során (mCTR: kiindulási érték -0,35 log HOMA-IR, HFDC -0,11 log HOMA-IR, n = 12, p = 0,05; mHFD: kiindulási érték -0,45 log HOMA-IR, HFDC -0.01 log HOMA-IR, n = 18, p. 7C ábra). Nem figyeltek meg különbséget a HOMA-IR-ben a két állatcsoport között. A görbe alatti glükózterület (AUC) nullától az ivGTT során nem volt szignifikánsan különbözõ csoportok vagy idõpontok között (7D. Ábra). Az inzulin AUC szignifikánsan megnőtt a kiindulási érték és a HFDC között mindkét csoportban (mCTR: kiindulási érték 3,16 log AUC, HFDC 3,25 log AUC, n = 12, p. 7E. Ábra); azonban egyik pillanatban sem volt különbség az mCTR és az mHFD csoport között. A leptin szérum hormonszintjét (≈ 2,5 ng/ml) nem befolyásolta sem az anyai HFD-expozíció, sem a HFDC (az adatokat nem közöljük).
Glükóz- és inzulinérzékenységi mérések a HFDC előtt és alatt. Intravénás glükóztolerancia teszteket (ivGTT) végeztek közvetlenül a HFD-expozíció (kiindulási) előtt és a HFD-fertőzés 30. és 35. napján. A HOMA-IR ((glükóz mg/dL × inzulin)/405; C) kiszámításához a glükóz (A) és az inzulin (B) kezdeti éhomi értékeit használtuk. Az ivGTT görbe alatti területét (AUC) a glükóz (D) és az inzulin (E) számításához nulláról számoltuk kiinduláskor és a HFDC alatt. * statisztikailag szignifikáns különbséget jelöl az mCTR alapvonaltól, # statisztikailag szignifikáns különbséget jelöl az mHFD kiindulási értéktől. mCTR n = 12, mHFD n = 18.
Vita
A mostani tanulmány az anya HFD-fogyasztásának hatásait vizsgálta az utódok alkalmazkodóképességére a kalória és a tápanyagok elérhetőségének változásához. Bár az 5 napos kalória-korlátozás és a 35 napos HFD-kihívás metabolikus válaszaiban finom különbségek voltak, az állatok anyáik által fogyasztott étrendtől függetlenül nagyjából hasonló módon alkalmazkodtak ezekhez az anyagcsere-kihívásokhoz. A csoportok között megfigyelt egyik különbség az volt, hogy az mHFD utódok nagyobb táplálékbevitelt mutattak az mCTR utódokhoz képest, amikor HFD-vel hevesen fertőzték őket, ami nagyobb mértékű súlygyarapodásnak felelt meg a fertőzés első hetében. Ezenkívül a bazális inzulin szekréció az mHFD csoportban az akut HFD expozíció után szignifikánsan megnőtt, az mCTR csoportban azonban nem. Ezek a megállapítások azt jelezhetik, hogy az mHFD utódok érzékenyebbek a HFD negatív metabolikus hatásaira, ez a hatás hosszabb ideig tartó expozíció esetén még hangsúlyosabb lehet.
A jelenlegi tanulmány megállapításai ellentétben állnak az anyai elhízás egérmodelljeivel, amelyek azt mutatták, hogy az elhízott gátak utódai nagyobb súlyt kapnak, ha később életükben HFD-nek vannak kitéve (28, 29). Míg az mHFD állatok kezdetben többet ettek és nagyobb súlyt kaptak egy HFD-n, ez a hatás a fertőzés vége felé eloszlani látszott. Ez azt jelezheti, hogy az mHFD utódok magasabb zsírfogyasztására adott adaptív válaszok késedelme rövid, de az általános mechanizmusok érvényesek. A HFD-expozíció akut rövid jellege mellett azt is meg kell jegyezni, hogy a jelenlegi vizsgálatban szereplő állatok még fiatalok és aktívak voltak, és így valószínűleg jobban ellenálltak a HFD obesogén hatásainak, mint a felnőtt állatok. Ezért továbbra is lehetséges, hogy az anyai HFD-fogyasztás befolyásolja az utódok alkalmazkodási képességét a HFD-fogyasztáshoz, de ez idősebb állatoknál hosszú távú expozíciót igényelhet. Folyamatban vannak az utódok anyagcseréjét vizsgáló tanulmányok a jelenlegi modellben, közelebb a pubertás idejéhez.
Bár az mCTR és az mHFD állatok közvetlen összehasonlítása nem mutatott ki különbségeket sem a HFD-provokáció előtt, sem annak végén, az inzulinszekrécióban finom különbségek voltak. Míg az mHFD állatok az éhomi inzulin növekedését mutatták a HFD expozíció során a saját kiindulási értékükhöz képest, ezt az mCTR csoportban nem figyelték meg. Meg kell jegyezni, hogy az mHFD csoportban az inzulinszekréció változása finom volt, és hogy az éhomi éhomi inzulin és az inzulin AUC szintje nem különbözött az mCTR és az mHFD csoportok között a HFDC alatt. Bár az inzulin emelkedése kicsi volt, a HFD-kezelés viszonylag rövid, 35 napos időtartama után következett be, és azt jelzi, hogy az anyai HFD-nek kitett utódok gyorsabban alakulhatnak ki inzulinrezisztenciát hosszabb HFD-expozíció esetén. A jelenlegi tanulmány megerősíti az anyai elhízás klinikai megállapításait, ami növeli a gyermekkori inzulinrezisztencia előfordulását (5, 8), és szemlélteti, hogy milyen gyorsan változhatnak az inzulin szekréció változásai HFD akut expozíciója esetén.
KÖVETKEZTETÉS
A jelenlegi jelentés megállapítja, hogy az anyai HFD-fogyasztás enyhe változásokat eredményez a serdülőkorban a HFD-expozíció adaptív reakcióiban. A bazális inzulin szerény növekedése azt jelzi, hogy az anyai HFD-fogyasztás növelheti a cukorbetegség kockázatát, ha később HFD-t fogyaszt. Az ezt a modellt alkalmazó jövőbeni tanulmányok továbbra is megvizsgálják azokat az alapvető mechanizmusokat, amelyek révén az anyai étrend programozza az anyagcsere-diszfunkciót.
TANULMÁNYI FONTOSSÁGI KÉRDÉSEK
Viszonylag keveset tudni arról, hogy az anyai elhízás hogyan változtatja meg az utódok alkalmazkodási képességét a főemlősök anyagcsere-kihívásaihoz.
Megállapításaink azt mutatják, hogy az anyai zsírtartalmú étrend-fogyasztás nem változtatja meg drámai módon az utódok azon képességét, hogy metabolikusan alkalmazkodjanak az akut kalória-korlátozáshoz vagy a magas zsírtartalmú étrendbe való elhelyezéshez később.
Míg a testsúly és az anyagcsere-paraméterek hasonlónak tűntek a csoportok között, az anyai HFD állatoknál az élelem fokozott bevitele és az éhomi inzulin nagyobb növekedése mutatkozott a HFD-hez való akut hozzáférés hatására, jelezve, hogy érzékenyebbek lehetnek az étrend diabetogén hatásaira.
Kiegészítő anyag
Supp FigS1
Köszönetnyilvánítás
Finanszírozás: NIH R01DK079194, R24DK090964, R01 MH107508R01 és P51 OD011092
A szerzők köszönetet mondanak Dr. Kevin Grove-nak az állatmodell kidolgozásában nyújtott támogatásért. Ezenkívül köszönjük Lina Gao-nak a biostatisztikai segítséget. Végül elismerjük finanszírozási támogatásunkat: NIH R01DK079194, R24DK090964, R01 MH107508R01 és P51 OD011092.
Lábjegyzetek
Szerző közreműködései: A CT elemezte az adatokat és megírta a kéziratot. A TD és a DT részt vett a kísérleti tervezésben, a kivitelezésben és az adatelemzésben. ES és PK részt vett a kísérleti tervezésben, az adatok értelmezésében, és jelentős vitával járultak hozzá az adatokhoz.
Közzététel: Dr. True pénzügyi támogatást kap az NIH-tól, és együttműködési támogatáson dolgozik a Novo Nordisk céggel. Dr. Sullivan a Murdock Charitable Trust (NIH), valamint a Bill és Melinda Gates Alapítvány támogatásáról számol be a vizsgálat lefolytatása során. Dr. Kievit pénzügyi támogatást kap az NIH-tól, valamint kutatási támogatást kap a Novo Nordisk, a Leidos Biomedical Inc. és a Janssen Pharmaceuticals.
- A magas rafinációjú szénhidráttartalmú étrend immunológiai és metabolikus hatásai allergiás ételekben
- A hőkezelt, magas zsírtartalmú étrend módosítja a bél mikrobiotáját és az anyagcsere markereit az apoe− egerekben Táplálkozás;
- Az étrend-kiegészítők, az étrend hatása az anyagcsere-egészségre a Nutritional Outlook áttekintésében
- Hogyan lehet homokóra ábrát szerezni (férfi és nő közötti transzformációs tippek)
- Hasimoto; s étrend A csokoládé hatása; BOOST pajzsmirigy Hashimoto; s és Hypothyroid alkalmazás