A medvebogyó levél kivonat mint természetes antioxidáns tulajdonságainak vizsgálata a modellélelmiszerekben
Nurul Aini Mohd Azman
1 Vegyészmérnöki Tanszék, Katalónia Műszaki Egyetem, Avinguda Diagonal 647, Barcelona 08028, Spanyolország; moc.liamg@namzainia (N.A.M.A.); [email protected] (M.G.G.); moc.liamg@jfaivoges (F.S.)
2 Kémiai és természeti erőforrások mérnöki kar, Malajziai Egyetem Pahang, Lebuhraya Tun Razak, Pahang 26300, Malajzia; ym.ude.pmu@aneerus (S.A.); ym.ude.pmu@adylahs (S.M.S.)
Maria Gabriela Gallego
1 Vegyészmérnöki Tanszék, Katalónia Műszaki Egyetem, Avinguda Diagonal 647, Barcelona 08028, Spanyolország; moc.liamg@namzainia (N.A.M.A.); [email protected] (M.G.G.); moc.liamg@jfaivoges (F.S.)
Francisco Segovia
1 Vegyészmérnöki Tanszék, Katalónia Műszaki Egyetem, Avinguda Diagonal 647, Barcelona 08028, Spanyolország; moc.liamg@namzainia (N.A.M.A.); [email protected] (M.G.G.); moc.liamg@jfaivoges (F.S.)
Sureena Abdullah
2 Kémiai és természeti erőforrások mérnöki kar, Malajziai Egyetem Pahang, Lebuhraya Tun Razak, Pahang 26300, Malajzia; ym.ude.pmu@aneerus (S.A.); ym.ude.pmu@adylahs (S.M.S.)
Shalyda Md Shaarani
2 Kémiai és természeti erőforrások mérnöki kar, Malajziai Egyetem Pahang, Lebuhraya Tun Razak, Pahang 26300, Malajzia; ym.ude.pmu@aneerus (S.A.); ym.ude.pmu@adylahs (S.M.S.)
María Pilar Almajano Pablos
1 Vegyészmérnöki Tanszék, Katalónia Műszaki Egyetem, Avinguda Diagonal 647, Barcelona 08028, Spanyolország; moc.liamg@namzainia (N.A.M.A.); [email protected] (M.G.G.); moc.liamg@jfaivoges (F.S.)
Absztrakt
A közönséges medveszőlő (Arctostaphylos uva-ursi L. Sprengel) mindenütt jelen levő örökzöld cserje Észak-Amerikában, Ázsiában és Európában. A gyümölcsök szinte íztelenek, de a növény nagy koncentrációban tartalmaz hatóanyagokat. A medveszőlő-levél kivonat antioxidáns aktivitása a 2,2′-azino-bisz-3-etil-benzotiazolin-6-szulfonsav (ABTS) radikális kationvizsgálatban 90,42 mmol Trolox-ekvivalens/g száraz tömeg (DW) volt. A medveszőlő levelének metanol-kivonatának a Fenton-reakcióban keletkező metoxi-gyökökkel szembeni tisztító képességét elektron paramagnetikus rezonancián keresztül mértük. A lipid oxidációját olaj-víz emulzióban lassítottuk 1 g/kg liofilizált medveszőlő-kivonat hozzáadásával. Emellett 1 g/kg liofilizált medveszőlőlevonat-kivonat, amelyet zselatinalapú filmbe építenek, magas antioxidáns aktivitást mutat, hogy lassítsa az izomeledelekben lévő lipidek lebomlását. Jelen eredmények azt mutatják, hogy a medveszőlevél-kivonat természetes élelmiszer-antioxidánsként használható.
1. Bemutatkozás
Az élelmiszerekben található lipidoxidáció súlyos problémákat okoz, amelyek rövid eltarthatósági időhez és a táplálkozási minőség csökkenéséhez vezetnek [1]. Szintetikus antioxidánsokat, például butilezett hidroxi-anizolt (BHA), butilezett hidroxi-toluolt (BHT) és terc-butil-hidrokinont (TBHQ) használtak antioxidánsként sok élelmiszertermékben [2], de a fogyasztók aggódnak a lehetséges toxikológiai hatások miatt, és gyakran a természetes antioxidánsokat részesítik előnyben. az egészséges étrend részeként fogyasztott ételek esetében. Ezért számos vizsgálat az új antioxidánsok azonosítására összpontosított, amelyeket modell élelmiszerekben - például emulziókban - tesztelnek és csomagolófóliákba építenek be.
A természetes antioxidánsok nagy koncentrációban tartalmaznak fenolos vegyületeket, és általában gyümölcsökben, zöldségekben és gyógynövényekben fordulnak elő [3,4]. A medveszőlő (Arctostaphylos uva-ursi L. Sprengel) mindenütt jelen levő örökzöld cserje Észak-Amerikában, Ázsiában és Európában. A gyümölcsök szinte íztelenek annak ellenére, hogy sok kereskedelmi termékben magas koncentrációban tartalmaznak hatóanyagokat [5]. A medveszőlő leveleinek (BL) antioxidáns potenciálját számos kémiai vizsgálattal vizsgálták, ideértve a csökkentő teljesítménytesztet, a 2,2-difenil-1-pikrilhidrazil (DPPH) alkalmazásával végzett gyökfogó aktivitást, a liposzómamodellt, a hidroxilgyököket (HO) és a linolsavat. savmodell rendszer [6,7]. A BL fő alkotórészei az arbutin glikozidok (5–15%), metil-karbutin (legfeljebb 4%), valamint kis mennyiségű szabad aglikonok. További alkotóelemek az urzolsav, a csersav, a gallussav, a p-kumarinsav, a szirinsav, a galloilarbutin, a gallo-tanninok és a flavonoidok, nevezetesen a kvercetin, kaempferol és a miricetin glikozidjai [8]. A polifenolok nyomai a BL-ben ígéretes jelöltté tették őket, mint potenciális védők a lipid oxidáció és a szövetek biológiai öregedése ellen.
2. Kísérleti szakasz
2.1. Növényi anyag
A kereskedelmi szempontból szárított BL-t a Pàmies Hortícoles (Balaguer, Spanyolország) bejegyzett gyógynövény-társaság szívesen szállította. Az összes alkalmazott reagens és oldószer analitikai minőségű volt, és a Panreac-tól (Barcelona, Spanyolország) és Sigma Aldrich-től (Gillingham, Anglia) szerezték be őket.
2.2. A BL-kivonat kivonása
A szárított BL-t finomra őrölték egy szokásos konyhai konyhai robotgéppel. Az őrölt BL-t 50:50 (v/v) etanol: víz eleggyel extraháltuk, mindig 1:20 (w/v) arányban. Az extrakciókat sötétben, 4 ± 1 ° C hőmérsékleten, 24 órán át folytattuk, állandó keverés mellett. A BL-kivonat oldatait szűréssel kinyertük 0,45 um Whatman Filter papír segítségével. A felülúszó egy részét későbbi felhasználásra szántuk az antiradikális kapacitás meghatározásához. A maradék felülúszót megmérjük, és az etanol feleslegét vákuumban eltávolítjuk rotációs bepárlóval (BUCHI RE111, Svájc), és 24 órán át -80 ° C-on fagyasztva tartjuk. Az összes kivonatot fagyasztva szárítóban (Unicryo MC2L -60 ° C, München, Németország) vákuumban -60 ° C-on 3 napig szárítottuk a nedvesség eltávolítása érdekében. Végül a liofilizált BL-t lemértük az oldható koncentráció (g/L) meghatározására, Zhang és mtsai. [14].
2.3. A teljes fenolvegyület (TPC) meghatározása
A teljes fenoltartalom meghatározásához Fantas – Ciocalteu módszert alkalmaztunk Santas és mtsai. [15].
2.4. Az antioxidáns aktivitás meghatározása TEAC Assay segítségével
A BL antioxidáns kapacitását módosított TEAC vizsgálattal mértük, Skowyra és mtsai. [16], amely Miller és munkatársai módszerén alapult. [17].
2.5. A radikális sugárzási aktivitás vizsgálatának meghatározása elektronparamágneses rezonancia (EPR) alkalmazásával
Az EPR gyökfogó aktivitását Azman és mtsai módszerével mértük. [18]. A BL-t MeOH-val extraháltuk 1:10 (w/v) arányban, és a BL oldható koncentrációját a fenti eljárásban leírtak szerint határoztuk meg. A centrifugálási reakcióelegy 100 μl 5,5-dimetil-1-pirrolin-N-oxidot (DMPO) (35 mM), 50 μl H2O2-t (10 mM) és 50 μL BL-kivonat oldatot tartalmazott különböző koncentrációban. . Ferulinsavat használtunk referenciaként (0–20 g/l), és a kontroll tiszta MeOH volt. Végül 50 μl FeSO4-et (2 mM) adunk az elegyhez. A végső oldatokat keskeny kvarccsőbe vittük, és az EPR spektrométer üregébe vezettük. A spektrumot 10 percig rögzítjük. Az X-sávos EPR-spektrumokat Bruker EMX-Plus 10/12 spektrométerrel (Bruker Española S.A., Madrid, Spanyolország) rögzítettük a következő körülmények között: mikrohullámú frekvencia, 9,88 GHz; mikrohullámú teljesítmény, 30,27 mW; középtér, 3522,7 G; söpörési szélesség, 100 G; vevőerősítés, 5,02 × 104; modulációs frekvencia, 100 kHz; modulációs amplitúdó, 1,86 G; időállandó, 40,96 ms; konverziós idő, 203,0 ms.
2.6. Az antioxidáns aktivitás meghatározása az élelmiszermodellben
2.6.1. A tokoferolok eltávolítása a napraforgóolajból
Az alumínium-oxidot 24 órán át 200 ° C-os kemencébe helyeztük, majd kivettük és exszikkátorban hagytuk lehűlni, amíg el nem érte a szobahőmérsékletet. A napraforgóolajat kétszer vezettük át az alumínium-oxidon egy oszlopban a tokoferolok eltávolítása céljából, Yoshida és mtsai. [19]. Végül a leszűrt olajat felhasználásig -80 ° C-on tároltuk.
2.6.2. Az emulzió elkészítése
Az olaj-víz emulziót az Azman et al. [20]. A végső mintákat (1) kontroll alkalmazásával (hozzáadás nélkül) készítettük; (2) 0,2 g/kg BHA; vagy (3) 1 g/kg liofilizált BL. Az egyes minták emulzióját négyszer készítettük el, összesen 12 mintát kapva, sötétben tárolva hagytuk 37 ° C-on oxidálódni. A minták pH-ját négyszer mértük minden egyes mintához (pH-mérő GLP21, Crison Instruments, Barcelona, Spanyolország), paraméterként annak korrelációjának vizsgálatához a peroxid-értékkel (PV).
2.6.3. A peroxid-érték (PV) meghatározása
Az elsődleges oxidációs termékeket peroxid-érték (PV) alkalmazásával mértük a Hivatalos Analitikai Kémikusok Egyesületének (AOAC) 8195 tiocianát-módszerével [21]. Vas (II) -klorid-oldatot készítünk 1 M sósavban 2 mM vas (II) -klorid hozzáadásával, végső koncentrációval. Ammónium-tiocianát oldatot készítünk vízben (2 mM, végső koncentráció). A vizsgálatot 0,007 és 0,01 g közötti csepp emulzióval hajtottuk végre, etanollal hígítva. Ebből az oldatból a szükséges mennyiségű mintát az oxidáció mértékétől függően küvettába helyeztük, és etanolt adtunk a mintához. Vas-klorid és ammónium-tiocianát oldatokat adunk hozzá, mindegyik 1,875% (v/v) végkoncentrációban. Az abszorbanciát spektrofotometriásán mértük λ = 500 nm-en. Az eredményeket meq hidroperoxid/kg emulzióban fejeztük ki.
2.6.4. Zselatin alapú film előállítása antioxidáns bevonattal
Az antioxidáns bevonattal ellátott zselatin alapú film gyártását Bodini és munkatársai módszerével adaptálták és jellemezték. [22] A filmogén oldat szorbit oldása után történő lehűtése közben 1 g/kg BL-kivonatot/zselatint adunk hozzá. A zsír és az ízületi szöveteket levágták a sovány húsról (2000 g), és a húst 8 mm-es ipari lemezeken aprították át. Ezután a húst 1,5 cm vastagságúra formáztuk. Mindegyik szelethez filmeket (5 × 5 cm2) helyeztek mindkét oldalra, kontrollfóliával (antioxidáns hozzáadása nélkül) vagy BL-fóliával (1 g/kg liofilizált BL). A kontrollmintákat ugyanúgy készítettük el, azzal az eltéréssel, hogy a szeleteket nem fedtük le semmilyen filmmel. Ezt követően a mintákat polipropilén tálcákba csomagoltuk, mielőtt 12 napig 4 ° C-on tároltuk volna.
2.6.5. Tiobarbitursavval reagáló anyagok (TBARS)
TBARS mérést alkalmaztunk a lipid oxidáció mértékének mérésére a tárolási időszak alatt, Grau és mtsai. [23]. A mintát (1 g) csőben lemértük és 3 ml/l vizes EDTA-val összekevertük. Ezután a mintát azonnal összekevertük 5 ml tiobarbitursav-reagenssel Ultra-Turrax (IKA, Németország) alkalmazásával 32000 fordulat/perc sebességgel 2 percig. Az összes eljárást sötétben hajtották végre, és az összes mintát jégben tartották. Az elegyet 97 ± 1 ° C hőmérsékleten forró vízben 10 percig inkubáltuk, és az eljárás során 1 percig rázattuk, hogy homogén keveréket kapjunk. A folyékony mintát szűréssel kinyertük (Whatman Filter paper, 0,45 um), miután a mintát 10 percig hűtöttük. Az egyes minták abszorbancia értékét 531 nm-en mértük spektrofotométerrel. A TBARS-értéket egy 1,1,3,3-tetraetoxi-propánnal előállított és a lineáris regresszióval elemzett malondialdehid (MDA) standard görbéből számítottuk. Az összes eredményt mg malaldehid/kg minta formájában adtuk meg.
2.7. Statisztikai analízis
Az egyirányú varianciaanalízist (ANOVA) a Minitab 16 szoftverprogrammal (Addlink Software Cientifico, Barcelona, Spanyolország) végeztük (α = 0,05). Az eredményeket átlagértékként adtuk meg (n ≥ 3).
3. Eredmények és megbeszélés
3.1. Extrakciós hozam, teljes fenoltartalom (TPC) és antioxidáns aktivitás
Az extrahálási hozam, az összes polifenol (TPC) és az antioxidáns aktivitás a medveszőlő leveleinek 50:50 v/v etanol: víz: víz térfogatarányú kivonataiban az 1. táblázatban található. 3 napos fagyasztva szárítás után átlagosan 1,6 ± 0,01 g extraktumot nyertünk ki 5 g medveszőlő kivonatból (p> 0,05).
Asztal 1
A medveszőlő levélkivonatainak extrakciós hozama, polifenoltartalma és antioxidáns aktivitása.
| Extrakciós hozam (%) | 32,1% ± 0,03% |
| Összes fenoltartalom (mg GAE/g DW) | 102,11 ± 7,12 |
| TEAC (mmol TE/g DW) | 90,42 ± 1,83 |
*: Az eredményeket átlag ± szórásként fejezzük ki (n = 3). Gallusav-ekvivalens (GAE), Trolox-ekvivalens antioxidáns aktivitás (TEAC), Trolox-egyenérték (TE), száraz tömeg (DW).
3.2 Szabad radikális aktivitás-vizsgálatok elemzése
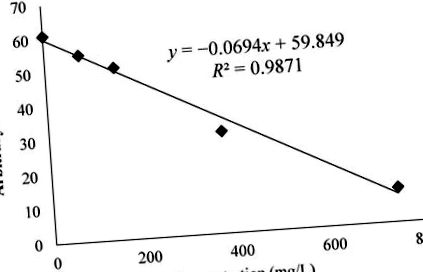
ahol az x értékek mg/l-ben voltak.
H2O2 (2 mM) és FeSO4 (0,04 mM) oldatból, DMPO-val (14 mM) oldószerként MeMP-ben lévő spin-csapdaként előállított DMPO – OCH3 radikális adduktum elektron-paramágneses rezonancia (EPR) spektrumának variációja. Az EPR-jel a BL metanol-kivonatok koncentrációjának növekedésével csökkent. Az EPR szignál magasabb antioxidáns aktivitás mellett csökkent.
A grafikon azt mutatja, hogy a medveszőlő-kivonat mennyiségének növekedésével a spektrum jelének exponenciális értéke csökkent. Azman és mtsai. bemutatta a katechinek metoxicsoporttal való eltávolító képességét ezzel a vizsgálattal [18]. Ezeket a katechineket a medveszőlő kivonatában Valjkovic et al. és ezek a vegyületek hozzájárultak a metoxi-gyök eltávolításának képességéhez ebben a vizsgálatban [24]. Ezenkívül a BL-eltávolító képességről korábban Amarowicz és munkatársai számoltak be. hidroxil szabad gyökök (HO •) felhasználásával, EPR-rel mérve [11].
3.3. Antioxidáns hatások tárolt o/w emulzióban
Módszereket fejlesztettek ki a természetes antioxidánsok hatásának megértésére a modellélelmiszerekben, például az emulziókban és az aktív film csomagolásában. Természetes antioxidánsok hozzáadása az élelmiszerekhez nemcsak késlelteti az oxidációs folyamatot, hanem közvetlen elfogyasztása révén javítja az ételek tápértékét. Korábbi munkáiban a medveszőlő levélkivonat olaj-víz emulzióban kifejtett hatását nem írták le. Modellemulzióval értékelték a lipidek romlását az oxidáció két szakaszában, amelyek az elsődleges oxidációs termékek (peroxid érték) és a szekunder oxidációs termékek (TBARS) voltak. Ezenkívül figyeltük a pH változását, mivel az oxidáció során a pH csökkenni szokott.
- Az aszalt szilva (szárított szilva) természetes fogyókúrás ételek HowStuffWorks
- Szójabab természetes fogyókúrás ételek HowStuffWorks
- Természetes zsírégetők Ételek, kiegészítők és egyebek
- Akció legújabb egészséges múmia fogyni baba súlya természetes - globális tanulmány UK
- Sáfrány Természetes erős antioxidáns, mint ígéretes elhízás elleni gyógyszer