A metil-4-hidroxi-cinnamát és a karnozinsav szinergetikus citotoxicitása az akut mieloid leukémia sejtekhez kalcium-függő apoptózis indukció útján
Aviram Trachtenberg
1 Klinikai Biokémiai és Farmakológiai Tanszék, Ben-Gurion Egyetem, Negev, Beer Sheva, Izrael
Suchismita Muduli
1 Klinikai Biokémiai és Farmakológiai Tanszék, Ben-Gurion Egyetem, Negev, Beer Sheva, Izrael
Katarzyna Sidoryk
2 Kémiai Osztály, Gyógyszerészeti Kutatóintézet, Varsó, Lengyelország
Marcin Cybulski
2 Kémiai Osztály, Gyógyszerészeti Kutatóintézet, Varsó, Lengyelország
Michael Danilenko
1 Klinikai Biokémiai és Farmakológiai Tanszék, Ben-Gurion Egyetem, Negev, Beer Sheva, Izrael
Társított adatok
Az ehhez a tanulmányhoz készített összes adatkészlet szerepel a kéziratban és/vagy a Kiegészítő fájlokban.
Absztrakt
Bevezetés
A jelenlegi tanulmányban azt vizsgáltuk, hogy a CUR mellett más fitokémiai anyagok is képesek-e szinergizálódni a CA-val az AML sejtek ellen. Így több fenolos vegyület és egy szeszkviterpén-lakton szűrését követően egy másik szinergetikusan ható kombinációt azonosítottunk, amely a metil-4-hidroxi-finnamát (MHC) és a CA fenolsav-származékát tartalmazta. Az MHC számos növényben található meg, például zöldhagyma (Allium cepa) (Xiao és Parkin, 2007) vagy noni (Morinda citrifolia L.) levelekben (Zhang et al., 2016), és potenciálisan kemopreventív aktivitással bír (Xiao és Parkin, 2007). Tudomásunk szerint az MHC-t korábban nem tesztelték antileukémiás szerként. Itt arról számolunk be, hogy az MHC + CA kombináció citotoxikus hatása mind fenomenológiailag, mind mechanikusan nagyon hasonló a CUR + CA hatásához. Továbbá, ellentétben az erősen fluoreszkáló CUR-val, amelyről ismert, hogy zavarja a fluoreszcencia alapú vizsgálatokat (Nelson és mtsai., 2017), az MHC-nek nem volt kimutatható fluoreszcenciája, ha áramlási citometriával tesztelték hullámhosszak széles tartományában (FL1 –FL10).
Anyagok és metódusok
Anyagok
A kurkumint (≥90%) és a karnozinsavat (98%) a Cayman Chemicals-tól (Ann Arbor, MI, USA), illetve a Chemlin UK-tól (Nanjing, Kína) vásároltuk. A metil-4-hidroxi-finnamátot (96%) Dr. Katarzyna Sidoryk (Kémiai Osztály, Gyógyszerészeti Kutatóintézet, Lengyelország) szintetizálta, a korábban leírtak szerint (Sidoryk et al., 2018). A zVAD-fmk-t az AdooQ BioScience-től (Irvine, Kalifornia, USA) szereztük be. A propídium-jodidot (PI), a 2-amino-etoxi-difenil-borátot (2-APB), az arabinosil-citozint (Ara-C) és a staurosporint (STS) a Sigma-tól (Rehovot, Izrael) vásároltuk. Az Annexin V-APC-t a BioLegend-től (San Diego, Kalifornia, USA) szereztük be. A Fluo-3/AM, 2 ', 7′-diklór-fluoreszcein-diacetátot (DCFH-DA), a dihidrorodamin-123-at (DHR) és a tetrametil-rodamin-metil-észtert (TMRE) a Santa Cruz Biotechnology-tól (Dallas, TX, USA) vásároltuk. Az RPMI 1640 táptalajt és hő-inaktivált szarvasmarha-magzati szérumot (FBS) a Gibco-Invitrogen-től (Carlsbad, Kalifornia, USA) szereztük be. Hank pufferolt sóoldatát (HBSS), Ca 2+/Mg 2+ mentes foszfáttal pufferolt sóoldatot (PBS), penicillint, sztreptomicint és HEPES-t a Biological Industries-től (Beit Haemek, Izrael) vásároltuk. Kurkumin (5 mM) és karnozinsav (10 mM) törzsoldatait abszolút etanolban és metil-4-hidroxi-cinnamátban (50 mM) DMSO-ban készítettük.
Sejtkultúra és -számlálás
Az emberi AML-sejtvonalakat, például a KG-1a őssejteket (CCL-246.1) és a HL60 myoblast sejteket (CCL-240) az American Type Culture Collection-től (Rockville, MD) vásároltuk. A sejteket 10% FBS-sel, penicillinnel (100 E/ml), sztreptomicinnel (0,1 mg/ml) és 10 mM HEPES-sel (pH = 7,4) kiegészített RPMI 1640 táptalajban tenyésztettük, nedvesített atmoszférában, 95% levegővel és 5% CO2-val. 37 ° C-on. A sejteket Vi-Cell XR sejtek életképesség-analizátorában (Beckman Coulter Inc., Fullerton, Kalifornia) számláltuk, automatikus tripán kék kizárási vizsgálattal. Az életképes (tripán kékben nem áteresztő) sejtek számát közvetlenül megszámoltuk, és a sejtek életképességét az életképes sejtek százalékos arányában számoltuk az összes (életképes + elhalt) sejtszámhoz viszonyítva.
Akridin narancs és etidium-bromid festés
A sejteket centrifugálással összegyűjtöttük, és kétszer festettük 14 μg/ml akridin narancssárgával és 14 μg/ml etidium-bromiddal, a korábban leírtak szerint (Pesakhov et al., 2010). A festett sejtek magmorfológiáját fluoreszcens mikroszkóppal vizsgáltuk 400-szoros nagyítással.
Annexin V/Propidium Jodide Assay
A sejteket PBS-sel mostuk, majd anesztin V-APC-vel és PI-vel festettük, a korábban leírtak szerint (Pesakhov et al., 2016). Az apoptotikus sejtek százalékos arányát áramlási citometriával határoztuk meg Gallios készülékben (Beckman Coulter, Miami, FL). Minden elemzéshez 10 000 eseményt rögzítettek, és az adatokat a Kaluza szoftver 2.1-es verziójával dolgozták fel (Beckman Coulter).
A reaktív oxigénfajták (ROS) intracelluláris szintjének meghatározása
Az intracelluláris ROS-szinteket a korábban leírtak szerint határoztuk meg (Pesakhov és mtsai., 2010), oxidációra érzékeny DCFH-DA és DHR fluoreszcens szondákkal. A sejteket összegyűjtöttük, HEPES-sel kiegészített HBSS-sel (pH = 7,3) mostuk és 5 μM DCFH-DA-val vagy DHR-vel töltöttük. A sejteket ezután rázóvízfürdőben 37 ° C-on inkubáltuk 15 percig sötétben. A fluoreszcencia intenzitását áramlási citometriával elemeztük, a fent leírtak szerint.
A mitokondriális membránpotenciál meghatározása
A sejteket összegyűjtöttük, HEPES-sel kiegészített HBSS-sel (pH = 7,3) mostuk és TMRE-vel (100 nM) töltöttük 30 percig sötétben, mostuk és szérummentes közegben szuszpendáltuk. A mitokondriális membránpotenciál változását áramlási citometriával értékeltük.
Citoszolos kalciumszintek mérése ([Ca 2+] cyt)
Az egyensúlyi állapotú [Ca 2+] cyt változásainak kiértékeléséhez a sejteket összegyűjtöttük, megmostuk és 2,5 μM Fluo-3/AM kalciumban (2 mM) kiegészített Ringer-oldattal inkubáltuk (Levin-Gromiko et al., 2014; Pesakhov et al., 2016) szobahőmérsékleten 30 percig sötétben. A sejteket ezután mossuk, újraszuszpendáljuk Ca 2+ -mentes Ringer-oldatban, és áramlási citometriával elemezzük.
Western Blot elemzés
A Western blot-ot teljes sejtkivonatokkal hajtottuk végre, az előzőekben leírtak szerint (Pesakhov et al., 2016). A következő elsődleges antitesteket használtuk: kaszpáz-3 a Santa Cruz Biotechnology cégtől (sc-7272; 1: 500); hasított kaszpáz-3 a Cell Signaling Technology-tól (# 9661; 1: 1000) és az Enzo-tól származó poli (ADP-ribóz) polimeráz (PARP) (BML-SA253; 1: 5000).
Statisztikai analízis
Minden kísérletet legalább háromszor végeztek. Két kísérleti csoport között statisztikailag szignifikáns különbségeket párosítatlan kétfarkú Student t-teszttel becsültünk meg. A több alcsoport átlaga közötti különbségek szignifikanciáját egyirányú ANOVA-val, Tukey többszörös összehasonlító post-hoc analízissel értékeltük. A P A + B), az adatokat összehasonlítjuk, miután kivontuk az A, B és AB megfelelő kontrollértékeket. Két vegyület kölcsönhatásának részletes elemzését a kombinációs index (CI) módszerrel hajtottuk végre (lásd Kiegészítő anyag). A statisztikai elemzéseket GraphPad Prism 6.0 szoftverrel (Graph-Pad Software, San Diego, Kalifornia) végeztük.
Eredmények
Az MHC és a CUR, de nem más tesztelt fitokemikália, hasonlóan szinergizál a CA-val, hogy apoptotikus sejtpusztulást idézzen elő az AML sejtekben.
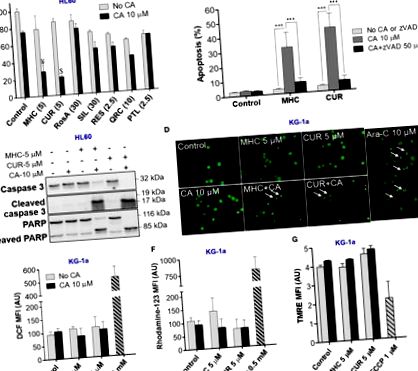
Ahogy az várható volt, az AML sejtek apoptózisa a magok zsugorodásával és széttöredezésével, valamint kromatin kondenzációval járt együtt (1D. Ábra). Másrészt nem figyeltük meg a nekrotikus sejthalál jeleit, például az egyenletesen festett (narancssárga) szabályos méretű vagy nagyobb magokat, amelyek általában normális morfológiával rendelkeznek. Fontos, hogy az apoptózis indukcióját nem előzte meg intracelluláris ROS felhalmozódás (1E, F ábra) vagy a mitokondriális membránpotenciál változásai (1G ábra).
Az apoptózis szinergikus indukcióját az MHC + CA kombinációval intracelluláris kalcium felhalmozódás közvetíti
Mivel a CUR + CA által kiváltott apoptózist korábban tartós [Ca 2+] cyt túlterhelés közvetítette, a következőkben megvizsgáltuk, hogy az MHC + CA is elpusztítja-e az AML sejteket Ca 2+ -függő mechanizmusokkal (Pesakhov et al., 2016 ). Valóban, a Fluo-3 citoszolos Ca 2+ indikátor segítségével azt tapasztaltuk, hogy a CUR + CA-hoz hasonlóan a KG-1a sejtekre alkalmazott MHC + CA kombináció a [Ca 2+] cyt tartós emelkedését okozta, és ezt a hatást megakadályozták 2-APB által ismert, hogy antagonizálja az inozitol-triszfoszfát receptorokat (IP3R) és a raktárban működtetett Ca 2+ csatornákat (2A, C ábra) (Dobrydneva és Blackmore, 2001; Yanamandra et al., 2011; Littlechild et al., 2015). Hasonlóképpen, a 2-APB eltörölte az apoptózis indukcióját MHC + CA-val kezelt sejtekben (2B, D ábra). Ez utóbbi gátló hatás az MHC + CA által indukált kaszpáz-3 majdnem teljes blokkolásával és a 2-APB PARP hasításával társult (2E ábra).
Vita
Adatok elérhetősége
Az ehhez a tanulmányhoz készített összes adatkészlet szerepel a kéziratban és/vagy a Kiegészítő fájlokban.
Szerző közreműködései
MD, AT és KS megalkotta a koncepciót. AT és MD kísérleteket tervezett és megírta a kéziratot. AT és SM kísérleteket hajtott végre. KS és MC reagenseket biztosított.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
Szójegyzék
Rövidítések
| 2-APB | 2-aminoetoxi-difenil-borát |
| Ara-C | arabinosil-citozin (citarabin) |
| DCF, 2 ′ | 7′-diklór-fluoreszcein |
| DCFH-DA, 2 ′ | 7′-diklór-fluoreszcein-diacetát |
| DHR | dihidrorodamin 123 |
| FCCP | karbonil-cianid-4- (trifluor-metoxi) -fenil-hidrazon |
| IP3R | inozitol-triszfoszfát receptor |
| PARP | poli (ADP-ribóz) polimeráz |
| PBMC | perifériás vér mononukleáris sejtek |
| PI | propidium-jodid |
| STS | sztauroszporin |
| TMRE | tetrametil-rodamin-metil-észter. |
Lábjegyzetek
Finanszírozás. Ezt a munkát az Izraeli Tudományos Alapítvány 226/16 támogatása támogatja.
- A húgysav mint patogén tényező a preeclampsiában
- A húgysav egészségügyi témái
- Húgysav - áttekintés a ScienceDirect témákról
- Húgysav, szérum - Mayo Clinic Laboratories Gyermekgyógyászati katalógus
- Húgysav-nephropathia; News-Medical