A Mia40, a mitokondriumok intermembrán térébe történő fehérjebehozatal új tényezője képes megkötni a fémionokat
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Levelezési cím. Fax: +49 89 2180 77093 Keresse meg a szerző további cikkeit
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Adolf-Butenandt-Institut für Physiologische Chemie, Ludwig-Maximilians-Universität München, Butenandtstrasse 5, D-81377 München, Németország
Levelezési cím. Fax: +49 89 2180 77093 Keresse meg a szerző további cikkeit
Absztrakt
A mitokondriumok intermembrán térében (IMS) elhelyezkedő sok fehérjét alacsony molekulatömeg jellemzi, erősen konzervált cisztein-maradványokat tartalmaznak és koordináta-fémionokat tartalmaznak. E fehérjék egyikén, a Tim13-on végzett vizsgálatok feltárták, hogy a külső membránon át történő nettó transzlokációt az IMS-ben lévő fémfüggő hajtás vezérli [1]. Azonosítottunk egy lényeges komponenst, a Mia40/Tim40/Ykl195w-t, amelynek az IMS-ben erősen konzervált doménje van, és amely képes megkötni a cink- és réz-ionokat. Azokban a sejtekben, amelyekben nincs Mia40, a Tim13 és más, fémhez kötődő IMS fehérjék endogén szintje erősen csökken ezeknek a fehérjéknek a káros importja miatt. Továbbá a Mia40 közvetlenül kölcsönhatásba lép az újonnan importált Tim13 fehérjével. Arra a következtetésre jutunk, hogy a Mia40 a fémkötő IMS fehérjék specifikus transzlokációs útvonalának első alapvető eleme.
1. Bemutatkozás
2. Anyagok és módszerek
2.1 Plazmidok és törzsek
A Mia40 élesztőből történő megtisztításához a Mia40 prekurzort kódoló szekvenciát, amely nyolc hisztidinmaradékhoz van fuzionálva, beillesztjük a pVTU plazmidba [15], és transzformáljuk a vad típusú W303-1B-be. A kifejezésben Escherichia coli, a Mia40 68–403 maradványait kódoló szekvenciát PCR-rel amplifikáltuk és szubklónoztuk a pMAL ‐ CRI plazmidba (NEB, Beverly). A Mia40 szabályozott expressziójához a GAL10 promótert inszertáltuk a MIA40 olvasókeret a vad típusú YPH499 törzsben. A Mia40 kimerítéséhez a kapott GAL-MIA40 tenyészetet a 0,1% galaktózt tartalmazó laktát táptalajról a 0,1% glükózt tartalmazó laktát táptalajra helyeztük át. A Mia40 túlzott mértékű expresszióját ugyanazt a törzset növesztettük 0,5% galaktóz jelenlétében.
2.2. Fehérjetisztítási eljárások és fémtartalom meghatározása
Az MBP-fúziós fehérjéket 100 μM cink-acetát vagy réz-szulfát jelenlétében expresszáltuk. A fehérjetisztítást és a fémtartalom meghatározását lényegében a fémmentes pufferek alkalmazásával végeztük [1]. Radiojelzett Tim13 kémiai mennyiségeket készítettünk és használtunk behozatali reakciókhoz, lényegében az [1] leírás szerint, azzal a különbséggel, hogy a sejteket alacsony szulfáttartalmú tápközegben (50 μM) növesztettük 5 mCi [35 S] szulfát jelenlétében.
2.3 Az endogén Mia40 tripszin kezelése
A mitokondriumokat mitoplasztokká alakítottuk 60 mM szorbitban, 1 mM ATP-ben, 4,5 mM β-merkaptoetanolban és 20 mM HEPES – KOH-ban (pH 7,4) inkubálva jégen 20 percig. További 10 percig tartó inkubálás után 10 mM EDTA és 2 mM batofenantrolin-diszulfonsav jelenlétében vagy hiányában a mitoplasztokat jégen 30 percig 5-25 μg/ml tripszinnek tettük ki. Tisztító centrifugálás után a felülúszó frakcióban lévő fehérjéket 12% triklór-ecetsav hozzáadásával kicsapjuk és immunblotolással analizáljuk Mia40 elleni antitestekkel.
2.4 Egyéb
A fehérjék beolvadását izolált mitokondriumba, a szubcelluláris és submochondriális frakcionálást, a preprotein keresztkötését és a koimmunoprecipitációt a leírtak szerint végeztük [1, 16, 17]. Az antitesteket Mia40 élesztő C-terminális peptidjével (CVKKEPLNEESKP) állítottuk elő nyulakban. A Mia40 érett N-terminálisának meghatározásához a Mia40 C-terminális oktahistidinil-jelölt formáját élesztőben fejeztük ki, Ni – NTA kromatográfiával tisztítottuk [16], és N-terminális szekvenálással elemeztük a TopLab GmbH-nál (Martinsried, Németország).
3 találat
3.1 A Mia40 nagy domaint tár fel az IMS-ben
3.2 A Mia40 elengedhetetlen réz- és cinkmegkötő fehérje
A Mia40 homológjai az egész eukarióta királyságban jelen vannak. Kb. 60 aminosav-maradékkal erősen konzervált doménjük van, amely hat invariáns cisztein-maradékot tartalmaz, CXC-CX9C-CX9C-motívumot alkotva (2. ábra A). Ezt a motívumot elengedhetetlennek találták a Mia40 számára, mivel egy olyan változat, amelyben az első három cisztein maradékot szerin maradványok cserélték, nem volt képes megmenteni a Δmia40 megszakítási törzs (az adatokat nem mutatjuk be).
A Mia40 potenciális fémmegkötő képességének értékeléséhez rekombinánsan expresszáltuk és megtisztítottuk a Mia40 IMS-doménjét (68–403. Aminosavmaradék) fúziós fehérjeként a maltóz-kötő fehérjével (MBP ‐ Mia40ΔTM). Az indukcióval kapcsolt plazma atomemissziós spektroszkópia (ICP ‐ AES) jelentős mennyiségű cink- és réziont tárt fel az MBP ‐ Mia40ΔTM-ben (2B. Ábra). Más fémeket, például vasat és nikkelt, nem sikerült kimutatni. Ez azt jelzi, hogy a Mia40 képes specifikusan megkötni a cink- és rézionokat.
A fémkofaktor jelenlétét a Mia40-ben tovább támogatta az endogén protein szignifikánsan megnövekedett tripszin-érzékenysége kelátok jelenlétében (2C. Ábra). Ez arra utal, hogy in vivo a Mia40 IMS-doménjának hajtogatását fémionok stabilizálják.
3.3 A kisméretű IMS fehérjék importálásához a Mia40 szükséges
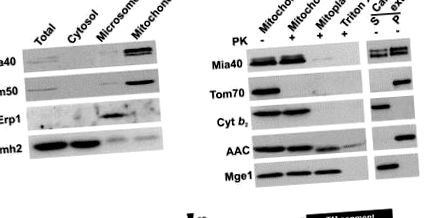
A Mia40 mitokondriumban való működésének azonosítása érdekében létrehoztunk egy törzset, amely a MIA40 gén a glükóz-reprezentálható kontroll alatt GAL10 promóter. Körülbelül 22 órával a galaktóztól a glükóztartalmú táptalajra való áttérés után a Mia40 kimerült a mitokondriumból, és a sejtek növekedése lelassult (3. ábra A). Érdekes módon a kis fém-koordináló TimS, Tim10 és Cox17 IMS fehérjék endogén szintje súlyosan csökkent a Mia40 (Mia40 ↓) kimerített mitokondriumokban (3B. Ábra). Ezzel szemben azok az IMS fehérjék, amelyek nem tartalmaznak fémkofaktort, nem érintettek (citokróm b 2, citokróm c és citokróm c hem-liáz). A külső membrán (Tom40), a belső membrán (Tim23, AAC) és a mátrixtér (Tim44, Mge1) mitokondriális fehérjéinek szintje szintén nem változott. A belső membrán Tim22 fehérje bizonyos mértékben csökkent, feltehetően azért, mert a Tim22 biogenezise a kis Tim fehérjék jelenlététől függ az IMS-ben [7, 20]. Ez arra utal, hogy a Mia40 kifejezetten szükséges a fémtartalmú IMS fehérjék biogeneziséhez vagy fenntartásához.
Ezután importálási kísérleteket végeztünk izolált mitokondriumokban, hogy teszteljük a Mia40 szerepét ebben a folyamatban (3C. Ábra). A Tim13 importja erősen függ a Mia40 jelenlététől, függetlenül attól, hogy a Tim13 rekombinánsból tisztult-e meg E. coli sejtek („kémiai mennyiségek”) vagy retikulocita lizátumban szintetizáltak („radiokémiai mennyiségek”). A Tim10 és a rekombináns Cox17 importját a Mia40 ↓ mitokondriumokban is befolyásolta. Ezzel szemben a citokróm behozatali aránya c a hem-liáz, az IMS fehérje, amely nem koordinálja a fémkofaktorokat, valamint a külső membrán (porin) és a mátrix (pSu9DHFR) fehérjéi nem csökkentek (3C. ábra). Arra a következtetésre jutunk, hogy a Mia40 létfontosságú a fémkötő fehérjék IMS-be történő importálásához. Érdekes módon a Mia40 túlzott expressziója után a Tim13 behozatali aránya jelentősen megnőtt, ami arra utal, hogy a Mia40 a Tim13 behozatalának sebességkorlátozó tényezője (3D ábra).
3.4 A Mia40 kölcsönhatásba lép a kis Tim fehérjékkel
Ezután kémiai keresztkötéssel teszteltük, hogy az újonnan importált Tim13 közvetlenül kölcsönhatásba lép-e a Mia40-gyel. A radioaktívan jelölt Tim13-at a térhálósító reagens 1,5-difluor-2,4-dinitrobenzol (DFDNB) jelenlétében vagy hiányában importáltuk a mitokondriumokba. A mitokondrium denaturáló körülmények között történő lízisét követően a Mia40-et immunprecipitációval izoláltuk. Amint a 4A. Ábra mutatja, a Tim13 körülbelül 75 kDa térhálós terméke kicsapódik Mia40-specifikus antitestekkel. Ez a termék a Tim13 és a Mia40 specifikus kölcsönhatását tükrözte, mivel hiányzott, amikor nem adtak keresztkötést, vagy preimmun szérummal végzett kontrollcsapások esetén (4A. Ábra, bal oldali panel). Ezenkívül nem figyeltek meg térhálósodást a Mia40-gyel a Tim13 SSSS mutánssal, amelyben a Tim13 négy konzervált cisztein-maradékát szerin-maradékok helyettesítették (4A. Ábra, jobb oldali panel). Ez a Tim13 variáns nem képes megkötni a fémionokat, és ennek következtében nem halmozódik fel stabilan a mitokondrium IMS-ben [1]. A Mia40 és az újonnan importált Tim13 közötti kölcsönhatást a Mia40 elleni antitestek alkalmazásával végzett ko-immunprecipitációval is kimutattuk (4B. Ábra). Az endogén Tim13-ot nem immunprecipitálták a Mia40-gyel (az adatokat nem közöljük). Így a Mia40 fizikailag kölcsönhatásba lép a Tim13-szal a mitokondrium IMS-be történő transzlokációja alatt vagy közvetlenül azt követően.
4. Megbeszélés
Bemutatjuk, hogy a Mia40 nagy fémmegkötő domént tesz ki az IMS-be, és kritikus fontosságú a kis fémtartalmú fehérjék IMS-be történő importálása szempontjából. A Mia40 intim kapcsolata az újonnan importált Tim13-mal arra utal, hogy a Mia40 közvetlen szerepet játszik a Tim13 csapdájában és/vagy hajtogatásában az IMS-ben. Mivel a Tim13 fémfüggő hajtogatása és importja mechanikusan és kinetikailag összekapcsolt eseménynek tűnik [1], nehéz megoldani a Mia40 elsődleges molekuláris funkcióját ebben a folyamatban. Érdekes az a megfigyelés, hogy a Mia40 maga képes megkötni a cink- és rézionokat, és lehetővé teszi a Mia40 aktív szerepét az újonnan importált IMS-fehérjékbe történő fémátadásban. Alternatív megoldásként a Mia40 szerepet játszhat az IMS fehérjék egy alosztályának receptoraként. Egy ilyen funkció összhangban lenne az újonnan importált Tim13 Mia40-hez kötődő megfigyelésével.
A kézirat elkészítése során két publikáció számolt be az Ykl195w/Mia40/Tim40 azonosításáról [21, 22]. Eredményeik és az itt bemutatottak egyetértenek e fehérje szerepével a kis IMS-fehérjék biogenezisében. Ezekben a vizsgálatokban feltárták a Mia40 és az újonnan importált kis Tim fehérjék komplexét is, amelyet keresztkötéses és koimmunoprecipitációs kísérletekkel azonosítottunk, bár alternatív natív géles megközelítéssel. A Mia40 fémmegkötő képességéről azonban korábban nem számoltak be. Továbbá tisztázni tudtuk a Mia40 topológiáját és elhelyezkedését. A két közelmúltban ellentmondásos nézetek hangzottak el. Az egyik azt sugallja, hogy a Mia40 hidrofób szegmenssel van rögzítve a belső membránhoz [22]. A másik egy második feldolgozási eseményről számol be, amely kiváltja a Mia40 felszabadulását a mitokondrium IMS-be [21]. Edman-lebontással határoztuk meg a Mia40 N-terminális szekvenciáját a mitokondriumokban. Ez feltárta, hogy a prekurzor fehérje feldolgozása N-terminálisan történik a hidrofób szegmens felé, ami azt jelzi, hogy a transzmembrán szegmens jelen van az érett Mia40 fehérjében.
A Mia40 azonosítása a Tim13 és más IMS fehérjék importkomponenseként az intracelluláris fehérje kereskedelem új aspektusát nyitja meg. A jövőbeni vizsgálatoknak arra a molekuláris mechanizmusra kell összpontosítaniuk, amely révén a Mia40 közvetíti az IMS fehérjék vektoros transzlokációját a mitokondrium külső membránján keresztül.
Köszönetnyilvánítás
Hálásak vagyunk Ulrike Gärtnernek és Heiko Germerothnak a kiváló technikai segítségért, Helmuth Hartlnak a fémmeghatározásért és Prof. Alex Tzagoloffnak a Cox17 elleni antitestekért. Köszönjük Matt Harmey professzornak, hogy kritikusan elolvasta a kéziratot. Ezt a munkát a Deutsche Forschungsgemeinschaft HE 2803/2, SFB 594 (B3, B13) és a Fonds der Chemischen Industrie támogatásai támogatták.
- Az ember 129 fontot veszít, hogy ikerfiaival együtt futhasson. A gyerekeimnek adtam a megérdemelt apát
- Hogyan befolyásolja a fehérje a fogyást
- Hipnózis a fogyáshoz Hipnoterápia segítségével fontok kegyelmi űrhipnózisának leadására
- Lite - szívű fogyás központ (WLC) ideális fehérje - lite - szívű fogyás központ (WLC)
- Hogyan tudtam eldobni a kövér nadrágomat, miközben Ázsiában étkeztem