A mikroRNS-funkció megcélzása akut hasnyálmirigy-gyulladásban
Hong Xiang
1 Integratív Orvostudományi Főiskola, Dalian Orvostudományi Egyetem, Dalian, Kína
2 Általános sebészeti osztály, Dalian Orvostudományi Egyetem első kórháza, Dalian, Kína
Xufeng Tao
3 Gyógyszerészeti Főiskola, Dalian Orvosi Egyetem, Dalian, Kína
Shilin Xia
4 Az integratív gyógyászat klinikai laboratóriuma, Dalian Orvostudományi Egyetem első kórháza, Dalian, Kína
Jialin Qu
4 Az integratív gyógyászat klinikai laboratóriuma, Dalian Orvostudományi Egyetem első kórháza, Dalian, Kína
Huiyi Song
4 Az integratív gyógyászat klinikai laboratóriuma, Dalian Orvostudományi Egyetem első kórháza, Dalian, Kína
Jianjun Liu
4 Az integratív gyógyászat klinikai laboratóriuma, Dalian Orvostudományi Egyetem első kórháza, Dalian, Kína
Dong Shang
1 Integratív Orvostudományi Főiskola, Dalian Orvostudományi Egyetem, Dalian, Kína
2 Általános sebészeti osztály, Dalian Orvostudományi Egyetem első kórháza, Dalian, Kína
Absztrakt
Bevezetés
Az akut hasnyálmirigy-gyulladás (AP) a hasnyálmirigy steril gyulladásának egy típusa, amelyet az exokrin hasnyálmirigy diszfunkciója indít el, és amely megszakítja az egyensúlyt a védőenzimek és a stressz jelek között (Lankisch et al., 2015). A betegek többségében az állapot enyhe és önkorlátozó, de
Az esetek 20–30% -ában végül súlyos haláleset alakul ki, magas mortalitással a kezelés ellenére (Bakker et al., 2014). Gyorsan fejlődő állapotként az AP súlyossága rendkívül rövid idő alatt gyorsan változhat (Mentula és Leppaniemi, 2014). Az AP jelenlegi kezelése általában táplálkozási támogatás, fájdalomcsillapítók és proteázgátlók kombinált kezeléséből áll; sajnos ezek a terápiák korlátozott hatékonyságot mutatnak a célzás hiánya miatt (Tenner et al., 2013; Yokoe et al., 2015). Ezért sürgősen új diagnosztikai és terápiás módszereket kell keresni az AP-re.
A mikroRNS (miRNS) felfedezése egy teljesen új gondolkodási folyamatot indított el az AP diagnózisával és kezelésével kapcsolatban. A miRNS egyszálú, nem kódoló RNS, amely hasítással vagy transzlációs represszióval szabályozza a gének többségének expresszióját (Iorio és Croce, 2009). Újabb bizonyítékok vannak arra vonatkozóan, hogy a megváltozott miRNS expresszió megváltoztathatja azokat a sarkalatos fiziológiai funkciókat, amelyek részt vesznek a gyulladás beszivárgásában és több betegség, köztük az AP szövődményében (Hu et al., 2015; Kusnierz-Cabala et al., 2015; Maltby et al. ., 2016). Ezért összefoglaljuk a miRNS és az AP közötti összefüggéseket, hogy egy lehetséges diagnosztikai és terápiás eszközt kínáljunk ennek a betegségnek a kezelésére ebben a mini-áttekintésben.
miRNS expresszió a hasnyálmirigyben
Számos miRNS gyakran evolúciósan konzerválódott, és expressziójuk csak bizonyos fejlődési szakaszokra vagy bizonyos sejt- vagy szövettípusokra korlátozódik (Sood és mtsai, 2006). Ezért a miRNS expressziójának meghatározásának képessége az exokrin hasnyálmirigyben értékesnek bizonyul a miRNS AP-ben játszott feltételezett szerepeinek megértésében. Szafranska és mtsai. számolt be arról, hogy a miR-216 és miR-217 expresszióját az emberi hasnyálmirigy szövetének jellemzőjeként azonosították (Szafranska et al., 2007), amelyek szinte kizárólag patkány hasnyálmirigyben expresszálódnak (Wang et al., 2017). Mint normális hasnyálmirigy áll
90% -os acináris sejtekből könnyen azt gondolhatjuk, hogy a miR-216 (beleértve a rendkívül homológ miR-216a és miR-216b) és a miR-217 az acináris sejtekben gazdagodik, és kulcsszerepet játszik az exokrin hasnyálmirigy működésében (Meher és mtsai. (2015; Rouse et al., 2017). Sőt, Kong et al. számszerűsítve meghatározta a miR-216a relatív koncentrációját az egészséges patkányokból vett hasnyálmirigy-szövetekben, és 128-szor magasabbnak találta, mint a következő legnagyobb koncentrációjú vesében, ami azt jelzi, hogy a miR-216a hozzájárulhat a hasnyálmirigy-betegségek megkülönböztetéséhez más szövetektől betegségek (Kong et al., 2010). Dixit és mtsai. azonosította, hogy a miR-148a-3p, a miR-375-3p, a miR-217-5p és a miR-200a-3p az alapállapotban a leggyakoribb miRNS, míg a miR-421-3p, miR-24-5p és miR -29a-5p expressziója a legkevésbé az egér hasnyálmirigy-acináris sejtjeiben történik (Dixit et al., 2016). Ezenkívül a Let-7b és miR-495 és célgénjeik kontrollálnak egy transzkripciós hálózatot, amely a hasnyálmirigy acináris sejtjeinek differenciálódását vezérli, amelyek kritikus fontosságúak az acináris homeosztázis biztosítása szempontjából (Prevot és mtsai, 2013). A miRNS-ek ezen összefüggéseinek köszönhetően a hasnyálmirigy fiziológiai folyamatainak szabályozásában elengedhetetlen a miRNS-ek AP-expressziójának modulációjának megértése.
Aberrant miRNS expressziós szint akut pancreatitisben
Az AP súlyosságának korai diagnózisa a lehető legkorábban azonosíthatja a lehetséges súlyos akut hasnyálmirigy-gyulladás (SAP) kockázatát, és magas klinikai értéket adhat a beteg prognózisának javításához (Lee és mtsai, 2013). Jelenleg az amiláz és a lipáz hasnyálmirigy biomarkereit általában használják az AP korai előrejelzésében, de a klinikai gyakorlatban gyakran korlátozottak saját korlátok miatt (Treacy et al., 2001; Huang et al., 2016). A halmozódó bizonyítékok azt mutatták, hogy az AP patogenezissel kapcsolatos miRNS rendellenes expressziója e betegség diagnózisának és prognózisának jelölt biomarkerként szolgálhat (Kong et al., 2010; An et al., 2014; Dixit et al., 2016; Zhang et al. ., 2017). Az aberrált miRNS expressziós mintákat állatmodellekben és AP-ben szenvedő betegeknél az 1. táblázat mutatja .
Asztal 1
Aberrant miRNS expressziós szint akut pancreatitisben.
| miR-216a ↑ | Patkány/beteg plazma | Kong és mtsai., 2010; Blenkiron és mtsai, 2014; Zhang és mtsai, 2017 |
| miR-21-3p ↑ | Egér hasnyálmirigy-acini | Dixit és mtsai, 2016 |
| miR-122 ↑ | Egér plazma | Rivkin és mtsai, 2016 |
| miR-216a/miR-216b ↑ | Patkány plazma | Endo és mtsai, 2013 |
| miR-216a/miR-375 ↑ | Patkány szérum | Usborne és mtsai, 2014 |
| miR-216a/miR-217 ↑ | Patkány/egér szérum | Goodwin és mtsai, 2014; Wang et al., 2017 |
| miR-216a-5p/miR-375-3p/miR-148a-3p/miR-216b-5p/miR-141-3p ↑ | Patkány/kutya szérum | Smith és mtsai, 2016 |
| miR-216a/miR-216b/miR-217 ↑ | Patkány/kutya szérum | Calvano és mtsai, 2016; Rouse és mtsai, 2017 |
| miR-375/miR-217/miR-148a/miR-216a/miR-122/miR-214/miR-138 ↑ | Patkány Mesentericus nyirok | Blenkiron és mtsai, 2014 |
| miR-126-5p/miR-148a-3p/miR-216a-5p/miR-551b-5p/miR-375 ↑ | SAP betegek szérum | Kusnierz-Cabala et al., 2015 |
| miR-216a-5p/miR-551b-5p/miR-375 ↑ | MAP betegek szérum | Kusnierz-Cabala et al., 2015 |
| miR-92b/miR-10a/miR-7 ↓ | A betegek széruma | Liu és mtsai, 2014 |
| miR-24-3p/miR-361-5p/miR-1246/miR-222-3p ↑ miR-181a-5p ↓ | HTAP-betegek szérum | És mtsai., 2014 |
Állatok
Betegek
Az AP folyamat szabályozásában a miRNS specifitása és érzékenysége miatt jobb, mint a gyenge szövet- és sejtspecifitással rendelkező hagyományos biomarkerek (Beuvink és mtsai., 2007; Tombol és mtsai., 2009). Bár általánosan elfogadott, hogy az RNS könnyen lebomlik, ha RNázban gazdag szövetmintákból, például hasnyálmirigyből izolálják, Kim és mtsai. úgy vélték, hogy a szobahőmérsékleten történő hosszabb tárolás miatti RNS-lebontás nincs hatással a szövet-specifikus miRNS kvantitatív reverz transzkripciós polimeráz láncreakció (QRTPCR) prediktor prediktív erejére (Kim és mtsai, 2011). Ezenkívül számos miRNS képes ellenállni a különféle zord környezeteknek, például az ismételt fagyasztásnak és olvadásnak, vagy a magas savtartalmú vagy bázikus, extrém pH-értékű környezeteknek (Machado et al., 2015). Más biomarkerekkel összehasonlítva a miRNS expressziója stabil a testfolyadékokban, különösen a véráramban, felkeltve az érdeklődést a miRNS mint AP szérum- és/vagy plazmaalapú biomarkerek felhasználása iránt az AP diagnózis és a beteg rétegződése szempontjából (Mitchell et al., 2008; Kong et al., 2010; Liu et al., 2014). Az AP kórképi állapotában azonban különféle miRNS-ek vannak rendellenesen; így egy részletes miRNS-profilt kell létrehozni, amely más diagnosztikai módszerekre is hivatkozik a félreértelmezés elkerülése érdekében.
miRNS, amely szabályozza az akut pancreatitris-gén expressziót
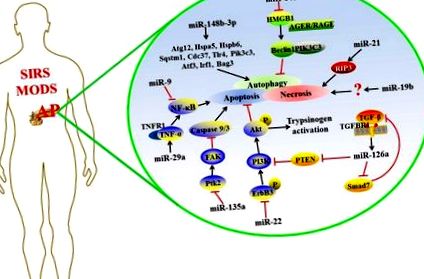
Nemrégiben kiderült, hogy egyes miRNS-ek szabályozzák a célgének expresszióját a bonyolult AP-ban, és a részletes mechanizmust az 1. ábra mutatja. 1 .
A miRNS-ek lehetséges mechanizmusai, amelyek a bonyolult AP-ben szabályozzák a cél expresszióját.
Apoptózis/nekrózis
Az apoptózis és a nekrózis a hasnyálmirigy-acináris sejtek AP halálozásának két fő mintája, és megfelelő körülmények között cserélődhetnek egymással (Bhatia, 2004; Mareninova et al., 2006). Az apoptózis megőrzi a membrán integritását az immunrendszer stimulálása nélkül, míg a nekrotikus sejtek károsodáshoz kapcsolódó molekuláris mintamolekulákat (DAMP) szabadítanak fel, amelyek gyulladásos kaszkádot váltanak ki (Bhatia, 2004).
A hasnyálmirigy-acináris sejtek nekrózisaránya és az azt követő gyulladás korrelál az akut nekrotizáló hasnyálmirigy-gyulladásban (ANP) szenvedő betegek halálozásával (Xu et al., 2015). Az egyre növekvő kutatások bebizonyították a miRNS-ek működését a hasnyálmirigy acináris sejtek nekrózisában, jelezve, hogy a miRNS potenciális célpont lehet az AP elleni gyógyszerfejlesztésben (Ma és mtsai, 2015; Hu és mtsai, 2016). A miR-19b fokozott expressziója ANP patkányokban vagy taurolithocholsav 3-szulfát dinátrium sóval (TLC-S) kezelt AR42J sejtekben elősegítheti a sejtek nekrózisát; ellenkező esetben a miR-19b törlése csökkentheti a nekrózis arányát (Hu et al., 2016). Ma és mtsai. számoljon be arról, hogy a miR-21 túlzottan expresszálódik az AP egérmodelljében; Az miR-21 gátlás véd a caerulein vagy L-arginin által kiváltott AP ellen, és hatékonyan csökkenti a betegség súlyosságát. Ezenkívül a miR-21 expressziójának elnémítása védelmet nyújt a TNF által kiváltott SIRS-ben. A MiR-21 elősegíti a TNF-α által indukált nekroptosist, egy olyan kóros állapotot, amely magában foglalja a receptor-interakciós fehérje 3 (RIP3) -függő szabályozott nekrózist (Ma és mtsai, 2015). A RIP3 a nekroszóma egyik olyan alkotóeleme, amelyet közvetlenül hasíthat és inaktiválhat a kaszpáz 8 a TNF-a által kiváltott nekroptózis negatív szabályozására (Kaiser és mtsai, 2011). Így az AP apoptózisában és/vagy nekrózisában kritikusan szerepet játszó miRNS-ek.
Autofágia
Az autofágia az evolúciós folyamat programozott sejthalálának egy formája, amelynek fő funkciója a sejt saját komponenseinek lizoszomális önemésztése a külső ingerekre adott válaszként (Jones és mtsai, 2013; Vernon és Tang, 2013). Számos tanulmány kimutatta, hogy az autofágia részt vesz az AP progressziójában, de funkciója az AP során még mindig ellentmondásos. Korábbi tanulmányok arról számoltak be, hogy a szelektív autofágia citoprotektív szerepet játszik azáltal, hogy kiküszöböli a felesleges zimogén-aktivációt, és csökkenti a tripszin által kiváltott hasnyálmirigy-sejtek pusztulását az AP megjelenésekor (Grasso et al., 2011). Egy másik ellentétes nézet az, hogy az autofágia hozzájárul az acináris sejtek vakuolusainak kialakulásához és a tripszinogén aktivációjához, mint az AP patogenezisének elsődleges mechanizmusához (Gukovsky et al., 2012).
TGF-β visszacsatolási út
A transzformáló növekedési faktor-β (TGF-β) egy multifunkcionális citokin, amely számos biológiai folyamatban vesz részt, beleértve a sejtek apoptózisát és az immunrendszer szabályozását (Mikami és mtsai, 2006). Beszámoltak arról, hogy a TGF-β és receptorai az AP-ben szenvedő betegeknél fokozottan szabályozottak (Friess et al., 1998; Wildi et al., 2007). A miR-216a expressziója dózisfüggő módon növekszik az AR42J sejtekben a TGF-β stimuláció után. Eközben az SB431542 TGF-β inhibitor csökkentheti a miR-216a expresszióját a hasnyálmirigy szövetében és a szérumban a cerulean által kiváltott AP egér modellben. A TGF-β súlyosbítja az AP-t a miR-216a felfelé szabályozó útján, amely a PTEN-t és Smad7-et célozza meg (Zhang et al., 2015). A PTEN a PI3K/Akt jelátviteli út szuppresszora, amely a sejt apoptózisával társul (Blanco-Aparicio és mtsai, 2007). A Smad7 blokkolja a TGF-β jelátviteli utat negatív visszacsatolási hurok révén, és keresztbeszéd közvetítőként is működik a TGF-β jelátvitel és mások között (Yan és Chen, 2011). Ezért a TGF-β/miR-216a jelátviteli út több biológiai folyamatot szabályoz az AP-ban.
NF-κB jelátviteli út
A mezenchimális őssejtek (MSC-k) az őssejt-családba tartoznak, és széles körben használják őket gén-szállító hordozóként exogén gének juttatására a sérült szövetekbe egy sejt-alapú terápiás stratégia céljából (Si et al., 2011). A MiR-9 a csontvelő eredetű mezenhimális őssejtek (BMSC) kulcsfontosságú parakrin molekulája, amelynek felfelé irányuló szabályozása gátolhatja a lipopoliszacharid (LPS) által kiváltott gyulladásos választ az emberi polimorfonukleáris neutrofilekben (PMN) és a perifériás vér mononukleáris sejtjeiben. (PBMC) (Bazzoni és mtsai, 2009). Qian és mtsai. megállapította, hogy a miR-9-módosított BMSC-k (pri-miR-9-BMSC-k) szignifikánsan csökkentették a hasnyálmirigy károsodását, valamint a szérum amiláz és lipáz aktivitását AP patkányokban. Eközben a gyulladásos faktorok csökkent felszabadulása és a nekrotizált hasnyálmirigy-szövetek fokozott regenerációja is megfigyelhető. Ezek az eredmények azt mutatják, hogy a miR-9 gyulladáscsökkentő tényező lehet az AP progressziójában. A BMSC-k miR-9-t juttatnak a sérült hasnyálmirigybe vagy PBMC-kbe, ami gyengítheti az NF-κB1/p50 gén SAP-célzását (Qian et al., 2017).
AP bekövetkezésekor a károsodott hasnyálmirigy-sejtek gyulladásgátló mediátorokat bocsátanak ki, hogy stimulálják a hasnyálmirigy, a hashártya és más szövetek makrofágjait (Gutierrez et al., 2008). Az aktivált makrofágok különféle gyulladásos citokineket választanak ki, ami gyulladás terjedését eredményezi (Jaffray és mtsai., 2000; Ni és mtsai, 2014). Ezért a makrofágokat célzó sejtszintű terápiák értékes áttörést érhetnek el az AP kezelésében. Felfedezték, hogy a sejtek közötti kommunikáció alapvető szerepet játszik a hasnyálmirigy-gyulladással összefüggő makrofágok aktiválásában (Lundberg et al., 2000). Úgy gondolják, hogy a miRNS az intercelluláris kommunikáció közvetítője, amelyet a befogadó sejtekbe szállítanak működésük szabályozása érdekében (Chevillet et al., 2014). A közelmúltban Zhao és mtsai kutatásainak eredményei azt mutatták, hogy az aktivált AR42J sejtek fokozták az NF-KB aktivációt a makrofágokban azáltal, hogy szekretálták a differenciálisan expresszált miRNS-eket hordozó exoszómákat (Zhao et al., 2016). Ezek a kutatások azt mutatják, hogy a miRNS úgy tűnik, hogy szabályozza az NF-KB által elősegített gyulladásos válaszokat az AP-ban.
a miRNS mint potenciális terápiás eszköz
a miRNS kulcsszerepet játszik a génexpresszió szabályozásában; így a miRNS funkció in vitro és in vivo manipulálása genetikai szinten potenciális terápia a betegség patogenezisének modulálására. A miRNS-inhibitorok (pl. Anti-miRNS-ek és miRNS-szivacsok) vagy fokozók (utánzók) felfedezése zavarja a miRNS-t, fokozva vagy gátolva a miRNS-célzott mRNS-ek transzlációját, ezáltal módosítva a fehérje expressziós szintjét, és nagyban elősegítve az új gyógyszerek (Ebert) kifejlesztését és munkatársai, 2007; Lennox és Behlke, 2011; Robb és mtsai, 2017). Jelenleg a miRNS-ek terápiás kiaknázásának fő korlátozása a biológiai tulajdonságaikból adódó nemkívánatos mellékhatások valószínűsége, amelyekben az egyes miRNS-ek több downstream célpontot modulálnak, és az egyes miRNS-ekbe való beavatkozás egyszerre széles hatásokat gyakorolhat több sejtes útvonalra, és potenciálisan ellensúlyozni fogja. a kívánt terápiás hatások, különösen akkor, ha szisztémás gyógyszeradagolást alkalmaznak (Baker, 2010). Ezért a jövőbeli kutatások során személyre szabott miRNS-terápiára van szükség az egyéb funkciók zavartalan fenntartása és a gyógyszeradagoló rendszerek optimalizálása érdekében.
Következtetés
Ebben a mini-áttekintésben megvitattuk a miRNS-ek ígéretes szerepét az AP hatékonyabb terápiáinak kidolgozásában, azon kívül, hogy potenciális diagnosztikai eszközként működnek. Bár néhány miRNS-t felfedeztek, hogy közvetlen vagy közvetett összefüggést mutassanak az AP progressziójával, a miRNS AP kezelésben történő alkalmazásának vizsgálata továbbra is a fejlesztési szakaszban van. Ezek az alapkutatások nagyszámú értékes információt nyújthatnak a miRNS-diagnosztikai alkalmazás klinikai népszerűsítéséhez és az AP-kezelés jövőbeli fejlesztéséhez.
Szerzői hozzájárulások
HX, XT, SX, JQ, HS, JL és DS írta a kéziratot.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
- Pajzsmirigy működése akut hasnyálmirigy-gyulladásban - PubMed
- A bél szerepe a súlyos akut pancreatitis patofiziológiájában és kezelésében -
- A kezelés felülvizsgálata és a súlyos akut hasnyálmirigy-gyulladás prognózisát befolyásoló tényezők
- Melyek az akut hasnyálmirigy-gyulladás tünetei
- Milyen étrend alkalmas heveny idiopátiás hasnyálmirigy-gyulladásra pszeudocisztával