A p53 mutánsok funkcióaktivitásának új növekedése: a dUTPáz gén expressziójának aktiválása, amely 5-fluorouracillal szembeni rezisztenciához vezet
Absztrakt
Bevezetés
A p53 mutánsok funkcionális aktivitásának növekedése mögött álló mechanizmusok továbbra sem ismeretesek. Egyes tanulmányok hangsúlyozzák az N-terminális transzkripció-aktivációs domén fontosságát a mutáns p53 funkciófenotípus-nyereség expressziójában (Lanyi és mtsai, 1998; Lin és mtsai, 1995). Úgy tűnik, hogy a p53 mutánsok képesek aktiválni olyan gének promotereit, amelyeket általában nem aktiválnak a vad típusú fehérjék. Ezek között vannak az MDR1 promóterei (Chin és mtsai, 1992; Dittmer és mtsai, 1993; Kopnin és mtsai, 1995), a PCNA (Deb és mtsai, 1992), a HSP70 (Tsutsumi-Ishii és mtsai, 1995)., 15-lipoxigenáz (Kelavkar és Badr, 1999), BAG-1 (Yang és mtsai, 1999) és c-myc (Frazier et al., 1998) gének. Nem világos, hogy a mutáns p53 közvetlenül transzkripciós faktorként működik-e megváltozott szekvenciaspecifitással, vagy a pozitív vagy negatív transzkripciós szabályozásért felelős tényezőkkel való kölcsönhatással módosítja-e a gének expresszióját. Figyelembe véve, hogy a missense p53 mutánsok milyen gyakorisággal fordulnak elő az emberi rákban, egyértelmű, hogy a funkció növekedésének hátterében álló mechanizmusok megértése, valamint a p53 mutánsok által szabályozott gének azonosítása segíthet a rák kezelésének racionális stratégiáinak kidolgozásában.
Ebben a tanulmányban megmutatjuk, hogy a mutáns p53 bizonyos típusai képesek kiváltani a dUTPáz gén expresszióját, és ennek eredményeként fokozzák a sejtek rezisztenciáját a fluor-pirimidin gyógyszerekkel szemben. Ez a megfigyelés egy lehetséges mechanizmust biztosít bizonyos rosszindulatú daganatok 5-FU-val szembeni fokozott rezisztenciájához, és potenciális értéke lehet a kemoterápiára való érzékenység előrejelzésében a mutáns p53 expresszió elemzése alapján.
Eredmények és vita
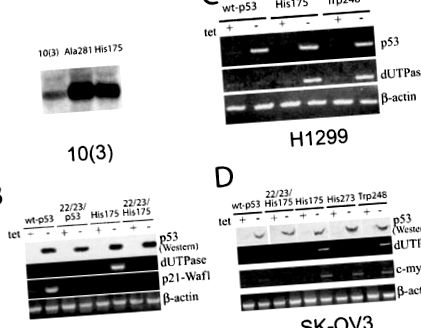
Kipróbáltuk, hogy a daganatból származó p53-mutánsok p53 negatív sejtekbe juttatott különböző formáinak expressziója befolyásolhatja-e a dUTPáz expresszióját és az 5-FU iránti érzékenységet. A His175 és Ala281 p53 mutánsok konstitutív méhen kívüli expressziója a p53-negatív egér sejtvonalban 10 (3) a dUTPáz transzkriptumok szignifikáns növekedését eredményezi, ahogy azt Northern-blot hibridizáció mutatja (1a. Ábra). Ez az eredmény összhangban áll azzal a ténnyel, hogy a dUTPáz cDNS klón nagy arányban volt jelen a 10 (3) -His175-ből származó kivonási könyvtárban. vs. 10 (3) sejtvonal.
Változások a dUTPáz gén transzkriptumokban a p53 negatív sejtekben a p53 mutánsok méhen kívüli expressziója után. (a) Az Ala281 és His175 p53 mutánsokat expresszáló 10 (3) egérsejtek teljes RNS-jének (20 μg) Northern-blot-hibridizációja jelölt egér dUTPáz-cDNS-próbával. (b) A dUTPáz transzkriptumok RT – PCR elemzése egérsejtekben 10 (1), amelyekben tetraciklinnel szabályozott konstrukciók vannak, amelyek expresszálják a wt-p53, 22/23-p53 és 22/23/His175 p53 expressziót (+) jelenlétében és ezt követően 24 órával 1 μg/ml tetraciklin eltávolítása (-). RT-PCR-t p21-Waf1 primerekkel alkalmaztunk a wt-p53 transzkripciós aktivitásának kontrolljaként. A cDNS minták normalizálásához béta-aktin primereket használtunk. (c) A tetraciklinnel szabályozott wt-p53, His175 p53 és Trp248 p53 hordozó H1299 humán tüdőrákos sejtekben a dUTPáz transzkriptumok RT – PCR elemzése. RT-PCR-t humán p53-ra specifikus primerekkel alkalmaztunk a p53 expresszió indukciójának szabályozására. (d) A dUTPáz transzkriptumok RT – PCR elemzése humán petefészek karcinóma sejtekben, SK-OV3, amelyekben tetraciklinnel szabályozott wt-p53, 22/23/His175 p53, His175, His273 p53 és Trp 248 p53 található. RT – PCR humán specifikus primerekkel c-myc Ezeket az egyik gén expressziójának monitorozására használtuk, amelyről ismert, hogy a mutáns p53s szabályozza őket
Annak tesztelésére, hogy a p53 missense mutáció típusától függően lehet-e valamilyen specifikus hatás a dUTPáz expressziójára, két további daganatból származó forró folt mutáns p53 cDNS-t, His273 és Trp248 expresszáltak p53 negatív sejtekben. Míg a Trp248 p53 mutáns hasonló indukciót mutatott a dUTPáz transzkriptumokban, a His273 nem mutatott látható hatást mind az SK-OV3 (1d. Ábra), mind a H1299 sejtvonalakban (nem látható). A p53 mutánsoknak ez a differenciális hatása a dUTPáz génre volt specifikus, mivel c-myc, egy másik gént, amelyről ismert, hogy reagál a p53 mutánsokra (Frazier et al., 1998), mindhárom mutáns egyformán indukálta (1d. ábra). Az eredmény hasonló volt az SK-OV3 és H1299 sejtvonalakkal (nem látható).
10 (1) sejtvonal kialakulása növekvő koncentrációjú 5-FU jelenlétében (a) és doxorubicin (b). 10 (1) sejt telepképzése 5-FU és doxorubicin (DOX) jelenlétében (c), H1299 sejtek (d) és SK-OV3 sejtek (e) p53 mutánsok tetraciklinnel szabályozott expressziójával (tet +) és (tet-) tetraciklin nélkül a táptalajban
Két p53 negatív humán H1299 és SK-OV3 sejtvonalban jó összefüggést találtak a p53 mutánsok azon képessége között, hogy növeljék a dUTPáz gén expresszióját, és hogy növeljék a 150 n M 5-FU jelenlétében képződött telepek számát (2d, e ábra). A kolóniaképződés legnagyobb növekedését a His175 p53 mutánsnál tapasztaltuk. Egy másik p53 mutáns, a Trp248, szintén képes volt növelni az 5-FU-rezisztens telepek számát, bár a hatás mérsékelt volt. Ezzel szemben az SK-OV3 sejtekben túlzottan expresszált His273 p53 mutáns nem eredményezte sem a dUTPáz transzkriptumok növekedését, sem pedig a sejtek túlélését 150 n M 5-FU jelenlétében (1d. És 2e. Ábra). Meg kell jegyezni, hogy a p53 mutánsok expressziója a vizsgált sejtvonalakban nem eredményezett változást a doxorubicin jelenlétében kialakult telepek számában. Ezért a hatást nem a sejtek túlélésének némi nem specifikus növekedése okozta, hanem a fluor-pirimidin-gyógyszerekkel szembeni rezisztenciára korlátozódott.
Az EGFP-vel jelölt 10 (1) és 10 (1) -His175 sejtek arányának változásai p53 mutánsokat expresszáló jelöletlen 10 (1) sejtvonalakkal vagy értelemben és antiszenszben rekombináns egér dUTPáz cDNS-sel alkotott keverékekben. A jelölt és a jelöletlen sejteket 50: 50 arányban összekevertük, mielőtt 5-FU-val kezeltük volna (lásd: Anyagok és módszerek). Az EGFP-vel jelölt sejtek arányát a FACScan segítségével határoztuk meg
Anyagok és metódusok
Sejtvonalak
Az összes sejtvonalat 10% FBS-sel kiegészített DMEM-ben növesztettük 37 ° C-on és 5% CO2-val. Az egér p53-null fibroblaszt sejtvonalait 10 (3) (Harvey és Levine, 1991), bevitt His175 és Ala281 p53 mutánsokkal, a MuMLV LTR ellenőrzése alatt, korábban leírtuk (Pugacheva et al., 2000). A p53 mutánsok tetraciklinnel szabályozott expressziójához egér 10 (1) és 10 (3) (Harvey és Levine, 1991) és humán SK-OV3 (ATTC HTB-77) és NCI-H1299 (ATCC CRL-5803) p53-null a sejtvonalakat először pPS-tTA-hygro retrovírus vektorral fertőzték, amely expresszálta a tetraciklin-függő transzaktivátor fehérjét, a tTA-t (Gossen és Bujard, 1992). A kiválasztott funkcionális tTA-expresszáló klónokat öninaktiváló retrovirális vektorokkal (pSIT-neo) fertőztük, amelyek különböző mutáns p53-kat (His175, Trp248, His273, Leu22/Trp23, His175/Leu22/Trp23) hordoztak, tetraciklin-függő promoter irányítása alatt. A G418-rezisztens tenyészeteket szelektáltuk és 250 ng/ml doxiciklin jelenlétében tartottuk a p53 expressziójának elnyomására. A p53 expresszió indukálásához a sejteket doxiciklinmentes közegben inkubáltuk 24–48 órán át.
Western blot elemzés
A sejteket kétszer PBS-sel mostuk, Petri-csészékből hideg PBS-ben kapartuk ki, majd rövid centrifugálással. A 10 (1) sejtpelletet pufferben (50 mM Tris-HCl, pH 7,5, 150 mM NaCl, 0,5% NP-40 és 1 mM EDTA) lizáltuk, 1 m D ditiotreitol, 100 μ M PMSF hozzáadásával. 1 μ M pepsztatin A és 1 μ M E64). Az SK-OV3 és H1299 sejtpelleteket RIPA pufferben lizáltuk. Egyenlő mennyiségű teljes fehérjét (kb. 600 μg) használtunk egy éjszakán át történő immunprecipitációhoz a p53 specifikus monoklonális PAb421 antitestekkel, amelyek 4 ° C-on keresztkötve voltak a protein A-Sepharose CL4B-vel. A kivált fehérjéket 10% -os SDS – PAAG elektroforézissel elválasztottuk, átvittük az Immobilon-P (Millipore) membránra, szondáztattuk a p53 specifikus PAb421 monoklonális antitestekkel, és peroxidázzal konjugált anti-egér IgG és ECL-Plus Western blot reagenseket (Amersham) fejlesztettünk ki.
Északi hibridizáció
A teljes RNS-t Trizol reagenssel (GIBCO – BRL) izoláltuk. 1% agarózgélen történő elválasztást, kapilláris transzfert Hybond-N membránra és hibridizációt végeztünk egy megfelelő 32 P-jelölt cDNS-próbával a publikált protokollok szerint (Sambrook et al., 1989). Minden gélre felvitt minta 20 μg teljes RNS-t tartalmazott. A próbaként használt dUTPáz cDNS-t RACE PCR-rel nyertük.
Félkvantitatív RT – PCR
A cDNS-t 5 μg teljes RNS-re szintetizáltuk oligo- (dT) 18–23 primerrel és AMV reverz transzkriptázzal a gyártó ajánlása szerint (Amersham PLC). A PCR-amplifikációkat olyan primerekkel hajtottuk végre, amelyek 126 bp fragmentumot hoztak létre az egér dUTPáz cDNS-jéből: 5′-AGCATTTGGTGTTCTAGGATGCAGGA; 5′-ACCAAGTCTGCATGTCAATGCCATGCTC; A humán dUTPáz cDNS 520 bázispár hosszúságú fragmense: 5′-CGGGATCCCGCCTTCTGGCTCTGCCATGCCCTGC-3 ’; 5′-GGAATTCGCATAAATTTTAATTCTTTCCAGTG-3 ’; 5'-GGAATTCGCATAAATTTTAATTCTTTCCAGTG-3 ', az egér p21-WAF1 cDNS-jének 278 bp-os fragmense: 5'-CCGAGAACGGTGGAACTTTGA; 5′-GTTTTCGGCCCTGAGATGTTG; 589 bp emberi fragmentum-myc cDNS: 5′-AAGATGAGGAAGAAAACGATGTTG; 5′-ACATTTCTGTTAGAAGGAATCGT; és 604 bp fragmentum, amely megfelel a béta-aktin cDNS-nek: 5′-AAGATGACCCAGATCATGTTTGAGACC; 5′-GCAGTAATCTCCTTCTGCATCCTGTCA. Az amplifikációt HotTub DNS-polimerázzal (Amersham) végeztük 20, 25 és 30 cikluson keresztül. A PCR termékeket agarózgél-elektroforézissel választottuk el.
Hivatkozások
Aherne GW, Browne S. 1999 Rákellenes gyógyszerfejlesztési útmutató: Antifolátus gyógyszerek a rákterápiában Jackman AL (szerk.) Totowa, NJ: Humana Press, Inc. 409–421
Benhattar J, Cerottini JP, Saraga E, Metthez G, Givel JC. 1996 Int. J. Cancer 69: 190–192
Blandino G, Levine AJ, Oren M. 1999 Onkogén 18.: 477–485
Bottini A, Berruti A, Bersiga A, Brizzi képviselő, Brunelli A, Gorzegno G, DiMarco B, Aguggini S, Bolsi G, Cirillo F, Filippini L, Betri E, Bertoli G, Alquati P, Dogliotti L. 2000 Clin. Cancer Res. 6.: 2751–2758
Bunz L, Hwang PM, Torrance C, Waldman T, Zhang Y, Dillehay L, Williams J, Lengauer C, Kinzler KW, Vogelstein B. 1999 J. Clin. Invest. 104: 263–269
Cabelguenne A, Blons H, de Waziers I, Carnot F, Houllier AM, Soussi T, Brasnu D, Beaune P, Laccourreye O, Laurent-Puig P. 2000 J. Clin. Oncol. 18.: 1465–1473
Canman CE, Radany EH, Parsels LA, Davis MA, Lawrence TS, Maybaum J. 1994 Cancer Res. 54.: 2296–2298
Chin KV, Ueda K, I. Pastan, Gottesman MM. 1992 Tudomány 255: 459–462
Deb S, Jackson CT, Subler MA, Martin DW. 1992 J. Virol. 66: 6164–6170
Dittmer D, Pati S, Zambetti G, Chu S, Teresky AK, Moore M, Finlay C, Levine AJ. 1993 Nat. Közönséges petymeg. 4: 42–46
Donehower LA, Harvey M, Slagle BL, McArthur MJ, Montgomery Jr Kalifornia, Butel JS, Bradley A. 1992 Természet 356: 215–221
el-Deiry WS. 1998 Szemin. Cancer Biol. 8.: 345–357
Frazier MW, He X, Wang J, Gu Z, Cleveland JL, Zambetti GP. 1998 Mol. Sejt. Biol. 18.: 3735–3743
Gloushankova N, Ossovskaya V, Vasziljev J, Chumakov P, Kopnin B. 1997 Onkogén 15: 2985–2989
Gossen M, Bujard H. 1992 Proc. Natl. Acad. Sci. USA 89: 5547–5551
Greenblatt MS, Bennett WP, Hollstein M, Harris CC. 1994 Cancer Res. 54.: 4855–4878
Harvey DM, Levine AJ. 1991 Genes Dev. 5.: 2375–2385
Hsiao M, Low J, Dorn E, Ku D, Pattengale P, Yeargin J, Haas M. 1994 Am. J. Pathol. 145: 702–714
Kelavkar UP, Badr KF. 1999 Proc. Natl. Acad. Sci. USA 96: 4378–4383
Kopnin BP, Stromskaya TP, Kondratov RV, Ossovskaya VS, Pugacheva EN, Rybalkina EY, Khokhlova OA, Chumakov PM. 1995 Oncol. Res. 7: 299–306
Kremenetskaya OS, Logacheva NP, Baryshnikov AY, Chumakov PM, Kopnin BP. 1997 Oncol. Res. 9.: 155–166
Ladner RD, Lynch FJ, Groshen S, Xiong YP, Sherrod A, Caradonna SJ, Stoehlmacher J, Lenz HJ. 2000 Cancer Res. 60: 3493–3503
Lanyi A, Deb D, Seymour RC, Ludes-Meyers JH, Subler MA, Deb S. 1998 Onkogén 16.: 3169–3176
Levine AJ. 1997 Sejt 88: 323–331
Levine AJ, Wu MC, Chang A, Silver A, Attiyeh EF, Lin J, Epstein CB. 1995 Ann. NY Acad. Sci. 768: 111–128
Li R, Sutphin PD, Schwartz D, Matas D, Almog N, Wolkowicz R, Goldfinger N, Pei H, Prokocimer M, Rotter V. 1998 Onkogén 16.: 3269–3277
Lin J, Teresky AK, Levine AJ. 1995 Onkogén 10.: 2387–2390
Lindhal T. 1982 Annu. Tiszteletes Biochem. 51: 61–87
Liu G, McDonnell TJ, Montes de Oca Luna R, Kapoor M, Mims B, El-Naggar AK, Lozano G. 2000 Proc. Natl. Acad. Sci. USA 97: 4174–4179
J Lotem, Sachs L. 1995 Proc. Natl. Acad. Sci. USA 92: 9672–9676
D Matas, Sigal A, Stambolsky P, Milyavsky M, Weisz L, Schwartz D, Goldfinger N, Rotter V. 2001 EMBO J. 20: 4163–4172
Michalovitz D, Halevy O, Oren M. 1991 J. Cell Biochem. 45: 22–29
Peled A, Zipori D, Rotter V. 1996 Cancer Res. 56: 2148–2156
Pugacheva EN, Snegur IN, Kopnin BP, Chumakov PM. 2000 Mol. Biol. 34: 143–151
Sambrook J, Fritsch E, Maniatis T. 1989 Molekuláris klónozás New York: Cold Spring Harbor Laboratory Press
Sionov RV, Moallem E, Berger M, Kazaz A, Gerlitz O, Ben-Neriah Y, Oren M, Haupt Y. 1999 J. Biol. Chem. 274: 8371–8374
Sun Y, Nakamura K, Wendel E, Colburn N. 1993 Proc. Natl. Acad. Sci. USA 90: 2827–2831
Tsutsumi-Ishii Y, Tadokoro K, Hanaoka F, Tsuchida N. 1995 Sejtnövekedés különbözik. 6.: 1–8
Wolf D, Harris N, Rotter V. 1984 Sejt 38: 119–126
Yang X, Pater A, Tang SC. 1999 Onkogén 18.: 4546–4553
Zheng M, Wang H, Zhang H, Ou Q, Shen B, Li N, Yu B. 1999 J. Cancer Res. Clin. Oncol. 125: 357–360
Szerzői információk
Elena N Pugacseva
Jelenlegi cím: Fox Chase Cancer Center, 7701 Burtholme Avenue, Philadelphia, 19111, Pennsylvania, PA, USA
Alekszej V. Ivanov és Peter M. Csumakov
Jelenlegi cím: Lerner Kutatóintézet Molekuláris Biológiai Tanszék, Cleveland Clinic Foundation, 9500 Euclid Avenue, Cleveland, 44195, Ohio, OH, USA
Arnold J Levine
Jelenlegi cím: Rockefeller University, 1230 York Avenue, New York, 10021, NY, USA
Hovatartozások
Engelhardt Molekuláris Biológiai Intézet, Orosz Tudományos Akadémia, Vavilov utca 32, Moszkva, 117984, Oroszország
Elena N Pugacseva, Julia E Kravchenko és Peter M Chumakov
Molekuláris genetikai tanszék, Illinoisi Egyetem, Chicago, Chicago, 60607, Illinois, IL, USA
Alekszej V. Ivanov és Peter M. Csumakov
Rákkeltési Intézet, Orosz Rákkutató Központ, Moszkva, Kasirszkoje shosse 24, Moszkva, 115478, Oroszország
Molekuláris Biológiai Tanszék, Princeton Egyetem, Princeton, New Jersey, USA
Elena N Pugacheva és Arnold J Levine
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
Levelezési cím
Jogok és engedélyek
Erről a cikkről
Idézd ezt a cikket
Pugacseva, E., Ivanov, A., Kravcsenko, J. et al. A p53 mutánsok funkcióaktivitásának új növekedése: a dUTPáz gén expressziójának aktiválása, amely 5-fluorouracillal szembeni rezisztenciához vezet. Onkogén 21, 4595–4600 (2002). https://doi.org/10.1038/sj.onc.1205704
Beérkezett: 2002. január 2-án
Felülvizsgált: 2002. május 15
Elfogadva: 2002. május 22
Publikálva: 2002. július 05
Kibocsátás dátuma: 2002. július 11
Kulcsszavak
- mutáns p53
- gyógyszer-rezisztencia
- funkciónyereség
További irodalom
A pirimidin metabolizmusának nem proliferatív szerepe a rákban
Molekuláris anyagcsere (2020)
A miR ‐ 200b ‐ 3p mérsékli az oxaliplatin rezisztenciát a TUBB3 célzásával vastagbélrákban
- Yu ‐ Zhu Wu
- , Hong ‐ Yue Lin
- , Yin Zhang
- & Wen-Fa Chen
A Journal of Gene Medicine (2020)
A p53 mutációk által közvetített rákellenes gyógyszerrezisztencia leküzdése felé
- Xin Cao
- , Jiayun Hou
- , Quanlin An
- , Yehuda G. Assaraf
- És Xiangdong Wang
Kábítószer-ellenálló frissítések (2020)
A p-STAT3 exoszómális transzferje elősegíti a megszerzett 5-FU rezisztenciát a vastagbélrák sejtjeiben
- Qian Zhang
- , Rui-Xian Liu
- , Ka-Wo Chan
- , Jiancong Hu
- , Jingdan Zhang
- , Lili Wei
- , Huiliu Tan
- , Xiangling Yang
- & Huanliang Liu
Journal of Experimental & Clinical Cancer Research (2019)
A p53R248Q mutáns szabályozza az oxidatív foszforilációt, és ugregulálja a glikolízist normoxia és hypoxia alatt az emberi méhnyakrák sejtjeiben
- Ileana Hernández-Reséndiz
- , Juan Carlos Gallardo-Pérez
- , Ambar López-Macay
- , Diana Xochiquetzal Robledo-Cadena
- , Enrique García-Villa
- , Patricio Gariglio
- , Emma Saavedra
- , Rafael Moreno-Sánchez
- & Sara Rodríguez-Enríquez
Journal of Cellular Physiology (2019)
- Az elhízásra reagálva a gén kifejeződésének nemspecifikus változásai különböző FGF21-hez kapcsolódnak
- Az inzulin csökkentése a feltételes részleges géneltávolítással felnőtteknél megfordítja az étrend által kiváltott súlygyarapodást
- A súlygyarapodás megakadályozása Egészséges testsúly, táplálkozás és fizikai aktivitás CDC
- Új DNS-kationos lipidek szintézise, aktivitása és felépítése - aktivitás-kapcsolat tanulmányok
- A tudósok azonosítják a vékonysághoz kapcsolódó gént, amely segíthet ellenállni a súlygyarapodásnak - írja a ScienceDaily