A piócák alkalmazását követő fertőzések: két esetjelentés és az irodalom áttekintése
Benjamin Maetz
1 Plasztikai és Maxillo-Arcsebészeti Osztály, Hôpitaux Universitaires de Strasbourg, 1, Place de l’Hôpital, Strasbourg Cedex, 67091, Franciaország
Ralph Abbou
1 Plasztikai és Maxillo-Arcsebészeti Osztály, Hôpitaux Universitaires de Strasbourg, 1, Place de l’Hôpital, Strasbourg Cedex, 67091, Franciaország
Jean Baptiste Andreoletti
2 Plasztikai és Rekonstruktív Sebészeti Osztály, Kórház Emile Muller, 20, Rue Laennec, Mulhouse, 68100, Franciaország
Catherine Bruant-Rodier
1 Plasztikai és Maxillo-Arcsebészeti Osztály, Hôpitaux Universitaires de Strasbourg, 1, Place de l’Hôpital, Strasbourg Cedex, 67091, Franciaország
Absztrakt
Bevezetés
Az 1980-as évek óta a piócákat ötletesen használják a vénás csappantyútorlódások kezelésében. Az antikoaguláns anyagok jelenléte a nyálukban javítja a vérelvezetést. Emésztőrendszerük számos baktériumfajt tartalmaz, amelyek közül a fő az Aeromonas hydrophila és az Aeromonas veronii biovar sobria, amelyek hozzájárulnak a bevitt vér emésztéséhez. Ezek a baktériumok okozhatják a fertőzéseket.
Eset bemutatása
Két, az Aeromonas veronii biovar sobriával kapcsolatos szeptikémia esetéről számolunk be, miután piócákat alkalmaztunk túlterhelt keresztirányú rectus abdominis myocutan flappokban késleltetett emlőrekonstrukciók esetén.
Az 1. számú beteg egy 55 éves kaukázusi nő volt, akit késleltetett mellrekonstrukciós eljárásnak vetettek alá. A hatodik posztoperatív napon a septicemia klinikai bemutatóját mutatta. Az Aeromonas veronii biovar sobriát a beteg bőr- és vér bakteriológiai mintáiban azonosították. Láza 4 napos antibiotikum-kezelés után megszűnt.
A 2. számú beteg egy 56 éves kaukázusi nő volt, akit késleltetett mellrekonstrukciós eljárásnak vetettek alá. A hetedik posztoperatív napon észrevettük, hogy a septicemia klinikai megjelenését mutatta. Az Aeromonas veronii biovar sobriát a páciens vérkultúrájában és helyi bakteriológiai mintákban azonosították. Egy antibiotogram rezisztenciát mutatott az amoxicillin/klavulánsavval szemben. Láza a műtétet követő tizenegyedik napon szűnt meg 4 napos antibiotikum-kezelés után.
Következtetés
A piócák alkalmazása után a fertőzés mértéke nem elhanyagolható. Az Aeromonas koncentrációja a piócák emésztőrendszerében nagymértékben csökken, ha a páciens antibiotikum terápiában részesül. Ezek a csírák érzékenyek a harmadik generációs cefalosporinokra és fluorokinolonokra, és rezisztensek az amoxicillinnel/klavulánsavval szemben. Javasoljuk az aszepszis klasszikus mértékein alapuló megelőző kezelést és a fluorokinolonnal szájon át alkalmazott antibiotikumok kezelését a piócákkal végzett kezelés teljes időtartama alatt.
Bevezetés
A piócákat Kr.e. 3500 óta használják terápiás célokra. Tulajdonságait egykori Egyiptomban, Kínában és Indiában fedezték fel. A thébai sírban (a 18. dinasztia fáraóinak eredete) egy falfestményt fedeztek fel, amely egy nővért látott piócával a beteg homlokára. Az első írásos utalás Kr. E. Második századra nyúlik vissza. és a mérgező harapások kezelésével foglalkozik. A piócák használata a XIX. Században érte el a csúcspontot különböző indikációk esetén: gégegyulladás, szemészeti problémák, agyi apopleksiia, elhízás és mentális rendellenességek. 1884-ben Haycraft felfedezte a hirudint, amely a piócák nyálának fő antikoaguláns anyaga [1]. 1955-ben Markwardt elsőként izolálta a hirudint a piócák garatmirigyéből. Manapság ezt az anyagot csak géntechnológia állítja elő. Foucher 1981-ben írta le először a piócák alkalmazását a vénás torlódások kezelésében a digitális újratelepítés során [2]. Azóta a piócát különösen a vénás vízelvezetési problémák kezelésére alkalmazzák [3].
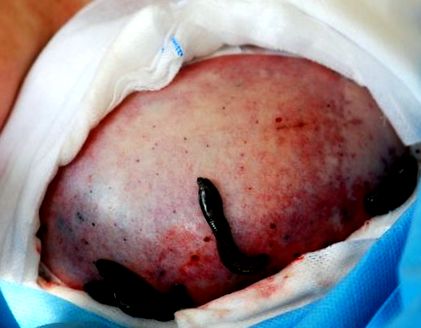
A klinikai gyakorlatban a kezelendő területet antiszeptikus oldattal, majd fiziológiás szérummal kell megtisztítani, mert a piócák nagyon érzékenyek a szagokra [7]. A folyamat során a piócákat kesztyűvel kezelik. Ha a pióca nem tapad a megfelelő helyre, akkor a piócát a megfelelő helyre kell mozgatni. Ha a piócák elegendő vért nyernek, akkor maguk is leesnek. A piócák kézi eltávolítása apró flegmonokat okozhat, amelyek fertőzés forrását jelentik. A piócákat naponta egyszer vagy kétszer alkalmazzák, amíg a kapilláris keringés helyre nem áll (4 vagy 5 nap; 1. ábra).
A piócák által kezelt vénás torlódások.
Franciaországban a gyógyszeres piócákat a Ricarimpex® szállítja. Használat előtt a piócákat hűtőszekrényben, steril vízzel ellátott tálban tartják. A piócákat 5 ° C és 7 ° C (42 ° F és 45 ° F) közötti, de legfeljebb 20 ° C (68 ° F) hőmérsékleten ajánlott tárolni. A vizet hetente cserélni kell, és havonta egyszer bakteriológiai mintát kell venni. A piócák bélflóra az Aeromonas hydrophila és az Aeromonas veronii biovar sobria [8] alkotta részből áll, megkönnyítve a mintavételezett vörösvérsejtek emésztését. 1983 óta számos ilyen baktérium okozta fertőzést írtak le orvosi alkalmazás után [9].
Két, az A. veronii-hoz kapcsolódó szeptikémia esetéről számolunk be, miután a piócákat a túlterhelt transzverzális rectus abdominis myocutanán (TRAM) alkalmazzák a késői emlőrekonstrukciók előtt, mielőtt áttekintenék a témával foglalkozó nemzetközi szakirodalmat.
Eset bemutatása
1. számú beteg
Az első beteg egy 55 éves kaukázusi nő volt, aki mellrákos masztektómián esett át, amelyet sugárterápia és kemoterápia követett. Három évvel a kezelések után késleltetett mellrekonstrukción esett át egy pedikeres TRAM fedéllel.
A hatalmas és azonnali vénás torlódás miatt 12 órával később egy második műtéten kellett átesnie, és a fedelet vissza kellett helyezni a kiinduló helyzetbe. A tartós vénás torlódások miatt a piócákkal végzett kezelést 2 nappal a második műtét után elkezdték. Sem az intraoperatív, sem a beteggel kapcsolatos kockázati tényező nem magyarázhatja a megfigyelt vénás torlódást.
A hatodik posztoperatív napon, 4 napos pióca után a fedél vaszkuláris állapota javult, de a páciens klinikailag bemutatta a 39,2 ° C-os hipertermiával, a fehérvérsejtszám 27,44 10 9/l és a C-reaktív fehérje (CRP) szintje 153 mg/l-rel nőtt.
Míg a vérkultúrákat és a helyi bakteriológiai tamponokat elemezték, megkezdték az intravénás antibiotikum-terápiát, beleértve a vankomicint (1,5 g/nap) és a cefotaximot (6 g/nap) 10 napig, és az amikacint (350 mg/nap) 2 napig.
Az A. veronii biovariás sobriát a bőr és a vér bakteriológiai mintáiban azonosították.
A láz 4 napos antibiotikum-kezelés után megszűnt. 10 nap elteltével orális klindamicin antibiotikus terápiát írtak fel 10 napig. A szárnyat 48 órás apyrexia után a 12. napon visszahelyeztük az emlő helyzetébe. A beteg a 19. napon hagyta el a kórházat.
2. számú beteg
A második páciens egy 56 éves kaukázusi nő volt, akin átesés masztektómiát hajtottak végre az első emlőrák után, amelyet tumorectomiával kezeltek, majd sugárterápiával. A mell azonnali rekonstrukciójának lehetőségei ellenére nem volt hajlandó ilyen eljárásnak alávetni magát. Tíz hónappal később egy késleltetett eljárás motiválta. Mivel abban az időben nem voltunk hozzászokva mélyen alsóbbrendű epigasztrikus perforátorcsappantyúkhoz, emlőrekonstrukciót hajtott végre egy pedikeres TRAM fedéllel.
Az intraoperatív szövődmények és a pácienssel kapcsolatos kockázati tényezők hiánya ellenére a fedél korai vénás torlódást mutatott, amelyet a műtét utáni második és ötödik nap között pióca és heparin-nedves géz kezelt. Részleges nekrózis telepedett az emlő és a has területére.
A hetedik posztoperatív napon észleltük a szeptikémia klinikai bemutatását, amely 39,8 ° C-os hipertermiával, a fehérvérsejtszám 15 × 109/l-rel és a CRP-szinttel 114 mg/l-rel emelkedett.
A műtét utáni nyolcadik napon nekrotikus terület kivágását végeztük, intravénás valószínűségi antibiotikum-terápiával társítva, amoxicillin/klavulánsav (4 g/nap) és gentamicin (160 mg/nap) alkalmazásával 2 napig.
Az A. veronii biovariás sobriát a beteg vérkultúrájában és helyi bakteriológiai mintákban azonosították. Az antibiotikumok rezisztenciát mutattak az amoxicillin/klavulánsavval szemben, amelyet a 10. napon leállítottak, és 10 napig cefotaximmal (6 g/nap) helyettesítették, majd nyolc napig orális ofloxacin (400 mg/nap). A láz a műtétet követő tizenegyedik napon szűnt meg négy napos antibiotikum-kezelés után. A 20. napon hagyta el a kórházat.
Két betegünk számára a mintát véragarra, Drigalski-agarra és agy-szív infúzióra helyeztük. Az izolátumot egy Vitek 2 gram-negatív kártya (bioMérieux Inc., Marcy L’étoile, Franciaország) segítségével azonosítottuk. Az antimikrobiális érzékenységet 24 órás korong-diffúziós módszerrel teszteltük Mueller-Hinton agar lemezeken, amelyeket 37 ° C-on inkubáltunk környezeti levegő inkubátorban.
Vita
A fertőzés legtöbbször az első 10 napban kezdődik, de egyes esetekben a fertőzés néhány héttel megjelenhet a pióca után [16]. Két esetünkben a pióca és a szeptikémia kezdete közötti késés 4 és 7 nap között mozog. A Lineaweaver [12] sorozatában 18 beteg fertőzött pióca után, ez a késés 1 naptól 10 napig terjed. Sartor sorozatában [14] hét beteg fertőzött meg pióca után, ez a késés 2 naptól 11 napig terjed.
A piócákból számos csírát azonosítottak [17]. A H. medicis nyálát, amely Európában és Észak-Amerikában a leggyakrabban alkalmazott gyógyhatású pióca, Mackay et al. és megmutatták az A. hydrophila és az Aeromonas sobria jelenlétét [18]. A leggyakoribb csíra az A. hydrophila, de más kórokozók, amelyek a pióca után sebfertőzést okoznak, az A. sobria [19], és a Serratia marcescensről [20] és a Vibrio fluvialisról [21] különálló jelentések találhatók. Az A. veronii biovariás sobriát vérkultúrákban, valamint két páciensünk helyi bakteriológiai mintájában találtuk.
Az Aeromonas β-laktamázt termel, amely ellenállást vált ki a penicillinnel és az első generációs cefalosporinokkal szemben [22]. Ezt a rezisztenciát két betegünk antibiotikuma is igazolja (1. táblázat). A második betegnek felírt amoxicillin/klavulánsav alkalmazásával végzett antibiotikum-terápia nem volt hatékony. Mégis, amint azt Hermansdorfer [23] említette, a harmadik generációs cefalosporinok, a ciprofloxacin és az aminosidok hatékonyak az Aeromonason. Két betegünk nem kapott ugyanazokat az antibiotikumokat, mert ugyanazon terület két különböző kórházában kezelték őket. Az első beteg esetében az antibiotikum-terápia gyorsan hatékony volt, míg a második esetében az antibiotikum-terápia csak akkor vált aktívvá, hogy a cefotaximot összekapcsolta az aminosidokkal. Két betegünk tünetei 4 napos antibiotikum után eltűntek.
Asztal 1
| Amoxicillin | R | R |
| Amoxicillin/klavulánsav | R | R |
| Piperacillin | S | S |
| Tazocillin | S | S |
| Cefalotin | R | S |
| Cefotetan | S | |
| Cefotaxim | S | S |
| Ceftazidim | S | S |
| Cefepim | S | |
| Imipenem | S | S |
| Aztreonam | S | S |
| Gentamicin | S | S |
| Tobramicin | S | S |
| Amikacin | S | S |
| Izepamicin | S | |
| Ofloxacin | S | S |
| Ciprofloxacin | S | S |
| Trimetoprim/szulfametoxazol | S | S |
R: Ellenálló, S: Érzékeny.
A kialakult fertőzést antibiotikumokkal, például harmadik generációs cefalosporinokkal, aminoglikozidokkal, fluorokinolonokkal, tetraciklinnel vagy trimetoprimmal/szulfametoxazollal kezelik [29].
Ami két betegünket illeti, Hermansdorfer és Braga tanulmányai azt mutatják, hogy az Aeromonas érzékeny a fluorokinolonra, különösen az ofloxacinra és a ciprofloxacinra [23,30]. A ciprofloxacin a legelőnyösebb megelőző antibiotikum a piócaterápiában, mert a vizsgálatok következetesen kimutatták a gyógyszeres piócákból izolált Aeromonas törzsek 100% -os érzékenységét. Tehát az ofloxacinnal 400 mg/nap vagy 1 g/nap ciprofloxacinnal adott antibiotikumok hatékonyan csökkentik a fertőzés arányát a kezelés teljes időtartama alatt. A szöveti penetráció jó, és a mellékhatások korlátozottak. Az Ofloxacin kiváló orális biohasznosulással rendelkezik (közel 95%), és alacsonyabb költségekkel rendelkezik, figyelembe véve a piócák viszonylag kevés esetét [31].
2011-ben Wang et al. piócaterápiával társított ciprofloxacin- és trimetoprim/szulfametoxazol-rezisztens Aeromonas fertőzésről írtak le [32]. Az ipari halgazdaságokban az Aeromonas törzsek antibiotikum-rezisztencia profilját vizsgáló vizsgálatok azt találták, hogy a ciprofloxacin és a trimetoprim/szulfametoxazol iránti rezisztencia 3% -nak, illetve 1% -nak felel meg [33,34]. Jelenleg a ciprofloxacin és a trimetoprim/szulfametoxazol rezisztencia az Aeromonas-ban ritka. A helyi rezisztencia-minták megfelelő antibiotikum-profilaxisának meghatározása érdekében a sebészeknek és a fertőző betegségek szakembereinek együtt kell működniük. Óvatosan ellenőrizni kell a fluorokinolon-rezisztencia növekedését.
Következtetés
A piócás fertőzés mértéke nem elhanyagolható. A szakirodalom szerint 2,4% és 20,0% között változik [11,12]. Az Aeromonas koncentrációja a piócák emésztőrendszerében nagymértékben csökken, ha a páciens antibiotikum terápiában részesül. Ezek a csírák érzékenyek a harmadik generációs cefalosporinokra és fluorokinolonokra, például az ofloxacinra. Javasoljuk az aszepszis klasszikus mértékein alapuló megelőző kezelést és fluorokinolonokkal, például ofloxacinnal, szájon át alkalmazott antibiotikumok kezelésével, napi kétszer 200 mg-ot a piócákkal végzett kezelés teljes időtartama alatt.
Beleegyezés
A két betegetől írásos tájékoztatáson alapuló beleegyezést szereztek ezen esetjelentések és a kísérő képek közzétételéhez. Az írásbeli hozzájárulás egy példányát megtekintheti a folyóirat főszerkesztője.
Versenyző érdekek
A szerzők kijelentik, hogy nincsenek versengő érdekeik.
A szerzők hozzájárulása
A BM és az RA részt vett a betegek kezelésében és megírta a kéziratot. A CBR áttekintette az irodalmat is. A CBR az első beteget, a második a JBA-t operálta. Minden szerző elolvasta és jóváhagyta a végleges kéziratot.
- A hasnyálmirigy traumájának laparoszkópos kezelése gyermekeknél 2 esetjelentés
- A máj hidrodinamikai megrepedése a harcban szenvedő betegeknél a „károsodás” sikeres alkalmazása
- A dacryocystitis leplezése Oxford Medical Case Reports Oxford Academic
- Nagyszerű választás Nyizsnyiben a klasszikus orosz ételekhez - Pjatkin áttekintése, Nyizsnyij Novgorod, Oroszország -
- Japán A vegán világrajongók esete