Közötti társulás SAH, egy Acyl-CoA szintetáz gén, valamint a hipertrigliceridémia, az elhízás és a magas vérnyomás
A Nemzeti Kardiovaszkuláris Központtól (N.I., T.M., K.K., J.O., S.B.) és az Oszakai Orvostudományi Kar Geriátriai Orvostani Tanszékétől (T.K., J.H., T.O.), Suita, Oszaka, Japán.
A Nemzeti Kardiovaszkuláris Központtól (N.I., T.M., K.K., J.O., S.B.) és az Oszakai Orvostudományi Kar Geriátriai Orvostani Tanszékétől (T.K., J.H., T.O.), Suita, Oszaka, Japán.
A Nemzeti Kardiovaszkuláris Központtól (N.I., T.M., K.K., J.O., S.B.) és az Oszakai Orvostudományi Kar Geriátriai Orvostani Tanszékétől (T.K., J.H., T.O.), Suita, Oszaka, Japán.
A Nemzeti Kardiovaszkuláris Központtól (N.I., T.M., K.K., J.O., S.B.) és az Oszakai Orvostudományi Kar Geriátriai Orvostani Tanszékétől (T.K., J.H., T.O.), Suita, Oszaka, Japán.
A Nemzeti Kardiovaszkuláris Központtól (N.I., T.M., K.K., J.O., S.B.) és az Oszakai Orvostudományi Kar Geriátriai Orvostani Tanszékétől (T.K., J.H., T.O.), Suita, Oszaka, Japán.
A Nemzeti Kardiovaszkuláris Központtól (N.I., T.M., K.K., J.O., S.B.) és az Oszakai Orvostudományi Kar Geriátriai Orvostani Tanszékétől (T.K., J.H., T.O.), Suita, Oszaka, Japán.
A Nemzeti Kardiovaszkuláris Központtól (N.I., T.M., K.K., J.O., S.B.) és az Oszakai Orvostudományi Kar Geriátriai Orvostani Tanszékétől (T.K., J.H., T.O.), Suita, Oszaka, Japán.
A Nemzeti Kardiovaszkuláris Központtól (N.I., T.M., K.K., J.O., S.B.) és az Oszakai Orvostudományi Kar Geriátriai Orvostani Tanszékétől (T.K., J.H., T.O.), Suita, Oszaka, Japán.
Absztrakt
Háttér- Az SA gén (SAH) differenciálszűréssel izolálták genetikailag magas vérnyomású patkány törzsből mint jelölt génből, amely hozzájárulhat a magas vérnyomás kialakulásához. Nemrégiben arról számoltak be, hogy az SA fehérje erősen homológ a szarvasmarha-xenobiotikummal metabolizáló közepes láncú zsírsavval: CoA ligázzal.
Módszerek és eredmények- A patofiziológiai jelentőség tisztázása SAH, emberi polimorfizmusokat kerestünk SAH és asszociációs vizsgálatokat végzett egy nagy kohorsz (4000 alany) felhasználásával, amely a japán lakosságot képviselte. 2 promóter régióban és egy nukleotid polimorfizmusokat találtunk az 5., 7. és 12. intronban és a 8. exonban. Az egyik variáns, az A/G polimorfizmus a 12. intronban, csak 7 bp-rel a 13. exontól felfelé, erősen befolyásolta a plazmát triglicerid, plazma koleszterin, testtömeg-index (BMI), derék-csípő arány (W/H) és vérnyomás állapota. Úgy tűnik, hogy ennek a genotípusnak a vérnyomásra gyakorolt hatása a BMI-re és a W/H-ra gyakorolt hatása révén közvetíthető. Az SA fehérje átmeneti expressziója emlős sejtekben megerősítette, hogy mitokondriumban expresszálódik és közepes láncú zsírsav: CoA ligáz aktivitással rendelkezik. Megállapították, hogy az A/G polimorfizmus összefüggésbe hozható az SA mRNS expressziós szintjével perifériás mononukleáris sejtekben in vivo.
Következtetések- A G allélja SAH kiderült, hogy több kockázati tényezővel van összefüggésben, beleértve a hipertrigliceridémiát, a hiperkoleszterinémiát, az elhízást és a magas vérnyomást. Ennek a megfigyelésnek új teret kell nyitnia a jövőbeni kutatások számára a multi-risk-factor szindrómákban.
Úgy gondolják, hogy a genetikai és környezeti tényezők közötti kölcsönhatások fontos szerepet játszanak a gyakori betegségek patogenezisében. Az asszociációs vizsgálatok használata nagy epidemiológiai kohorszokban, nagyszámú egy nukleotid polimorfizmus mellett egyetlen génben vagy az egész genomban új stratégia a gyakori betegségekhez hozzájáruló gének azonosítására. 1–3 Jelen tanulmányban ezt a stratégiát alkalmaztuk az SA génre (SAH) annak megvizsgálására, hogy befolyásolja-e a vérnyomást.
SAH genetikailag magas vérnyomású patkánytörzsből, a spontán magas vérnyomású patkányból, differenciálszűréssel izoláltuk. 4 A kifejezése SAH a spontán hipertóniás patkány veséiben szignifikánsan magasabb, mint a normotenzív kontroll törzs veséiben, a Wistar-Kyoto patkány. SAH főleg proximális tubulusokban és hepatocitákban fejeződik ki. 5 A közelmúltban az SA fehérje jelentősen homológ a marha xenobiotikummal metabolizáló közepes láncú zsírsavval (MCFA): CoA ligázzal. 6 Számos F2 patkány 7, 8 kohorsz elemzése és számos kongenikus patkány 9, 10 törzs létrehozása megerősítette, hogy az SA gén lokusz hozzájárul a vérnyomás szabályozásához patkányban. Így, SAH az emberi esszenciális hipertónia jelölt génje.
Számos kisszabású társulási tanulmány azonban ellentmondásos eredményeket hozott a tekintetben SAH hozzájárul az emberek magas vérnyomásához. 11,12 A kérdés tisztázása érdekében alaposan megkerestük az emberi polimorfizmusokat SAH és asszociációs vizsgálatokat végzett egy nagy kohorsz (4000 alany) felhasználásával, amely a japán lakosságot képviselte.
Mód
Tárgyak
A Suita tanulmány kiválasztási kritériumait és kialakítását korábban leírták. 13 A genotípus SAH 4039 alanyban állapították meg (írásos tájékozott beleegyezést kaptak).
A jelen vizsgálatban elemzett alanyok jellemzőit az 1. táblázat foglalja össze az intron A/G genotípusának megfelelően. A magas vérnyomást szisztolés vérnyomásként ≥140 mm Hg, diasztolés vérnyomásként ≥90 mm Hg vagy a jelenlegi felhasználásként határozták meg. vérnyomáscsökkentő gyógyszerek. A teljes koleszterin- és trigliceridszintet enzimatikus módszerekkel határoztuk meg kitek segítségével (L-TC Wako, Wako Pure Chemical és Clinimate TG-2, Daiichi Chemicals).
1101780 táblázat. A vizsgálati populáció jellemzői (összesen)
DNS-vizsgálatok
32 szubjektum genomi DNS-ét alkalmaztuk templátként a szekvenciaelemzésekhez. A promóter régiót (-2,1 kb-ig), az 1–14 exont és a szomszédos régióikat szekvenáltuk. A primer szekvenciákat kérésre biztosítjuk. A polimorfizmusokat a TaqMan rendszer (PE Applied Biosystems) alkalmazásával határoztuk meg (2. táblázat).
2101780 táblázat. Genotipizáláshoz használt alapozók és szondák
A. Expressziós szintjének értékelése SAH mRNS
A kifejezési szint SAH Az mRNS-t kompetitív reverz transzkripció – polimeráz láncreakció (RT-PCR) módszerrel értékeltük. Szintetizáltuk azt a cRNS-t, amelyből hiányzik az 1064 és 1074 nukleotid közötti régió (GenBank csatlakozás D16350). Az RNS-t a 14. leírás szerint extraháltuk perifériás mononukleáris sejtekből, amelyeket Ficoll-sűrűség-gradienssel tisztítottunk. A perifériás mononukleáris sejteket egészséges orvosoktól szereztük be, akik megértették a vizsgálat jelentőségét (írásos tájékozott beleegyezést kaptak). A delécióval mutált cRNS-sel kombinált teljes RNS-t (1 μg) reverz transzkripcióval írtuk le, és a kapott cDNS-keveréket primerekkel amplifikáltuk, lefedve a 968 és 1111 nukleotidok közötti régiót. A natív mRNS-ből származó PCR termék hossza 144 bp volt, hogy a delécióval mutált cRNS-ből 133 bp volt. Az mRNS expressziós szintjét a 144 bp-os PCR-fragmens és a 133 bp-os fragmens arányaként adjuk meg.
Kifejezési tanulmány
A kifejezési konstrukció az ember számára SAH az Invitrogen-től (GeneStorm expresszióra kész humán klónok) vásároltuk. Az SA cDNS-t egy citomegalovírus (CMV) promóter szabályozása alatt fejezik ki. A COS1 sejteket átmenetileg transzfektáltuk ezzel az expressziós vektorral LipofectAmine Plus reagenssel (Gibco-BRL). A transzfektált sejteket proteázgátló koktélt (Sigma) tartalmazó A pufferben (50 mmol/l Tris-HCl [pH 8,0], 1 mmol/l EDTA, 1 mmol/l ditiotreitol és 10% glicerin) szuszpendáltuk, és szonikálással megszakítottuk. . A kapott felülúszót használtuk az acil-CoA szintetáz enzimatikus vizsgálatához. Az oktánsav és a palmitoesav acil-CoA szintetáz aktivitását Vessey és Hu módszerével vizsgáltuk. 15
Az SA fehérje, az embert kódoló cDNS sejt lokalizációjának meghatározásához SAH a C-terminális Myc-taggal pCI emlős expressziós vektorba (Promega) szubklónoztuk és HeLa-sejtekben expresszáltuk. Az SA fehérje és a mitokondrium egyidejű kimutatásához a sejteket anti-Myc-tag nyúl poliklonális antitesttel (MBL) és anti-humán mitokondrium egér monoklonális antitesttel (Chemicon) inkubáltuk. A sejteket ezután kétszer festettük Alexa Fluor 488-jelölt anti-nyúl IgG-vel és Alexa Fluor 568-jelölt anti-egér IgG-vel (Molecular Probes).
Az A/G polimorfizmus jelentőségének feltárásához a 12. intronban egy minigént készítettünk, amely a 11. és 14. exon közötti régiót (3′-nem transzlált régió) tartalmazta a CMV promoter (pcDNS 3.1 mint vektor) irányítása alatt. A helyesen bekötött érett transzkriptumot (M transzkriptum) 204 bp-os PCR-termékként detektáltuk a 12. és 14. exon primerek alkalmazásával. A szelektálatlan transzkriptumot 229 bp-os PCR-termékként detektáltuk intron 12 és exon 13/14 primerekkel. Az M transzkriptum és a nem szelektált RNS arányát a 209 bp és a 229 bp PCR termék arányaként fejeztük ki. Az A és G allélok M transzkriptumának expressziós szintjének felmérésére a pRL-CMV vektor (Promega), amelyben Renilla a luciferáz a CMV promoter alatt van, belső standardként bekerült a transzfekciós keverékbe. Az M transzkriptum expressziós szintjét az M transzkriptumból (204 bp) és a luciferázból (283 bp) származó PCR termék arányával értékeltük.
A promóter régióban az inszerció/deléció polimorfizmus szabályozó hatásainak feltárására elkészítettük SAH promoter/luciferáz fúziós gének. A polimorfizmusok egy inszerció/deléció (I és D allél) voltak -1037 és egy G (119952). A polimorfizmus -407-nél. A transzkripció iniciációs helyét az 5′-RACE határozta meg, és a fő helyet +1 számmal jelöltük. A meghatározott haplotípusok D/G, D/A, I/A és I/G voltak. A -2052 és +253 közötti promoter régiót szubklónoztuk pGL2-Basic (Promega) -ba, amely nem tartalmaz semmilyen promóter-szekvenciát. A transzfektálást MDCK sejtekben végeztük, belső standardként PRL-CMV vektor (Promega). Photinus és Renilla a luciferáz aktivitásokat kit segítségével mértük (PG-DUAL-SP, Toyo Ink, Co).
Kérésre részletesebb leírást adunk az anyagokról és módszerekről, beleértve az primer szekvenciákat is.
Statisztikai elemzések
Az értékeket átlag ± SEM vagy átlag ± SD értékkel fejezzük ki. Az összes statisztikai elemzést a JMP és a StatView statisztikai csomagokkal (SAS Institute Inc.) végeztük. Több lineáris regressziót és több logisztikai elemzést végeztek más kovariánsokkal (nem és életkor). A vérnyomásértékek, a derék-csípő arány (W/H), a triglicerid és a koleszterin maradványait nem és életkor szerinti kiigazítással számoltuk. A csoportok közötti numerikus adatok különbségeit egyutas/kétutas ANOVA-val és párosítatlanokkal elemeztük t teszt. A frekvenciák közötti különbségeket és a kötési egyensúlyhiány mértékét kontingencia táblázat elemzéssel teszteltük.
Eredmények
SAH polimorfizmusok
Polimorfizmusok találhatók SAH Az 5. és a 7. intron genotípusai teljes összekapcsolódási egyensúlyhiányban voltak a 8. exon polimorfizmusával a 96 elemzett alanyban. Ezért ezt a 2 polimorfizmust nem tesztelték. Az I/D és az intron 12 polimorfizmus páros kapcsolati egyensúlyhiányát a 4. táblázat mutatja.
3101780 táblázat. A polimorfizmusok SA Gén
4101780 táblázat. Kapcsolódási egyensúlyhiány az I/D és az Intron 12 polimorfizmusai között
Egyesületi tanulmány
Meghatároztuk az I/D promoter, a G/A promóter, a 8 G/C exon és a 12 intron A/G polimorfizmusok genotípusait a teljes vizsgálati populációban. Az 1. táblázat bemutatja a vizsgált populáció jellemzőit az intron 12 polimorfizmusa szerint. Mivel csak 4 GG genotípus létezett, a GG és az AG genotípusokat egy csoportba egyesítették.
Az intron 12 polimorfizmusa jelentősen befolyásolta a testtömeg-indexet (BMI), W/H, az antihipertenzív kezelés százalékos arányát, a szisztolés és diasztolés vérnyomást, a pulzusszámot, az éhomi vércukorszintet és a trigliceridet (1. táblázat). Az életkor és nem szerinti kiigazítás után az intron 12 polimorfizmusa jelentősen befolyásolta a BMI-t, a W/H-t, a trigliceridet, valamint a szisztolés és diasztolés vérnyomást (1. táblázat). A promóterben található D allél befolyásolta a triglicerid szintet. A többszörös regressziós elemzés azt mutatta, hogy a triglicerid szintet életkor szerint határozták meg (P
Az SA fehérje funkciója
Beszámoltak arról, hogy az SA fehérje erősen homológ egy szarvasmarha-xenobiotikummal metabolizáló MCFA: CoA ligázzal. 6 db COS1 sejt transzfektált pcDNA3.1/GS-humán SA szignifikánsan magasabb acil-CoA-szintetáz aktivitással rendelkezik az oktánsavval szemben, mint a pcDNA3.1/GS-sel transzfektáltaké, ami megerősítette, hogy a humán SA fehérje MCFA: CoA ligáz aktivitással rendelkezik (1. ábra). 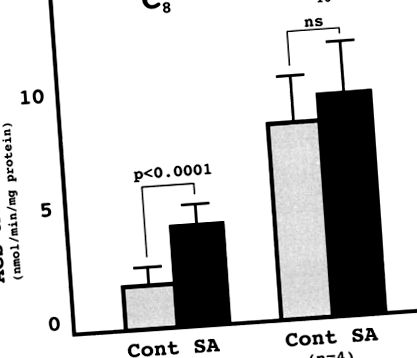
1.ábra. A transzfektált Cos sejtek acil-CoA szintetáz (ACS) aktivitása. A COS1 sejteket pcDNS/GS-SA (SA) vagy pcDNA/GS (folytatás) módszerrel transzfektáltuk. Értékelték az oktánsav (C8) és a palmitoesav (C16) ACS-aktivitását. Mindegyik érték 4 független transzfekciós kísérlet átlagát jelenti (átlag ± SD).
Az anti-mitokondrium antitest spagetti-szerű festődést mutatott a HeLa sejtekben. Az anti-Myc-tag antitest hasonló mintázatot mutatott a transzfektált sejtekben. Arra a következtetésre jutottunk, hogy az emberi SA fehérje összefügg a mitokondriumokkal (az adatokat nem közöljük).
Az intron 12 A/G és a promóter I/D polimorfizmusok funkcionális jelentősége
Az SA mRNS expressziós szintjét az intron 12 A/G genotípusa és a promoter I/D polimorfizmusai alapján értékeltük (2. ábra). Az SA mRNS expressziós szintje mononukleáris sejtekben AG genotípussal (a promóterben az összes DD genotípus) (n = 4) szenvedő betegeknél (n = 4) ~ 4-szer magasabb volt, mint az AA genotípussal (1 II, 4 ID és 3 DD genotípusok a promóterben) (n = 8) (P= 0,0002). Úgy tűnik, hogy az I/D polimorfizmusnak nincs jelentős hatása az SA mRNS szintjére (az adatokat nem mutatjuk be).
2. ábra. Az SA mRNS expressziós szintje A/G polimorfizmus szerint. Az expresszió szintjét kompetitív RT-PCR-rel mértük perifériás mononukleáris sejtekben. Kezdeti, reprezentatív, kompetitív RT-PCR, az SA mRNS (144 bp) és a delécióval mutált cRNS (133 bp) sávokkal. Az expressziós szinteket három delécióval mutált cRNS szinttel értékeltük (1,0 × 105, 4,0 × 105 és 1,6 × 106 molekula/μg teljes RNS; balról jobbra). Átlagos ± SD adat, amelyet 8 AA genotípusú és 4 AG genotípusú alanyból nyertünk.
A fenti megfigyelés azt sugallta, hogy az intron 12 A/G polimorfizmusa befolyásolhatja az SA mRNS expressziós szintjét. Mivel az A/G polimorfizmus az intron polipirimidin traktusában található, és azt javasoljuk, hogy ez a traktus befolyásolja a splicinget, 16 megvizsgáltuk ennek a polimorfizmusnak a splicing hatékonyságra gyakorolt hatásait, amelyek ezután befolyásolhatják az mRNS expresszió szintjét.
Egy minigént készítettünk, amely a 11–14 exont tartalmazta a CMV promoter irányítása alatt. A helyesen illesztett M transzkriptum expressziós szintje a kontroll RNS szintjéhez képest (Renilla luciferáz RNS) szignifikánsan magasabb volt a G allélben, mint az A allélben (3. ábra). Az M transzkriptum és a nem szelektált transzkriptum aránya magasabb volt a G allélben, mint az A allélben (3A. Ábra). Ez a kísérlet azt jelzi, hogy ez az egyetlen nukleotid változás jelentősen befolyásolta az expresszió szintjét azáltal, hogy befolyásolta az intron splicingjét ezekben a kísérleti körülmények között. Nemrégiben beszámoltak arról, hogy egy intronikus szekvencia variáció befolyásolja az mRNS expresszió szintjét WNK1, amely pszeudohipoaldoszteronizmust okoz II. 17.
Az I/D polimorfizmus funkcionális jelentősége SAH MDCK sejtekkel végzett tranziens transzfekciós vizsgálattal értékelték. A kétirányú ANOVA azt mutatta, hogy az I/D polimorfizmus, de nem a G (119952) A polimorfizmus, jelentősen befolyásolta a promoter aktivitását. A D allél promóter aktivitása körülbelül kétszerese volt az MDCK sejtekben lévő I allélének. Bár ez az I/D polimorfizmus nem befolyásolta az mRNS szintjét a perifériás mononukleáris sejtekben (lásd fent), ennek a polimorfizmusnak funkcionális jelentősége lehet más releváns szövetekben, például vese-, máj- és zsírszövetekben.
Vita
Az MCFA-k bőségesen tartalmaznak tejet, kókuszolajat és különféle félszintetikus olajokat. 20,21 Az MCFA aktiválása leginkább a mitokondriális mátrixban történik az MCFA acil-CoA szintetázai révén, és a hepatocitákba beépített MCFA nagy része β-oxidációnak van kitéve. 20,21 Az MCFA oxidációja során keletkező acetil-CoA egy része a keton testtermelésre irányul, a többi pedig a hosszú szénláncú zsírsavak (LCFA) de novo szintézisére irányul, amelyeket aztán trigliceridbe vagy más komplex lipidekbe építenek be. 20,21
Az SA géncsaládban ≥5 gén van. 22 Kettő (KS1 és KS2) nagyon homológak a teljes SA-fehérjével (4. ábra). KS1 ~ 210 kb-ra lokalizálódik az áramlási irány előtt SAH. Ezek az acil-CoA-szintetázok funkcionálisan kapcsolódhatnak specifikus metabolikus utakhoz, amint azt a máj LCFA-acil-CoA-szintetázaiban megfigyelték. 23 Az SA fehérje magasabb expressziója az LCFA magasabb de novo szintéziséhez vezethet az MCFA-ból, mivel a G allél magasabb plazma triglicerid szinttel társult. Az MCFA preferenciális trigliceridhez történő lerakódása hosszú távon a perifériás triglicerid (zsigeri elhízás) nagyobb felhalmozódásához vezethet. Az A/G polimorfizmus és a plazma triglicerid összefüggése egyértelműbb volt az alanyokban
4. ábra. Aminosav szekvencia homológia feltételezett SA géncsalád között. A szekvenciákat a GenBanktól szereztük be. SAH és KS1 NT010441-ből származnak. KS2 az AK00588-ból származik. Sőt, további 2 olyan fehérjéről számoltak be, amely nagyon homológ az SA fehérje második felével (AC003034). Az 1. motívum az acil-CoA szintetázok feltételezett AMP-kötő doménjét jelzi; a 2. motívum az acil-CoA szintetázok feltételezett doménjét jelzi a közepes láncú zsírsavakra.
- A hasi elhízás és annak összefüggései az egészséggel kapcsolatos életminőséggel felnőtteknél a
- A CART-t kódoló gén polimorfizmusa a pima indiánoknál nem társul az elhízással
- A születés, a szoptatás és az elhízás összefüggése 22 országban A WHO
- A császármetszés és az elhízás közötti összefüggés gyermekkorban, longitudinális kohorsz vizsgálat
- Az alkoholos kalóriabevitel, valamint a túlsúly és az elhízás közötti kapcsolat angol felnőtteknél