A táplálékkombináció hatékonysága a lipid metabolizmuson metabolikus szindrómás betegeknél: multicentrikus, kettős vak, randomizált, placebo-kontrollos vizsgálat
Absztrakt
Háttér
A tápanyagok új terápiás határt jelentenek a metabolikus szindróma (MetS) és a kapcsolódó kardiovaszkuláris kockázati tényezők kezelésében. Ennek a vizsgálatnak az volt a célja, hogy értékelje az Armolipid Plus (AP) (500 mg berberin, vörös rizs rizs, 3 mg monakolin K és 10 mg policozanol) potenciális jótékony hatását az inzulinrezisztenciára, a lipidprofilra, különösen a kicsi és sűrű LDL-koleszterinre. (sdLDL-C), amely a leginkább atherogén komponenseket képviseli, valamint a magas érzékenységű C-reaktív fehérjére gyakorolt hatása, amely a metS által érintett egyének kardiovaszkuláris kockázatának, vérnyomásának és szívműködésének átalakulásának jelentős markere, bal kamrai hipertrófiával.
Mód
A vizsgálat egy prospektív, több központú, randomizált, kettős vak, placebo-kontrollos vizsgálat volt. Százötvennyolc, 28 és 76 év közötti beteget vontak be és randomizáltak, hogy 24 héten keresztül naponta egyszer egy AP vagy placebo (PL) tablettát kapjanak. Antropometriai és létfontosságú paraméterek, teljes koleszterin (tot-C), alacsony sűrűségű lipoprotein-koleszterin (LDL-C), nagy sűrűségű lipoprotein-koleszterin (HDL-C), trigliceridémia (TG), nem HDL-koleszterin (NHDL-C) és sdLDL -C értékeltük.
Eredmények
24 hetes kezelés után a 141 alanyon (71 AP-karon és 70 PL-karon) végzett elemzés a lipidprofil szignifikáns javulását mutatta az AP-csoportban, a tot-C csökkenésével (- 13,2 mg/dl), Az LDL-C (- 13,9 mg/dl) és az NHDL-C (- 15,3 mg/dl) és a HDL-C növekedése (+ 2,0 mg/dl). Ezek a változások ugyanolyan szignifikánsak voltak a placebóval összehasonlítva (tot-C: AP - 13,2 mg/dl vs PL + 2,7 mg/dl, o
Bevezetés
A metabolikus szindróma (MetS) a nyugati világban gyakori klinikai állapot, amely a szív- és érrendszeri betegségek (CVD) fokozott kockázatával jár együtt [1, 2].
Ezt az állapotot zsigeri elhízás, magas vérnyomásértékek és inzulinrezisztencia (IR) jellemzi, ami elősegíti az aterogén lipidprofilt, emelkedett trigliceridekkel (TG), magas alacsony sűrűségű lipoprotein koleszterinnel (VLDL-C) és csökkent magas sűrűségű lipoprotein koleszterinnel. (HDL-C), ami a nem HDL-koleszterin (NHDL-C) növekedését jelenti.
Az inzulinrezisztencia olyan állapot, amelyben az inzulin fiziológiás mennyisége az éjszakai időszakban nem megfelelő inzulinszuppresszióval csökkenti az étkezés utáni glikémiás kontrollt. Kezdetben ellensúlyozza az inzulin felszabadulásának növelése a normális glükóz szérumérték fenntartása érdekében. Idővel ez a kompenzációs mechanizmus általában nem megfelelő, ezért a betegek étkezés utáni, majd éhomi hiperglikémiát alakítanak ki. Csökkenti a glükózfelvételt, csökkentve az izom glikogénkészleteit, elősegíti a máj glükoneogenezisét és növeli a szimpatikus tónust. Kimutatták, hogy a hiperinzulinémia nem cukorbetegeknél a kardiovaszkuláris események megnövekedett gyakoriságával jár, a metabolikus lipidprofiltól függetlenül [1, 2].
Köztudott, hogy a hiperkoleszterinémia a CVD független rizikófaktora, és különösen a normál felső határértéket meghaladó alacsony sűrűségű lipoprotein-koleszterin (LDL-C) szintek fokozott kardiovaszkuláris kockázatot okoztak. Elektroforézissel az LDL-C 7 szubfrakciója azonosítható a csökkenő mérethez és a növekvő sűrűséghez viszonyítva. A 3–7-es szubfrakciók, amelyeket általában kis sűrűségű LDL-C-ként (sdLDL-C) azonosítanak, bizonyítottan atherogénebbek, mint a nagyobb LDL-C részecskék, mivel azok hosszabb ideig fennmaradnak a keringésben, nagyobb az érzékenységük az oxidációra és a glikációra, valamint fokozott affinitás az artériás fal proteoglikánjaival szemben [3,4,5,6,7,8,9,10]. Megfigyelték, hogy az emelkedett sdLDL-C plazmakoncentráció általában korrelál a magas plazma TG és alacsony HDL-C szinttel, amelyek a MetS legfontosabb jellemzői. Sőt, úgy tűnik, hogy az sdLDL-C szint növekedése közvetlenül kapcsolódik a MetS komponenseinek számához, így jelképezheti a szindróma diagnózisát és súlyosságát [11,12,13,14,15,16]. Klinikai vizsgálatok kimutatták, hogy az emelkedett sdLDL-C plazmakoncentráció szignifikánsan összefügg a CVD megnövekedett kockázatával [17,18,19,20,21].
A Felnőtt Kezelő Panel III jelentése a MetS-t a terápia másodlagos célpontjaként azonosította a CVD kezelésében, az LDL-C szintet csökkentő terápia mellett [22,23,24,25].
A MetS széles fenotípusos heterogenitása és komplex patogenezise nehézzé teszi egyetlen terápiás cél azonosítását. A szindróma jelenlegi terápiás megközelítése stabil életmódbeli változásokon alapul, és gyakran komplex, több gyógyszeres kezelést igényel, a szindróma összetevőit egyedileg kezelve. Ez magas költségeket, gyenge megfelelést és kevés eredményt jelent, megnövekedett mellékhatások kockázatával.
A ma kapható hipolipidémiás gyógyszerek bizonyítottan hatékonyak az LDL-C és az sdLDL-C csökkentésében. Ennek ellenére bebizonyosodott, hogy releváns kölcsönhatásban vannak más általánosan használt gyógyszerekkel és nem elhanyagolható mellékhatások.
A diszlipidémia kezelésének nem farmakológiai lehetőségei jó alternatívát jelenthetnek, javítva a betegek megfelelőségét [26].
A legújabb tanulmányok bizonyítják a táplálékkombinációk hatékonyságát a lipid plazmaértékek csökkentésében, anélkül, hogy a CPK szint, a myalgia vagy a myopathia növekedne, ami jó jelöltet jelent a koleszterinszint-csökkentő terápiában olyan betegeknél, akik intoleránsak a szokásos kezelésekkel [27,28,29]. Sőt, ez a terápia biztonságosnak bizonyult a heterozigóta familiáris hiperkoleszterinémia által érintett gyermekeknél is [30].
Ennek a vizsgálatnak a célja egy táplálékkombináció hatásainak vizsgálata volt az inzulinrezisztenciára, a lipid anyagcserére és az LDL-C altípusokra MetS-ben és bal kamrai hipertrófiában szenvedő betegeknél. Az ebben a vizsgálatban alkalmazott táplálékkombináció egyetlen tablettából állt, amely berberint (500 mg BRB), vörös liszt rizst (RYR) (3 mg monakolin K) és 10 mg policozanolt (Armolipid Plus®, AP, Rottapharm Madaus, Olaszország) tartalmazott.
Anyagok és metódusok
Dizájnt tanulni
A vizsgálat egy prospektív, több központú, randomizált, kettős vak, placebo-kontrollos vizsgálat volt, amely szűrővizitust és 24 hetes kezelési időszakot tartalmazott. Három központban folytatták, köztük kettőben a Nápolyi „Federico II” Orvostudományi és Sebészeti Egyetemen és egyben a Terni Egyetemi Kórházban. Az egyes helyszínek intézményi etikai bizottsága minden kísérlethez kapcsolódó tevékenység megkezdése előtt jóváhagyta a vizsgálati protokollt (Università degli Studi di Napoli Federico II: 13/12 protokollszám az 1. központnál és 28/12 a 3. központ esetében; Aziende Sanitarie Umbria: protokollszám 2026/(12), és minden betegetől írásos tájékozott beleegyezést kaptak. A tanulmány a Helsinki Nyilatkozat elveinek megfelelően készült.
A betegek és a kezelés
A vizsgálat résztvevőit 2013. április és 2014. július között vették fel.
A jogosultsági kritériumok a következők voltak: (1) 18 és 70 év közötti életkor; (2) a MetS diagnózisa, amelyet úgy határoznak meg, hogy a derék kerülete ≥ 94 cm (férfi), ≥ 80 cm (nő), és amely az alábbiak közül legalább kettőhöz társul: szisztolés vérnyomás (SBP) ≥ 130 Hgmm vagy diasztolés vér nyomás (DBP) ≥ 85 Hgmm, vagy vérnyomáscsökkentő kezelésre van szükség; éhomi glükóz (FG) ≥ 100 mg/dl; HDL-C 48 g/m 2,7 (férfi) vagy> 44 g/m 2,7 (nő) és (4) képesség a klinikai kísérletek megértésére és megalapozott beleegyezésére.
A kizárási kritériumok a következők voltak: (1) bizonyított intolerancia a táplálékvegyület bármely összetevőjével szemben; (2) terhesség vagy szoptatás; (3) kezelés hipoglikémiás szerekkel és/vagy glikált hemoglobinnal (HbA1c) ≥ 6,5%; (4) mérsékelt vagy súlyos májműködési zavar (gyermek B-C); (5) rendellenes vesefunkció (eGFR 2); (6) szérum trigliceridek> 500 mg/dl; (7) súlyos elhízás (testtömeg-index (BMI)> 35 kg/m 2); (8) a szívelégtelenség kórtörténete vagy jelenlegi tünetei; (9) bal kamrai szisztolés diszfunkció (bal kamrai ejekciós frakció (LVEF) ≤ 40%); (10) hipertrófiás kardiomiopátia; (11) szívbillentyű szűkület; (12) korábbi szívinfarktus; (13) pacemaker által kiváltott kamrai ritmus; (14) mérsékelt vagy súlyos szívbillentyű-regurgitáció; (15) kontrollálatlan magas vérnyomás az optimális terápia ellenére (PAS> 140 Hgmm o PAD> 90 Hgmm). Egyidejű betegségben szenvedő betegeket vontak be, feltéve, hogy klinikai körülményeik és kezeléseik az elmúlt három hónapban stabilak voltak, és nem voltak jelentős klinikai eseményeik.
A vizsgálatba százötvennyolc beteget vontak be, akik megfelelnek az alkalmassági kritériumoknak. A betegeket randomizálták, hogy vagy egy tablettát kapjanak az Armolipid Plus-ból.
(MEDA-Rottapharm SpA; 1 tabletta/nap, 200 mg RYR-t tartalmaz (egyenértékű 3 mg monakolin K-val), 500 mg berberint, 10 mg policozanolt, 0,2 mg folsavat, 2,0 mg Q10 koenzimet és 0,5 mg asztaxantinból; az Armolipid Plus-ban található RYR citrinin és aflatoxin mentes volt) vagy placebo (napi 1 tabletta, íze és megjelenése megegyezik az Armolipid Plus tablettával, de mikrokristályos cellulózt, barna vas-oxidot 70, Compritol E ATO-t tartalmaz [Gattefoss_e Saint-Priest, Lyon, Franciaország] és magnézium-sztearát. A randomizálást és a vakítást a Rottapharm Madaus SpA (Monza, Olaszország) végezte, amely szintén finanszírozta a tanulmányt. A randomizálást 1: 1 arányban hajtottuk végre, egy számítógéppel generált randomizálási lista szerint, amely tartalmazza a randomizációs kódokat, amelyeket fokozatosan a betegekhez rendelhet, és amelyeket a kezelés kiadására használnak. A vizsgálati személyzet és a vizsgálók, valamint az összes beteg elvakult a csoportos megbízástól. A randomizációs kódokat zárt borítékban tartották, amelyet csak a vizsgálat befejezéséig és az adatok elemzéséig nyitottak meg. A placebo csoportban 44 beteget kezeltek sztatinokkal. Hasonlóképpen az AP csoportban 44 beteget kezeltek sztatinokkal.
Eredmények
Az elsődleges végpontok az AP metabolikus hatásainak megerősítése voltak az inzulinrezisztenciára (IR) MetS-ben és a bal kamrai hipertrófiában szenvedő betegeknél, valamint a kezelés lipidprofilra gyakorolt hatásainak értékelése, különös tekintettel a kicsi és sűrű LDL-koleszterinre (sdLDL-C). a leginkább atherogén komponensek. A másodlagos végpontok a szív átalakulására, a vérnyomásra és a C-reaktív protein H-ekre (CRP-H) gyakorolt hatásai voltak, amelyek a kardiovaszkuláris kockázat figyelemre méltó markerei. Ez a cikk csak a klinikai vizsgálat metabolikus részével foglalkozik.
Klinikai és sztrumentális mérések
Nyugalmi állapotban 12 vezetéses EKG-t rögzítettek, és elvégezte a bazális echokardiográfiát. Az echokardiográfiai vizsgálatok összes felvételét vakon értékelte a koordináló központ egyetlen kezelője. Az LVM értékelését az American Society of Echocardiography ajánlásai szerint végezték [31]. A betegeket randomizálták, hogy megkapják a kezelést. 4 hét múlva a kezelés során telefonhívást terveztek a kezelés betartásának ellenőrzése érdekében, rögzítve az egyidejűleg alkalmazott gyógyszerek változását és a nemkívánatos eseményeket. 12 hét után. a betegek új klinikai látogatáson és vérvizsgálaton estek át a biztonsági paraméterek monitorozása céljából. Az egyidejűleg alkalmazott gyógyszereket és a nemkívánatos eseményeket a vizsgálat során folyamatosan figyelték.
Statisztikai analízis
A statisztikai elemzéseket SAS szoftverrel végeztük (9.3 verzió; SAS Institute, Cary, NC, USA). A leíró eredményeket átlag ± standard eltérés (SD) vagy százalékban fejeztük ki, a változó típusának megfelelően. A hatékonysági paraméterek változása a kiindulási értékről 24 hétre. összehasonlították a kezelési csoportok között, egyirányú varianciaanalízissel (ANOVA), a kezeléssel mint faktorral. Ezenkívül a sztatinhasználat figyelembevétele érdekében a kezelés hatásának értékelésekor ANOVA-t végeztek kezeléssel és sztatinhasználattal (igen/nem) tényezőként. Összehasonlítások a kezelési csoporton belül a kiindulási érték és a hetes érték között. 24-et páros t-teszttel végeztünk. Az összes elemzés jelentőségét P
Eredmények
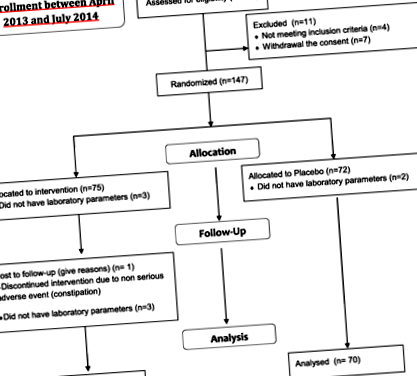
Százötvennyolc, 28 és 76 év közötti beteget vontak be vizsgálatunk alkalmassági kritériumainak. Száz negyven betegnél (71 az AP karon és 70 a PL karon) elemezték a laboratóriumi paramétereket a koordinációs központból. A fennmaradó 17 közül 5 betegnél nem elemezték a laboratóriumi paramétereket a koordinációs központból, míg 12 beteg idő előtt abbahagyta a vizsgálatot (4 az inklúzió/kizárás kritériumainak megsértése miatt, 7 a beleegyezés visszavonása miatt és 1 beteg az AP csoportban, a kezeléshez kapcsolódó nem súlyos mellékhatások miatt) (1. ábra).
Tanulmány folyamatábra
A betegek klinikai jellemzőit az 1. táblázat mutatja. A kiinduláskor a 2 csoport életkor, nem, egyidejűleg alkalmazott hipolipidémiás gyógyszerek, antropometriai paraméterek és lipidszintek tekintetében összehasonlítható volt. A placebo csoportban 44 beteget kezeltek sztatinokkal. Hasonlóképpen az AP csoportban 44 beteget kezeltek sztatinokkal.
24 hét után. A kezelés során a kiindulási értékhez viszonyított abszolút változások összehasonlítása a két csoport között nem mutatott szignifikáns eltérést az éhomi plazma glükóz és inzulin esetében, csakúgy, mint az inzulinrezisztens (HOMA-IR) index homeosztázis modelljének értékelése, míg a lipidprofil jelentős javulását az AP kar (2. táblázat) az összkoleszterin (Tot-C) csökkenésével (AP = - 11 mg/dl vs PL: + 3, o 0,05) (2. táblázat).
Bár a HDL-C redukciójában nem figyeltünk meg szignifikáns különbséget a két kar között, az AP csoportban szignifikánsan megnőtt (AP = + 2 mg/dl o 2. ábra
Végül a CRP-H-k szignifikáns javulását figyeltük meg az AP csoportban a PL-vel összehasonlítva (1,85 ± 2,34-ről 1,25 ± 1,54 mg/L-re, szemben 1,35 ± 1,01-ről 1,58 ± 1,83 mg/L-re, P 3. ábra
Nem figyeltek meg szignifikáns eltéréseket a testtömegben, a derék kerületében és a vérnyomásban, mind a csoporton belül, mind a csoporton belül.
A vese- és májparaméterekben nem figyeltek meg változásokat a vizsgálati időszak alatt. Az AP általában jól tolerálható volt, és a sperimentális kezeléssel kapcsolatban nem jelentkezett súlyos mellékhatás.
Vita
Vizsgálatunk nem erősíti meg az AP IR-re gyakorolt hatását, míg az AP hatékonyságát és biztonságosságát a lipid-anyagcsere javításában a MetS-ben szenvedő alanyok helyi populációjában. MetS-ben szenvedő betegeknél. 24 hetes kezelés után a tot-C, NHDL-C és LDL-C szignifikáns csökkenését figyeltük meg, az sdLDL-C méret növekedésével.
Ez a tanulmány először értékelte a BRB táplálékhatásait az sdLDL-C-re MetS-ben szenvedő populációban. A kezelési periódus után jelentős javulást tapasztaltunk az sdLDL-C méretben, ami a HDL-C szint növekedésével társult az AP karban, összehasonlítva a PL karral, amelyet általában a szív- és érrendszeri betegségek elleni védőanyagként tartanak számon.
Végül az aktív karú betegeknél javult az MetHD-ben klasszikusan megemelkedett NHDL-C szint javulása is, amely a kardiovaszkuláris kockázat és az endothelium károsodása miatt való figyelemre méltónak tűnik, amit a CRP-Hs értékek csökkenése is megerősített. AP kezelés.
Érdekes módon megjegyezzük, hogy adataink megerősítik, hogy az AP terápiás hatása azoknál a betegeknél is nyilvánvaló, akiket már sztatinokkal kezeltek [32].
„Farmakodinamikai” szempontból ezen eredmények némelyike a BRB lipid anyagcserére gyakorolt hatásának tudható be. A BRB növeli az LDL-receptor (LDLR) expresszióját a hepatocyták membránján, elősegítve annak géntranszkripcióját azáltal, hogy az LDLR-mRNS stabilizálódását indukálja, és gátolja annak lizoszómális lebomlását, a PCSK9 által közvetített [33]. Ez a mechanizmus független az intracelluláris koleszterinszinttől, és ellensúlyozhatja a sztatinok PCSK9-re gyakorolt indukáló hatását, ami az LDLC plazmaszintjének kontraproduktív növekedését eredményezi, ami csökkenti a gyógyszer lipidcsökkentő hatását. A farmakológiai és táplálkozási kombináció szinergikus hatékonyságot eredményezhet. A BRB az adenozin-monofoszfát-kinázon keresztül is képes inaktiválni az acetil-CoA-karboszilázt, amely kulcsfontosságú enzim a zsírsavszintézisben, ami a zsírsav-oxidáció növekedéséhez, a zsírsavszintézis csökkenéséhez és a TG-szintézis gátlásához vezet [33].
Van néhány korlátozás, amelyet figyelembe kell vennünk, például a vizsgálat rövid időtartama. A vizsgálat másik fontos korlátja a koleszterinszint-csökkentő terápia jelenléte; ezt a választást azonban etikai okok határozták meg, amelyek arra késztettek minket, hogy egy „top-of-up” kialakítást válasszunk. Ezenkívül feltételezzük, hogy az ARM inzulinérzékenységre gyakorolt hatásának hiánya a sztatin kezelésnek tudható be, tekintettel az inzulinérzékenységre jól ismert pozitív hatására.
Következtetés
Ez az első vizsgálat, amelyben a MetS által érintett betegek körében magas CVD-kockázattal rendelkező populációban értékelték az olyan vegyületek, mint a BRB, táplálékhatását az sdLDL-C-re. Eredményeink azt mutatták, hogy a MetS-ben szenvedő alanyok populációjában az AP-kezelés hatékony és biztonságos a lipidprofil és az atherogén faktorok javítására, már a statinokkal kezelt betegeknél is, csökkentve ezzel a fejlődés és a progresszió kockázatát. az ateroszklerózis kialakulása, különösen azoknál az egyéneknél, akiknél az atherogén sdLDL-C jelenléte miatt magas a CVD kockázata.
A kombinált terápia biztonsági profilja alátámasztja azoknál a betegeknél, akik nem tolerálják a sztatinokat, vagy egyetlen terápiával nem érik el a terápiás célokat.
További vizsgálatokra van szükség hosszú távú nyomon követéssel ezen ígéretes eredmények megerősítéséhez és a szív- és érrendszeri megbetegedések morbiditására és mortalitására gyakorolt hatásuk értékeléséhez.
- Az életmódbeli változások hatékonysága nem alkoholos máj steatosisban és metabolikus szindrómában szenvedő betegeknél
- A lipid és purin anyagcseréjének korrekciója artériás hipertóniában, elhízásban és köszvényben szenvedő betegeknél
- Étrendi szokások és metabolikus szindróma egy japán dolgozó népességben Táplálkozás; Anyagcsere teljes
- Gyors anyagcsere-diéta Hogyan lehet helyrehozni a káros anyagcserét, növelni az anyagcserét, enni többet,
- CrossFit alacsony szénhidrátfelmérésű bizonyíték a fenntartható anyagcsere-szindróma megfordítására