Alkoholmentes zsírmájbetegség: Az epesavval aktivált Farnesoid X receptor mint új kezelési cél
Michael Fuchs
Gasztroenterológiai, Hepatológiai és Táplálkozási Osztály, Belgiológiai Klinika, Virginia Commonwealth University Orvostudományi Kar, P.O. Box 980341, Richmond, VA 23298-0341, USA
Absztrakt
Az alkoholmentes zsírmájbetegség (NAFLD) jelenleg világszerte a leggyakoribb májbetegségként fejlődik. Előfordulhat májcirrhosis és májrák kialakulásában, és készen áll arra, hogy a közeljövőben a májtranszplantáció leggyakoribb indikációját képviselje. A NAFLD patogenezise multifaktoriális és nem teljesen ismert, de inzulinrezisztencia állapotot képvisel, amelyet a kardiovaszkuláris kockázati tényezők csoportja jellemez, beleértve az elhízást, diszlipidémiát, hiperglikémiát és magas vérnyomást. Fontos, hogy a NAFLD a szív- és érrendszeri betegségek független rizikófaktoraként is fejlődött. Sajnos egyelőre nem létezik a NAFLD kezelésének alapja. Kimutatták, hogy az epesavval aktivált nukleáris farnesoid X receptor (FXR) nemcsak az epesavban, hanem a lipid- és glükóz homeosztázisban is szerepet játszik. Az FXR specifikus célzása elegáns és nagyon hatékony módja lehet a szabályozatlan nukleáris receptor által közvetített metabolikus útvonalak újbóli beállításának. Ez az áttekintés a szervezet komplex reakcióját tárgyalja az FXR aktiválására, annak jótékony hatásaival, de a lehetséges nemkívánatos mellékhatásokkal is.
1. Bemutatkozás
Modern civilizációnk egyik jellemzője az egészségtelen és kalóriatartalmú sűrű ételek könnyű és korlátlan hozzáférése. Egy tipikus amerikai étrend biztosítja a májat
20 g zsír minden nap, ami megegyezik a máj teljes trigliceridtartalmának felével. A technológiai fejlődés miatt a fizikai aktivitás iránti kevés igény mellett az ülő és túlzott életmód egyik következménye az alkoholmentes zsírmájbetegség (NAFLD).
A NAFLD súlyos egészségügyi probléma, amely akár 60 millió amerikait érint és világszerte a leggyakoribb májbetegségként fejlődik ki [1, 2]. Ez többszörösen magasabb, mint más gyakori krónikus májbetegségek, például a hepatitis C és az alkohollal összefüggő májbetegségek. Míg a NAFLD-ben szenvedő alanyok többsége elhízott, az állapot elhízás vagy a metabolikus szindróma egyéb jellemzőinek hiányában jelentkezhet. Cukorbetegségben és kóros elhízásban szenvedő betegeknél a NAFLD prevalenciája 62, illetve 96% -nak bizonyult [3, 4].
A NAFLD legkorábbi stádiuma a zsírmáj, amelyet a citoplazmatikus trigliceridcseppek jelenléteként határoznak meg a hepatociták több mint 5% -ában [5]. Bár gyakran önkorlátozott, 12–40% -ban alkoholmentes steatohepatitiszé (NASH) válhat [6]. A NASH-t az egyszerű zsírmájtól a hepatocita sérülés jelenléte különbözteti meg, mint például a hepatocita ballonozása és apoptózisa, gyulladásos infiltrátum és/vagy kollagén lerakódás. 10–15 éves periódus alatt a NASH-ban szenvedő betegek 15% -a májcirrhosissá válik [7]. Miután a vírusos hepatitis hiányában cirrhosis alakult ki, a máj dekompenzációja évente 4% -os arányban fordul elő, míg a májrák kialakulásának tízéves kockázata 10% [7, 8]. Bár a NASH által másodlagos májrák általában a cirrhosis hátterében alakul ki, a carcinogenezis előrehaladott májbetegség hiányában is előfordulhat. Ezért nem meglepő, hogy a NAFLD arra készül, hogy a májtranszplantáció elsődleges indikációjává váljon. A krónikus májbetegség egyéb okaihoz hasonlóan a NASH is szinte átmenetileg ismétlődik a májtranszplantáció után [9].
2. A NAFLD alapvető kórélettani fogalmai és kezelése
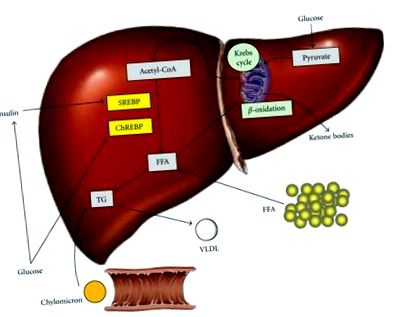
A máj triglicerid (TG) képződése, megszerzése és eltávolítása. A zsírmáj a szabad zsírsavak (FFA), valamint a TG input és az FFA és TG output közötti egyensúlyhiány eredménye. Az FFA perifériás szövetből, endogén szintézisből vagy diomból származik chilomicronok formájában. A szénhidrátbevitel növeli a glükóz és az inzulin szintjét, ezáltal elősegítve a lipogenezist a transzkripciós faktorok aktiválásával, a szterin szabályozó elem-kötő 1c fehérje (SREBP) és a szénhidrátra reagáló elem-kötő fehérje (ChREBP) révén. Az FFA terhelés csökkentése magában foglalja a β-oxidációt a mitokondriumokban, a tárolást TG-ként vagy az exportot nagyon alacsony sűrűségű lipoproteineként (VLDL).
A NAFLD kezelésének vagy meg kell akadályoznia a betegség májcirrhosissá válását, vagy meg kell fordítania a már kialakult NASH-t. A NAFLD patogenezisének megértése terén elért számos előrelépés ellenére jelenleg nincs elérhető kezelés. Az életmód megváltoztatása és a testtömeg csökkentése érdekében végzett testmozgás, valamint az egyidejű cukorbetegség és diszlipidémia kezelése elfogadható az első vonalbeli terápia, de nem bizonyított, hogy meggyőzően csökkentené a betegség előrehaladásának kockázatát [16]. Ezért kulcsfontosságú a közös betegség új útjainak feltárása.
3. Az epesavval aktivált nukleáris Farnesoid X receptor (FXR)
A nukleáris receptorok a transzkripciós faktorok csoportja, amely emberekben 48 tagból áll. Közös struktúrájuk van, amely egy ligandum-független aktivációs doménből áll, amely kölcsönhatásba lép a kofaktorokkal, egy központi DNS-kötő doménből és egy egyedi ligandum-kötő doménből, amely lehetővé teszi a receptor dimerizációját és a coregulator kölcsönhatásait. A legtöbb nukleáris receptor homodimerként vagy heterodimerként működik a retinoid X receptorral együtt. A ligandum megkötése elősegíti a konformációs változásokat, megkönnyítve a corepresszorok felszabadulását, és a kromatin konformációs változásait, ami lehetővé teszi a transzkripciós mechanizmus hozzáférését a megfelelő promóterekhez. A ligandum aktiválása után a corepresszor komplex disszociál, és a koaktivátor komplexet felveszik, lehetővé téve a transzkripció megkezdését. Úgy gondolják, hogy a nukleáris transzkripciós aktivitás ellenőrzése poszttranszlációs módosításokkal is megtörténik [17–19].
1995-ben felfedeztek egy fehérjét, amely kölcsönhatásba lépett a humán retinoic X receptorral, és retinoic X receptor kölcsönhatásba lépő fehérjét nevezték el 14 [20]. Mivel a mevalonát útvonal közbenső része, a farnesol aktiválta, átnevezték farnesoid X receptorra [21]. További négy évvel később három független csoport [22–24] fedezte fel az epesavakat az FXR endogén ligandumaiként. Evolúciós szempontból az FXR gén erősen konzervált, ami azt sugallja, hogy számos fajban fontos szerepet játszik. Szöveti szinten az FXR túlnyomórészt a májban, a belekben, a vesében és a mellékvesében expresszálódik. A szív és a zsírszövet expressziója alacsony [25]. Az Fxr géneltávolítással rendelkező egerek nemzedéke az FXR-t az epesav homeosztázis mesterregulátoraként azonosította [26]. Ezt követően az FXR új funkcióit azonosították, beleértve a bélgát védelmét és a veleszületett immunitás [27, 28] és tumorgenezis [29, 30] modulálását. Az FXR legfontosabb szerepe valószínűleg az anyagcsere folyamatok szabályozásában.
4. Az FXR mint kulcsszereplő több anyagcsere folyamatban
Hosszú ideig az epesavak fiziológiai hatásait elsősorban fizikai-kémiai tulajdonságaiknak tulajdonítják [31]. Az elmúlt néhány évben nyilvánvaló volt, hogy az epesavak jelátviteli molekulákként működnek [32], és nemcsak az enterohepatikus keringés során szabályozzák saját homeosztázisukat, hanem triglicerid, koleszterin és glükóz anyagcserét is.
4.1. Epesav anyagcsere
Az FXR fő fiziológiai szerepe az epesav anyagcserében az, hogy megvédje a hepatocitákat az epesavszint megnövekedett káros hatásaitól az endogén epesavszintézis gátlásával és az epesav biotranszformációjának és kiválasztásának felgyorsításával. E tekintetben az FXR által közvetített hatások szorosan összehangolt módon jelentkeznek a hepatocita és az enterocita szintjén, és másutt részletesen áttekintették őket [33].
4.2. Triglicerid és koleszterin metabolizmus
Évek óta ismert, hogy az epesavak képesek modulálni az emberekben a lipid anyagcserét. Az epesavak transzhepatikus fluxusának csökkentése csökkenti az alacsony sűrűségű lipoprotein koleszterinszintet és növeli a nagy sűrűségű lipoprotein koleszterin és a nagyon alacsony sűrűségű lipoprotein triglicerid szintet. Ellentétes hatások figyelhetők meg, ha az epesav-készlet bővül [34–36]. Fxr géneltávolítással vagy FXR agonisták beadásával végzett egereken végzett vizsgálatok kulcsfontosságú információkat szolgáltattak, amelyek bemutatták az FXR központi szerepét a lipid homeosztázisban.
4.3. Glükóz homeosztázis
4.4. Májgyulladás és fibrogenezis
A gyulladás és a májban a kollagén lerakódása a NASH legfontosabb hisztopatológiai jellemzője. Úgy tűnik, hogy az FXR antagonizálja a máj gyulladásos folyamatait azáltal, hogy antagonizálja a nukleáris faktor kappa B útvonalát [64]. Egy másik védő FXR mechanizmus antimikrobiális faktorok indukcióját foglalja magában a belekben [65]. Mivel az FXR olyan rágcsáló májstellátum sejtekben expresszálódik, amelyek kritikus szerepet játszanak a májfibrózisban, nem meglepő, hogy az FXR agonisták védenek a májfibrózis ellen [66]. Úgy tűnik, hogy ezt a különböző profibrotikus növekedési faktorok csökkent máj expressziója közvetíti, ideértve a transzformáló β1 növekedési faktort, a metalloproteináz 1 szöveti inhibitorát, az α1 (I) kollagént, az α simaizom aktint, a mátrix metalloproteináz 2 és az α2 (I) kollagént, valamint a mikroRNS-t. -29a [67–69]. Ha azonban ez a mechanizmus emberben is működik, alacsonyabb FXR expressziós szintet kell meghatározni [70]. Ezek az adatok azt sugallják, hogy az FXR célzása befolyásolhatja a NAFLD-ről a NASH-ra való haladást.
5. FXR és érelmeszesedés
Az FXR aktiváció pro- és antiaterogén hatása. Az érelmeszesedés tekintetében az FXR aktiválása jótékony és potenciális negatív hatásokkal járhat. Hacsak emberen nem tesztelték, nem lehet pontosan megjósolni, hogy a pro- vagy antiaterogén hatások dominánsak-e, és specifikus FXR modulátorok kifejlesztése segíthet elkerülni a negatív hatások egy részét vagy a legtöbbet. VCAM: vaszkuláris sejtadhéziós fehérje. ICAM: intracelluláris adhéziós molekula.
6. Összegzés és perspektíva
Az FXR kulcsszerepet játszik számtalan olyan célgén transzkripciós kontrolljában, amelyek a NAFLD szempontjából releváns metabolikus utakat szabályozzák. E szerepe révén az FXR kritikusan részt vesz a NAFLD fejlesztésében és előrehaladásában. Az FXR célzása ezért izgalmas új perspektívákat kínál a NAFLD kezelésében. Azonban a sejttenyésztésből nyert adatok és az emberi betegség rágcsálómodelljeinek értelmezésekor figyelmet kell fordítani a modellek és az emberek közötti különbségekre. Az FXR agonisták kialakításának egyik különös kihívása a kívánt terápiás hatások elkülönítése a nemkívánatos mellékhatásoktól. A szerv- vagy génspecifikus FXR ligandumok kialakítása növelheti ennek a terápiás megközelítésnek a specifitását és csökkentheti a mellékhatásokat. Az FXR és koregulátor fehérjéinek sejtszignalizációjának fokozott megértése segíthet új szelektív terápiás modulátorok felfedezésében, valamint új és hatékonyabb terápiák kifejlesztésében. Végül azt is figyelembe kell venni, hogy az FXR receptor modulációjára adott válasz NAFLD és NASH betegek között eltérő lehet.
- A tartós, magas zsírtartalmú étrendi táplálás elősegíti az alkoholmentes zsírmáj betegségeket és megváltoztatja a beleket
- A táplálkozás szerepe az alkoholmentes zsírmájbetegség patogenezisében és megelőzésében Legutóbbi
- A táplálkozás szerepe az alkoholmentes zsírmájbetegség patogenezisében és megelőzésében Legutóbbi
- Fizikai aktivitás beavatkozás nem alkoholos zsírmájbetegségben szenvedő betegek számára a
- Alkoholmentes zsírmájbetegség - Étel; Táplálkozási Magazin