Amiodaron által kiváltott tirotoxikus pajzsmirigy-gyulladás: diagnosztikai és terápiás kihívás
1 Belgyógyászati Klinika, Marshfield Klinika, 1000 N. Oak Avenue, Marshfield, WI 54449, USA
2 Endokrinológiai Osztály, Marshfield Clinic, Marshfield, WI 54449, USA
Absztrakt
Az amiodaron jódalapú, erős antiaritmiás gyógyszer, amelynek szerkezeti hasonlósága van a tiroxinnal (T4). Ismert, hogy pajzsmirigy-rendellenességeket okoz, a pajzsmirigy működésének kóros vizsgálatától kezdve a nyilvánvaló hypothyreosisig vagy hyperthyreosisig. Ezek a káros hatások olyan betegeknél jelentkezhetnek, akiknek pajzsmirigybetegsége van, vagy anélkül. Az amiodaron által kiváltott tirotoxikózis (AIT) egy klinikailag elismert állapot, amelyet általában a pajzsmirigy jód által indukált túlzott szintézise okoz, más néven 1-es típusú AIT. Ritka esetekben az AIT-t amiodaron által kiváltott pajzsmirigy-gyulladás okozza, ami előformált pajzsmirigyhormonok felszabadulását és hipertireoid állapotot eredményez, amelyet 2. típusú AIT-nek neveznek. Fontos megkülönböztetni a két állapotot, mivel mindkét állapotnak eltérő kezelési vonzata van; a vegyes előadás azonban nem ritka, diagnosztikai és kezelési kihívásokat jelent. Leírjuk az amiodaron által kiváltott 2-es típusú hyperthyreosisban szenvedő betegek esetét, és áttekintjük a diagnosztikai és kezelési megközelítések legjobb gyakorlataival kapcsolatos jelenlegi szakirodalmat.
1. Bemutatkozás
2. Esetismertetés
Egy 63 éves férfi kb. 2 évig 200 mg/nap amiodaron terápiát kapott a paroxizmális pitvarfibrilláció miatt másodlagos angina fájdalom miatt, a kamrai ritmus ellenőrzése ellenére. Az endokrinológiai osztályra utalták a pajzsmirigy-funkció monitorozásának során diagnosztizált hyperthyreosis miatt, ami az amiodaron-expozícióval kapcsolatos. Az elmúlt évben 19 kilós súlycsökkenésről számolt be, amely részben szándékos volt, és súlyosbodott a kézremegése, amelyet évekig szenvedett. Tagadta a hyperthyreosis egyéb tüneteit.
A korábbi kórtörténet szignifikáns volt a nonkkluzív koszorúér-betegség, a magas vérnyomás, a kóros elhízás és a perifériás érrendszeri megbetegedések esetében, claudikációval. Családtörténetében szerepelt egy nővér, akinek pajzsmirigy-tünetei voltak, de további részleteket nem tudott megadni. A beteg éber volt, akut szorongás nélkül, testtömege 263 font. A pajzsmirigy vizsgálata nem mutatott tapintható csomókat egyik lebenyen sem. A mirigy nyelés közben szabadon mozgott, és kissé diffúzan megnagyobbodott. A tapintás során nem észleltek lymphadenopathiát vagy érzékenységet. Az életjelek normálisak voltak, 110/60 Hgmm vérnyomás mellett. A vizsgálat hátralévő része nem volt figyelemre méltó.
A pajzsmirigyfunkciós tesztek 0,01 mIU/ml (0,35–4,5 mIU/ml), a szabad T4 2,7 ng/dl (0,6–1,2 ng/dL tartomány) és a szabad T3 szintet 3,7-es pajzsmirigy-stimuláló hormon (TSH) szintet mutattak ki. pg/ml (tartomány: 2,1–4,1 pg/ml). A pajzsmirigy ultrahangja nem mutatott hipervaszkularitást (1. ábra). 2 évvel ezelőtt elvégzett ultrahanggal multinoduláris mirigyet mutattak ki egy domináns jobboldali 1,3 × 0,8 cm-es csomóval, amelyről finom tűvel végzett aspirációs biopsziában jóindulatúnak találták. A bal oldalon volt még egy 1,1 × 0,6 cm-es csomó, amely nem volt biopsziás. A jobb oldali domináns csomó stabil maradt, és a bal oldali csomó kissé megnőtt, 1,2 cm-re. A rádió-jód felvétel és a pásztázás 0,6% (4–20% tartomány) és 0,2% (5–30%) felvétel volt 4 órában, illetve 24 órában, összhangban az amiodaron által kiváltott tirotoxikózissal a klinikai összefüggésben (2. ábra). A tiroglobulin antitestek szűrése normál állapotban volt 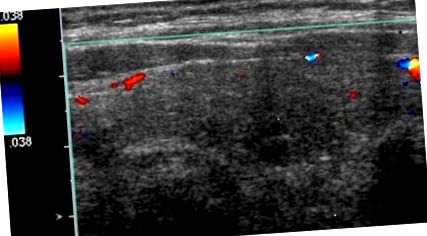
a)
b)
c)
Bár egyik megállapítás sem volt diagnosztikus, inkább az AIT2 diagnózist támogatták, sokkal inkább, mint a gyakoribb AIT1-et. A beteget egy hónapon át alacsony dózisú szteroidokkal (napi 20 mg prednizon) kezelték, az adagolás csökkentésével a pajzsmirigyfunkciós tesztek javulása után. A kétoldalú kézremegés javulásáról számolt be, vissza az alapértékéhez, és eutireoid volt, 3,09 mIU/ml TSH-val, a szabad T4 1,0 ng/dL-vel és a szabad T3 2,5 pg/ml-vel a következő követés során 3 hónappal később. A páciens klinikailag és biokémiailag eutiroid maradt az AIT megismétlődése nélkül, miközben az AIT2 kezelést követően 3 évig folytatta az amiodaron terápiát.
3. Megbeszélés
Az amiodaront különféle pitvari és kamrai ritmuszavarok kezelésére alkalmazzák, és a bal kamrai diszfunkcióban szenvedő betegek számára előnyös [2]. A pajzsmirigyhormonokkal való szerkezeti hasonlóság és a gyógyszeres jódtartalom miatt ismert, hogy jelentős változásokat okoz a pajzsmirigy működésének tesztelésében, gyakran klinikailag jelentős hatással [3].
3.1. Az amiodaronnal kapcsolatos pajzsmirigy-diszfunkció mechanizmusai
Az amiodaron gátolja az 1-es típusú 5′-dejodináz aktivitást a májban/perifériás szövetekben, amely a gyógyszer megvonását követően hetekig fennmaradhat [4]. Ezenkívül a gyógyszer gátolja az agyalapi mirigyben a 2-es típusú 5′-dejodináz aktivitást, ami csökkenti a T4 átalakulását T3-zá és a megnövekedett TSH-szintet [5]. Míg az amiodaron nincs hatással a plazma T3-medence metabolizmusára (eloszlására és eltávolítására) [6], a gyógyszer gátolja a pajzsmirigyhormonok keringésbe jutását [7]. Az 1. táblázat összefoglalja az amiodaron hatását a pajzsmirigyfunkciós tesztekre euthyreoid betegeknél.
Belső tulajdonságai miatt az amiodaron a jódban gazdag országokban, például az Egyesült Királyságban és az Egyesült Államokban, inkább a hypothyreosishoz, mint a tireotoxikózishoz társul [8]. Az amiodaron által kiváltott hyperthyreosis patogenezise még mindig nem teljesen ismert, ami a diagnózist és a kezelést kihívást jelent. Az AIT két fő típusát írták le, különböző mechanizmusokkal. Az AIT1 a jód által indukált felesleges szintézisnek és a pajzsmirigyhormonok felszabadulásának köszönhető, általában a rendellenes pajzsmirigyekből. Az AIT2 a destruktív pajzsmirigy-gyulladás egyik formája, amely az előformált hormonok szivárgásához vezet a keringésben. Bár a jódfelesleg mindkét altípusban fontos patogén tényező lehet, az AIT egyes formái pusztán a szubakut thyreoiditisnek és az előformált hormonok felszabadulásának köszönhetők.
3.2. Az AIT2 diagnózisa
Az AIT általában hirtelen jelentkezik, új vagy súlyosbodó ritmuszavarral jár, vagy tünetmentes lehet, különösen fiatalabb egyéneknél [9, 10]. Mivel az 1-es típusú hyperthyreosis gyakran előfordul már fennálló pajzsmirigybetegségben szenvedő betegeknél, az első hónapokban jelentkezik, míg az AIT2 előfordulásának medián ideje körülbelül 30 hónap az amiodaron-terápia megkezdését követően [11]. Mindkét esetben az első értékelésnek tartalmaznia kell a pajzsmirigy működésének szokásos megmunkálását, beleértve a TSH, T3, T4 és antithyroid antitesteket. A pajzsmirigy ultrahangja CFDS-sel vagy anélkül, valamint a radiojód felvétel (RAIU) és a szkennelés hasznos a két AIT altípus megkülönböztetésében.
Az AIT2-ben a RAIU alacsonyabb lenne (10%) [12]. Az Egyesült Államokban, ahol a legtöbb beteg jódban gazdag, a RAIU alacsony lehet mindkét AIT-típusban, ezért a CFDS hasznos a terápia irányításában [13, 14]. A CFDS valós idejű információkat nyújt a pajzsmirigy belsejében lévő véráramlásról és annak morfológiájáról. A follikuláris roncsolás, az AIT2-ben látható gyulladásos válaszok következtében kialakuló limfocita infiltráció miatt az ultrahang színáramlása megnövekedett vaszkularitást és véráramlási sebességet mutat [15]. Ezek a megállapítások a hiperfunkciós mirigyre utalnak, és a kezeletlen Grave-kór esetében is megfigyelhetők. A CFDS a döntéshozatal megkönnyítésére szolgál, viszonylag egyszerű felhasználhatósága, a gyorsabb eredmények elérésének képessége és a vizsgálat noninvazív jellege miatt, különösen életveszélyes tachyarrhythmia esetén.
A hiperfunkciós mellékpajzsmirigy adenómák és néhány rosszindulatú vagy jóindulatú pajzsmirigy daganat kimutatására MIBI szkennelést alkalmaztak. Nemrégiben felmerült az érdeklődés a kétféle AIT megkülönböztetése iránt. Egy 20 betegből álló kicsi tanulmány megállapította, hogy az AIT1 és AIT2 megkülönböztetésében jobb volt a CFDS-nél [16].
Az interleukin-6 (IL-6), a gyulladással összefüggő citokint biomarkerként javasolták az amiodaron által indukált thyreoiditis és a jód által kiváltott hyperthyreosis megkülönböztetésére. Az IL-6 szint emelkedése szorosan korrelált a szubakut pajzsmirigy-gyulladással olyan betegeknél, akiknek már nem volt fennálló pajzsmirigybetegsége. Az AIT1-ben szenvedő betegeknél normális vagy enyhe IL-6 emelkedést is találtak [17]. A 2. táblázat összehasonlító összefoglalást mutat be az amiodaron által kiváltott hyperthyreosis két típusa között.
Az 1. és 2. típusú amiodaron által kiváltott hyperthyreosis klinikai és kóros jellemzői † .
3.3. Kezelés
Az AIT2 elérhető legjobb kezelési lehetősége az orális glükokortikoid. Úgy hatnak, hogy csökkentik a pajzsmirigy gyulladását, az AIT2 elsődleges kóros mechanizmusát, és csökkentik a T4 perifériás átalakulását T3-ra is [18]. Az alapszintű szabad T4 koncentráció és a pajzsmirigy térfogata megjósolhatja a késleltetett válaszreakciót a glükokortikoidokra. Magas kockázatú egyéneknél ez segíthet azonosítani azokat az embereket, akiknél a műtétet és/vagy az iopánsavat a betegség korai szakaszában fontolóra kell venni [19].
A jopánsav, egy orális kolecisztográfiai szer (OCA), gátolja az 1-es típusú 5′-dejodináz aktivitást, amely enzim a T4 perifériás átalakulásáért T3. A szérum T3 szintjének 70% -os csökkenését figyelték meg 48 órás iopánsav adagolás után spontán hyperthyreosisos betegeknél, csekély hatással a szérum T4 koncentrációjára. Az iopánsav azonban nem befolyásolja az AIT2-hez kapcsolódó destruktív pajzsmirigy-gyulladásos folyamatokat [20]. A jopánsav ésszerű alternatíva a szteroidokkal a pajzsmirigy túlműködés rövid távú szabályozásához, de hosszabb ideig tart, mint a szteroidok használata az euthyroid állapot elérése érdekében, amint azt egy kicsi, prospektív, randomizált kontrollpróba mutatja [21].
Az AIT mindkét formájának együttélése miatt az AIT2-ben gyakran változó a válasz a glükokortikoid terápiára. A glükokortikoidokon kívül néha tionamidokra van szükség az euthyroid státusz eléréséhez ezekben a betegeknél. Az IL-6 szintek segíthetnek a terápia kiválasztásában, de napoktól hetekig tarthat a szintek bejelentése. Ezért súlyosan beteg betegeknél, amíg a diagnózis nem biztos, körültekintő mind az AIT1, mind az AIT2-et pajzsmirigy-ellenes gyógyszerekkel és glükokortikoidokkal kezelni perkloráttal vagy anélkül. A pajzsmirigy-szakorvosok lépcsőzetes megközelítést alkalmazhatnak, ahol a kezdeti terápia a tionamidok 4 héten át történő alkalmazását jelenti, és szteroidokat vezet be, ha a tionamid-terápiára nincs elégséges válasz vagy nincs megfelelő válasz.
Guitierrez-Repiso és mtsai. [23] megfigyelte, hogy megfelelő és stabil táplálkozású felnőtt populációban a véletlenszerű vizeletmintában a jódkiválasztás a napi jódbevitel 70–80% -át tette ki. Ezt a tényt több kutató is felhasználta a gyógyszer okozta tirotoxikózis diagnosztizálására vagy kezelésére [24–26]. Erdoğan és munkatársai azt javasolták, hogy az AIT-et prednizonnal, kálium-perkloráttal kezeljék, és a metimazolt titrálják vizelettel történő jódkiválasztással [27].
- 28 napos alacsony glikémiás menüterv kihívás - egyél
- 10 napos tiszta étkezési kihívás!
- Az A4-es derék veszélyes trendet jelentene - figyelmezteti a CTV News az étkezési rendellenességek szakértőjét
- Aszpartát-amino-transzferáz Davis s Lab; Diagnosztikai tesztek
- Az ápolók táplálkozási ismereteinek értékelése a terápiás étrendekről - ScienceDirect