Az alkoholmentes steatohepatitisre specifikus máj- és szérum lipid aláírások egér modellekben
Tárgyak
Absztrakt
A nem alkoholos zsírmáj (NAFL) az alkoholmentes steatohepatitis (NASH) előfutára, egy olyan állapot, amely cirrhosissá és hepatocelluláris carcinomává válhat. A NASH diagnózisának markerei még mindig hiányoznak. Vizsgáltunk lipidmarkereket olyan egérmodellekkel, amelyek NAFL-t fejlesztettek ki magas zsírtartalmú étrenddel (HFD) táplálva, vagy NASH-t metionin-kolinhiányos étrend (MCDD) alkalmazásával. Átfogó lipidomiás elemzést végeztünk a májszöveteken, valamint HFD-vel (n = 5), MCDD-vel (n = 5) vagy normál étrenddel etetett egerek szérumain (n = 10). A gépi tanulás megközelítése, amely a mikrosugarak előrejelzésének elemzésén alapul, majd véletlenszerű erdők lehetővé teszik a máj 149-ből 21 lipid és 14-ből 14 lipid azonosítását a szérumban, megkülönböztető egerek, amelyek HFD-ből vagy kontrollokból tápláltak MCDD-t. Összefoglalva, a megvalósított globális megközelítés lehetővé tette a NASH-ra specifikus lipid-aláírások jellemzését mind a májban, mind a szérumban állatmodellekből. Ez új utat nyit a korai és nem invazív lipidmarkerek vizsgálatára a NASH diagnosztizálására emberben.
Bevezetés
A nem alkoholos zsírmájbetegség (NAFLD) olyan kóros állapot, amely az alkoholmentes zsírmájtól (NAFL), az alkoholmentes steatohepatitisig (NASH) átfogó elváltozások széles spektrumát mutatja. Megállapításra került, hogy a NASH májfibrózis, cirrhosis és hepatocelluláris karcinóma kialakulásához vezethet, 1,2,3. A NAFLD egy szisztémás betegség, amely elhízással, inzulinrezisztenciával, 2-es típusú diabetes mellitusszal és 4,5,6,7 metabolikus szindrómával társul. Az olyan előfordulások drámai növekedése, amely jelenleg több mint 1 milliárd embert tesz, a NAFLD-t a krónikus májbetegségek leggyakoribb okává és világszerte jelentős közegészségügyi problémává teszi. 8,9,10,11 .
A zsírmájbetegség jellemzője a lipidek sejten belüli felhalmozódása, amelynek eredményeként lipidcseppek képződnek hepatocitákká. Ez a felhalmozódás a 4,12,13,14,15,16,17,18,19,20,21,22 zsírsavak felvétele, szintézise, exportja és oxidációja közötti egyensúlyhiányból adódik. Mivel nem minden lipid keletkezik egyenlően, a közelmúltban a NASH markereinek felkutatásakor átfogó lipidomikus vizsgálatokat végeztek májbiopsziákból vagy szérumokból humán minták vagy 12,23,24,25,26,27 egérmodellek felhasználásával. Ezek a vizsgálatok néhány lipid homeosztázisának változását tárták fel a NASH progressziója során. A megfelelő statisztikai eljárások hiánya miatt azonban egyik tanulmány sem volt képes a NASH specifikus lipid-aláírását jellemezni.
Ebben a tanulmányban a NAFL és a NASH jól bevált diétás egérmodelljeit használtuk. Megvalósítottunk egy átfogó lipidomikus elemzésen alapuló megközelítést, amelyet tanulás-gép elemzés követett, és ezeket az eredményeket felügyelet nélküli klaszterelemzéssel igazoltuk. Ez az eredeti adatelemzés mind a májban, mind a szérumban lipid-szignatúrákat azonosított, amelyek specifikusak a NASH-ra.
Eredmények
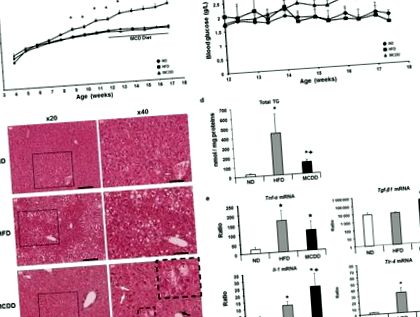
Alkoholmentes zsírmáj és steatohepatitis állatmodelljeinek jellemzése
A magas zsírtartalmú étrendet és a metionin-kolin hiányos étrendet tápláló egérmodellek jellemzői.
A gyulladással molekuláris szinten is foglalkoztak a gyulladásos folyamatba bevont gének máj mRNS expressziójának szintjének vizsgálatával, mint pl. Tnf-α, Tlr-4, Il-1 és Tgf- β1 33. Ezek a gének jelentősen megnőttek az MCDD-vel táplált egerek májában (1e. Ábra).
Fontos, hogy az MCDD-nél jelentkező rövid periódus miatt ezek közül az egerek egyike sem mutatott fibrózist, így a vizsgálatot a NASH progressziójának korai szakaszában helyezték el, elkerülve az esetleges metabolikus következményeket a hepatocytákon.
Az alkoholmentes steatohepatitis máj lipid aláírása
Specifikus máj lipideket megkülönböztető egerek táplálták MCDD-t.
Összességében ezek az eredmények bebizonyították, hogy az átfogó lipidomikus elemzés és az adatok tanulási megközelítései kombinálva sikerült a zsíros májbetegségek, különösen a NASH fokozatainak specifikus máj lipid-aláírását jellemezni.
Az alkoholmentes steatohepatitis szérum lipid aláírása
Specifikus szérum lipideket megkülönböztető egerek táplálták MCDD-t.
Összességében ezek az eredmények lehetővé tették a zsírmájbetegségek fokozatos specifikus szérum lipid-aláírásának jellemzését, különös tekintettel az MCDD-vel táplált egerekre, amelyek NASH-t fejlesztettek ki.
Az alkoholmentes steatohepatitis máj- és szérum-aláírásainak összehasonlítása
Vita
Ez a tanulmány kiemelte a lipidomikus globális megközelítés és a bioinformatikai specifikus stratégia, például a PAM, majd az elfogulatlan tanulási gép statisztikai megközelítés (azaz. véletlenszerű erdők) 38,39,40,41. Az ilyen statisztikai munkafolyamat lehetővé tette 21 lipid máj aláírásának és 14 lipid szérum aláírásának azonosítását az MCDD-vel táplált egerek számára, és felügyelet nélküli klaszteranalízissel validálták.
Az utóbbi időben a NASH MCDD-modellje volt a legjobb étrendi modell, amely gyorsan utánozta az emberi patológiát, anélkül, hogy az étrendnek és/vagy genetikai háttérnek bármilyen közvetlen hatása lenne, ami később módosíthatja a máj és a szérum lipidösszetételét 15, 28, 42, 43. Ezután a statisztikai munkafolyamat-megközelítés képes volt azonosítani azokat a máj- és szérum lipideket, amelyek már szignifikánsan megnövekedtek vagy csökkentek voltak a NAHS-ben szenvedő betegek vagy egerek modelljeiben 14,23,24,44,45,46,47,48,49,50,51, 52,53, de ezekben a vizsgálatokban mindezidáig egyik lipidet sem azonosították biomarkerként.
Valójában a májban vagy a szérumban minden egyes aláírást alkotó teljes lipidkombináció a kulcs a NASH csoport megkülönböztetéséhez, ahelyett, hogy az egyes lipideket önmagukban tekintenénk.
Mindkét aláírásból származó lipidek, például zsírsavak, foszfolipidek, koleszterin, szfingomielinek és eikozanoidok (például. 12-HETE, 18-HEPE) ismert, hogy szerepet játszanak a membránok felépítésében vagy a 12,16,21,54 sejtjelzésben. Így az aláírások tükrözhetik a máj metabolikus betegségeinek a sejtfolyamatokra gyakorolt jelentős hatását. Az aláírásokból származó lipidek szintén kiválthatják a gyulladást 17,24,48,55,56,57,58,59,60,61. Érdekes, hogy egérmodelljeinkben a lipid-aláírások korreláltak a gyulladás molekuláris markereivel. Egyre több bizonyíték azt sugallja, hogy a lipid-szignalizáció modulációja TLR-4 útvonal segítségével aktiválja a makrofágokat (például. a TNF-a felszabadulása) a lipotoxicitás mögött álló közös kórokozó mechanizmus a NASH 62,63-ban. A zsírsavak elősegítik a TNF-α által indukált hepatocita sejtek pusztulását és az immunrendszer aktiválódását 64,65,66,67,68. Megfigyeléseink szerint a TNF-α felszabadulása más pro-gyulladásos citokinek termelését is indukálta (például. IL-1, TGF-p1). Az MCDD-vel táplált egerek májszövetének szövettani vizsgálata mindössze 5 hét elteltével a NASH korai jeleit mutatta gyulladással és fibrózis nélkül, ami arra utal, hogy az anyagcsere-rendellenességek és így az ebből eredő lipid-aláírások korai eseményt jelenthetnek a NASH-ba történő progresszió során.
Összegzésként egyértelműen kifejlesztettünk egy új adatbányászati munkafolyamat-megközelítést a specifikus lipid-aláírások jellemzésére a NASH korai szakaszában a májban és a szérumban egyaránt. Ezt az új megközelítést kell alkalmazni az emberi klinikai vizsgálatokban. Ez új utakat nyit a NASH nem invazív korai diagnosztizálására és a NAFLD-ben szenvedő betegek nyomon követésére.
Mód
Állati modellek
Vérvétel
A táplált egereket 8 és 10 óra között elvéreztük. A szérumot elválasztották a vértől és -80 ° C-on tartották a lipidomikus elemzésig. A vércukorszintet a One Touch Ultra Glucometer (Lifescan Inc.) segítségével minden reggel 8 és 9 óra között értékelték az 5 hét alatt, heti három alkalommal. keresztül a farokér.
A gyulladásos folyamatban részt vevő gének kvantitatív valós idejű RT-PCR-je
A teljes RNS-t a máj fagyasztott szövetéből extraháltuk RNS-STAT 60 reagenssel (AMS Biotecnology Europe LTD, Egyesült Királyság), és a szinteket NanoDrop-ND1000 (Thermo Scientific) alkalmazásával számszerűsítettük. A cDNS-eket a RivertAid® első szál cDNS-szintézisének (Thermo Scientific, Franciaország) felhasználásával állítottuk elő, és a FastStart Essential DNA Green Master keverékekből származó Syber Green-et (Roche, Life Science) használtuk a mennyiségi meghatározáshoz. Tnf-a, Il1-a, Tgf-p1 és Tlr4 Az mRNS szintje az egyes gének specifikus primereivel, amelyeket korábban 71 írtunk le és az S1 kiegészítő táblázatban foglaltunk össze.
A valós idejű kvantitatív PCR-t LightCycler® 96 Instrument (Roche, Life Science) géppel végeztük. A génexpressziós szinteket az aktin RNS szintjére normalizáltuk, és az adatokat LightCycler® 96 SW 1.1 szoftverrel (Roche, Life Science) elemeztük. Minden minta esetében a gén Gadph arányt az egyes gének standard görbéjével meghatározott tetszőleges kópiaérték alapján számítottuk, a 72 előtt leírtak szerint .
Szövettani májvizsgálatok
A májokat eltávolítottuk és 4% paraformaldehidben PBS-ben (Sigma-Aldrich) rögzítettük egy éjszakán át, majd paraffinba ágyazottuk. Az 5 μm vastag sorozatokat metszettük a csúszó mikrotómon (Microm HM335E, Microm Microtech), és standard eljárásokkal hematoxilint és eozint vagy picrosirius vöröset festettünk. A szövettani májértékeléseket patológus szakértő végezte a NASH 30,31,32 meghatározása alapján, végül a tárgylemezeket a Scanscope 6 tárgylemezek (Aperio CS, USA) modelljével fényképezték le, képalkotással és a ColaPix szoftver v3.4.3 (TRIBVN) elemzésével., Fr) a 72 előtt használtak .
Lipidprofilozás
A májbiopsziákat 2 ml metanol/EGTA (2: 1 v/v) és 0,9 ml HBSS-ben homogenizáltuk eikozanoidok elemzéséhez FAST-PREP (MP Biochemicals) szöveti lizátorral a további lipidelemzésekhez. Ezenkívül 0,5 mg szövet egyenértékét elpárologtattuk. A száraz pelletet 0,25 ml NaOH-ban (0,1 M) egy éjszakán át feloldjuk, és a fehérjéket Bio-Rad assay-vel mérjük. A lipidek mennyiségi meghatározását nmol/mg összes fehérjében fejezzük ki.
Röviden, a lipideket kivontuk a májszövetekből (1 mg kibocsátásnak felel meg) vagy a szérumból (10 μl) Bligh és Dyer 73 szerint diklór-metán/metanol/víz (2,5: 2,5: 2,1, v/v/v) elegyben. a belső standardok (sztigmaszterin, koleszteril-heptadekanoát, gliceril-trinonadekanoát) jelenléte a semleges lipidek mennyiségi meghatározásához. A diklór-metán fázist szárazra pároljuk, és a maradékot 20 μl etil-acetátban oldjuk. 1 μl lipid-extraktumot gáz-folyadék kromatográfiával analizáltunk FOCUS Thermo Electron rendszeren, Zebron-1 Phenomenex fuzionált szilícium-dioxid-kapilláris oszlopokkal, a korábbi 74. publikáció szerint. A sütő hőmérsékletét 200 ° C-ról 350 ° C-ra programozták 5 ° C/perc sebességgel, és a hordozógáz hidrogén volt (0,5 bar). Az injektor és a detektor 315 ° C-on, illetve 345 ° C-on volt.
A relatív mennyiségi meghatározáshoz használt foszfolipideket semleges lipidként, de 2% ecetsavval extraháltuk a belső standardok jelenlétében (Cer (d18: 1/15: 0) 16 ng; PE (12: 0/12: 0) 180 ng; PC (13: 0/13: 0) 16 ng; SM (d18: 1/12: 0) 16 ng; PI (16: 0/17: 0) 30 ng; PS (12: 0/12: 0) 156,25 ng ). Centrifugálás után a szerves fázist összegyűjtöttük és azote atmoszférában szárítottuk, majd 50 μl metanolban oldottuk. A mintamegoldásokat egy Agilent 1290 UPLC rendszerrel elemeztük, amely egy G6460 hármas kvadripol spektrométerhez (Agilent Technologies) volt kapcsolva, és MassHunter szoftvert (Agilent Technologies) alkalmaztunk adatgyűjtéshez és elemzéshez. Kinetex HILIC oszlopot (Phenomenex, 50 × 4, 6 mm, 2, 6 μm) használtunk LC elválasztásra. Az oszlop hőmérsékletét 40 ° C-on szabályoztuk. A mozgó A fázis acetonitril volt; és B 10 mM ammónium-formiát volt 3,2 pH-jú vízben. A gradiens a következő volt: 10% és 30% B között 10 perc alatt; 10–12 perc, 100% B; majd a következő injekció beadása előtt 1 percig ismét egyensúlyba hozzuk a 10% B-t 13 percen keresztül. A mozgófázis áramlási sebessége 0,3 ml/perc, az injektálási térfogat pedig 5 μL volt. Elektrospray forrást alkalmaztunk pozitív (Cer, PE, PC és SM elemzéshez) és negatív ion módban (PI és PS elemzéshez). Az ütközési gáz azote volt. A tű feszültségét +4000 V-ra állítottuk.
Több szkennelési módot használtak. Először, a természetesen eltérő faj tömegének megszerzéséhez elemeztük a sejtek lipidkivonatait 184 m/z, 241 m/z és 264 m/z prekurzor ion-letapogatással PC/SM, PI és Cer; és 141-es, illetve 87-es semleges veszteségvizsgálat PE-re és PS-re. A Cer, PE, PC, SM, PI, PS ütközési energiaoptimuma 2 eV, 2 eV, 30 eV, 25 eV, 45 eV és 22 eV volt. Ezután a megfelelő SRM átmeneteket alkalmaztuk annak érdekében, hogy az egyes osztályokhoz különböző PL fajokat számszerűsítsünk. Az adatokat a QqQ Quantitative (B.05.00 verzió) és a Qualitative analysis szoftver (B.04.00 verzió) segítségével kezeltük.
A zsírsavmetil-észter (FAME) elemzéséhez a májszöveteket (1 mg-nak megfelelő mennyiség) vagy a szérumot (10 μl) semleges lipidekként extraháltuk a belső standardok gliceril-triheptadekanoát (2 μg) jelenlétében, és 1 órán át transzmetiláltuk bór-trifluoridban. 10% metanolos oldat 55 ° C-on. Miután a nyers anyaghoz 1 ml vizet adtunk, a FAME-ket 3 ml hexánnal extraháltuk, szárazra pároltuk és 20 μl etil-acetátban oldottuk. A FAME-t (1 μl) gáz-folyadék kromatográfiával analizáltuk Clarus 600 Perkin Elmer rendszeren, Famewax RESTEK fuzionált szilícium-dioxid-kapilláris oszlopokkal (30 m × 0,32 mm id., 0,25 μm filmvastagság) 75. A sütő hőmérsékletét 110 ° C-ról 220 ° C-ra programoztuk 2 ° C/perc sebességgel, és a hordozógáz hidrogén volt (0,5 bar). Az injektor és a detektor 225 ° C-on, illetve 245 ° C-on volt.
Eikozanoid profilozás
Statisztikai analízis
Minden számítást az R v.2.2.2 77 alkalmazásával hajtunk végre. Az állatkísérletekből fakadó torzítások elkerülése érdekében a májból és a szérumból azonosított lipideken mikro-sugarakra vonatkozó predikciós elemzést alkalmaztunk a négy egércsoport között, amelyek HFD-vel táplált egerek normál étrendjével etetett kontrollcsoportként (n = 5), HFD-vel táplált egerek esetében (n = 5), egy kontrollcsoport normál étrenddel etetett egerekkel MCDD-vel (n = 5) és MCDD-vel táplált egerekkel (n = 5), beleértve a heterogenitás elemzést, pontos és gyors osztályozót a beteg csoport egerek megkülönböztetésére MCDD-vel a „pamr”Csomag 78. A téves osztályozási hiba maximumát 20% -ra állítottuk be mind a máj-, mind a szérumanalízishez, hogy meghatározzuk a legjobb küszöbértéket a három egércsoportot megkülönböztető lipid minimumra.
A fő komponens analízist (PCA), 95% -ban magabiztos ellipszisközpontot az átlaghoz és a kérdéses lipideket kiszámítottuk és kivontuk „FactoMinR”Csomagot. A globális p-értéket az első és a második dimenzió tengelye mentén a varianciaanalízis F-tesztjéhez tartozó kritikus valószínűség felhasználásával számoltuk (α = 0,05).
Hőtérkép felügyelet nélküli klaszterezéssel, a DIvisive ANAlysis (DIANA dendrogram) alkalmazásával, euklideszi távolsággal, a májban és a szérumban azonosított lipidek alapján készült. hőtérkép.2 funkció a „gplots”És„fürt”Csomagokat, ill.
A változót boxplotként ábrázoltuk, és varianciaanalízissel (ANOVA-teszt, egyirányú) teszteltük, majd párosítatlanul t-teszt. A különböző lipidek arányának teszteléséhez különböző csoportokban chi-square (χ 2) tesztet alkalmaztunk Yate korrekciójával. Az I. típusú hibakészlet 5%, kétoldalas.
A grafikus ábrázolások kiszámításagplots”És„RColorBrewer”Csomagokat használtak.
további információ
Hogyan lehet idézni ezt a cikket: Chiappini, F. et al. Az alkoholmentes steatohepatitisre specifikus máj- és szérum lipid aláírások egér modellekben. Sci. ismétlés. 6., 31587; doi: 10.1038/srep31587 (2016).
- JLA Journal of Lipid and Atherosclerosis
- Köszvény okai A kávéfogyasztás alacsonyabb szérum húgysavval jár
- Az ivartalanított cica etetése - SPECIFIC ™
- Liu Wen, Fei Fei Sun és még több kínai modell a szülővárosi szépségápolási hagyományok divatjáról
- Hyperbilirubinemiát okozó veleszületett anyagcserezavarok - máj- és epebetegségek - Merck