Az anyai étrend programjai az embrionális vese gén expresszióját
Nephro-Urology, Gyermekegészségügyi Intézet, University College London, London, Egyesült Királyság
Molekuláris orvostudomány, Gyermekegészségügyi Intézet, University College London, London, Egyesült Királyság
Biostatisztika és epidemiológia, Gyermekegészségügyi Intézet, University College London, London, Egyesült Királyság
Molekuláris hematológiai és rákbiológiai egységek, Gyermekegészségügyi Intézet, University College London, London, Egyesült Királyság
Nephro-Urology, Gyermekegészségügyi Intézet, University College London, London, Egyesült Királyság
Absztrakt
Mi okozza az embert arra, hogy a normálnál kevesebb nephronnal szülessen (vese hypoplasia)? Valószínűleg legalább három általános oka van: 1) nephrogenesis gének mutációi, mint pl PAX2 és HNF1β (4; 51); 2) a magzati vizeletáramlás károsodása, amelyet fizikai obstrukció okoz az alsó vizeletkiáramló traktusban, amely fenotípus kísérleti állatokban modellezhető (46, 59); és 3) teratogének (45). Nemrégiben felvetődött egy negyedik ok, nevezetesen az, hogy a terhesség alatt bevitt anyai étrend modulálja a metanephros és más szervek fejlődését (40, 42). Ezt az elképzelést közvetett módon alátámasztják az alacsony születési súlyt felnőttkori betegségekkel, például magas vérnyomással, valamint 2-es típusú cukorbetegséggel és szívkoszorúér-betegséggel összekötő emberi epidemiológiai adatok (3, 61); az ilyen asszociációk akkor magyarázhatók, ha a magzati differenciálódást az anyai étrend „beprogramozhatja”. Patkányokban a fehérje korlátozása terhesség alatt kevesebb glomerulust és magasabb szisztémás vérnyomást eredményez, mint a kontrollok (32, 33, 56). Továbbá az embereknél pozitív összefüggés van a születési súly és a glomeruláris szám között (24).
Jelen tanulmányunkban két kérdéssel foglalkoztunk: 1) vajon az anyai LPD káros hatással van-e a végső glomeruláris számokra, ha a terhesség kezdetén kísérleti étrendet kezdeményeznek, és a terhesség vége helyett csak az E13.0 értéket folytatják, és 2) az LPD modulálja-e a génexpressziót az E13.0 metanephrosban? E kísérletek eredményei azt mutatják, hogy az anyai étrend programozza az átírást az embrionális vesében, amikor a nephronok és a glomerulusok még nem alakultak ki.
Az állati protokollokat az Egyesült Királyság Belügyminisztériuma hagyta jóvá. Az összes reagens a Sigma Chemical cégtől (Dorset, Egyesült Királyság) származik, hacsak másképp nem jelezzük.
Diétás manipulációk és glomeruláris számlálás.
Diétás manipulációk molekuláris és szövettani elemzésekhez.
Valós idejű PCR.
Western-blot elemzés és immunhisztokémia.
Anyai étrend és végső glomeruláris szám.
Az anyai LPD hatásának meghatározására az utódok végső nefronszámára először azt a protokollt vizsgáltuk, amelyben az étrendi fehérjetartalmat a terhesség alatt szabályozták (1. ábra). A 18% fehérjét E0,0-től a 31,2 × 10 3 ± 0,7 × 10 3 (átlagosan ± SE) glomerulusok/vese táplált patkák utódai; 9% LPD-nek kitett utódok a terhesség alatt 6,3 × 10 3 ± 1,7 × 10 3-kal kevesebb glomerulussal/vesével rendelkeztek, mint a kontrollok (kb. 20% -kal kevesebb, P 3 ± 1,6 × 10 3 glomerulus/vese kevesebb, mint a kontrollokban (körülbelül 23% -kal kevesebb, P 3 ± 1,4 × 103 glomerulus/vese kevesebb, mint a kontrollokban (körülbelül 19% -kal kevesebb, P 3 ± 1,3 × 10 3 glomerulus/vese kevesebb (kb. 24% -kal kevesebb, P 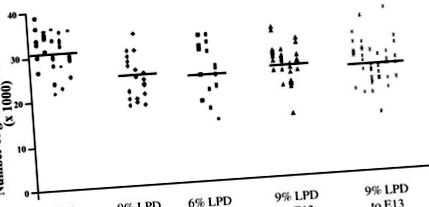
1. ábra.A diéták hatása a glomerulusok végső számára. A 2 hetes állatok veséiből származó teljes glomeruláris szám 2 hét alatt 18% fehérjének volt kitéve a terhesség alatt (•), 9% alacsony fehérjetartalmú étrendben (LPD) a terhesség alatt (⧫), 6% LPD a terhesség alatt (▪), 9% LPD embrionálisig 13. nap (E13.0), majd 18% fehérje a terhesség hátralévő részében (▴), vagy 6% LPD az E13.0-ig, majd 18% fehérje a terhesség hátralévő részében (X). Minden szimbólum egy vese, és minden oszlop külön almot jelent. * Jelentős különbség a 18% -os fehérje kontrollokhoz képest (P
Az LPD hatása a metanephric gén expressziójára, amelyet RDA értékel.
A fenti eredmények arra utalnak, hogy az LPD valamilyen módon megváltoztatta a patkány nephrogenesis pályáját a metanephros kialakulásának napjáig. Ezzel összhangban (56) korábban dokumentáltuk a megnövekedett metanephricus mesenchymalis apoptózist az E13.0-nál az anyák embrióiban, akiknek a terhesség kezdetén megkezdődött az LPD. Megállapítottuk, hogy ez a programozási hatás korrelálhat a metanephric gén expressziójának váltakozásaival, ezért RDA szűrést végeztünk, összehasonlítva az E13.0 metanephroit a kontroll és az LPD-nek kitett állatok között. Azzal, hogy 31 telepet szekvenáltunk a 18T kontra 9D hibridizáció inzertjeivel és 18 kolóniát a 9T kontra 18D hibridizációval, és kizártuk a mindkét sorozatban megjelenő „hamis” termékeket, ez a képernyő több átiratot is izolált, akár anya, akár anya szabályozta. LPD (1. táblázat) (9, 21, 25, 28, 29, 34, 39, 47, 52, 55, 62), néhányan többször is megjelennek.
1. táblázat: Reciprok RDA képernyőkről izolált átiratok
Az átiratokat az anyai 9% -os alacsony fehérjetartalmú étrend (LPD) szerint lefelé vagy felfelé szabályozzák. RDA, reprezentációs különbség elemzés.
* Átirat, amelynek jelenleg nincs ismert patkányszekvenciája, és ezért az egér átiratára utal.
Az LPD hatása a metanephric génexpresszióra valós idejű PCR-rel értékelve.
Az RDA-ban izolált gének közül több olyan fehérjéket kódol, amelyek megfelelnek a differenciálódás és az organogenezis potenciálisan érintett kritériumainak (például transzkripciós faktorok, adhéziós molekulák, a citoszkeletont befolyásoló fehérjék stb.). Ezeket E13.0 metanephroi-ban történő mérésre választottuk ki valós idejű PCR-rel mind a 9% -os, mind a 6% -os LPD-vel szemben a kontroll étrendben. Az eredményeket a 2. táblázat mutatja.
2. táblázat: Valós idejű PCR
A relatív transzkriptumszintek következetesen változnak a 18% fehérje kontrollhoz viszonyítva. A különböző étrendek közötti relatív transzkriptumszintek a valós idejű reakciók három sorozatának átlagos mért arányát képviselik minden étrendi mintán. A valós idejű elemzés során használt primereket mutatjuk be.
Immunhisztokémia.
2. ábra.Prox-1 immunhisztokémia. A kontroll metanephroiban a Prox-1 immuno-lokalizáció látható. A: E13.0 metanephros kis teljesítmény mellett immunreaktív jelet mutat (barna) az ureter rügy körüli sztrómákban (u); a kondenzáló mesenchyme (m) általában negatív volt. B: nagyobb teljesítményű kép A. C: hasonló szakasz, mint a B, izotípus kontroll immunglobulinnal vizsgáltuk. D: E15.0 metanephros nagy teljesítményen, amely a prox-1 széles körű expresszióját mutatja be a mesenchyme-ban, és a magok részhalmazait az ureter bimbóágakban és a nephron vezikulákban (v). Bar = 100 μm in A és 25 μm B – D. E: hasonló szakasz D, izotípus kontroll immunglobulinnal vizsgáltuk.
3. ábra.Cofilin-1 immunhisztokémia. A kontroll metanephroikat foszforilezett/defoszforilezett cofilin-1 antitesttel vizsgáltuk (A és B) vagy a foszforilezett kofilin-1-re specifikus antitest (D). A: E13.0 metanephros alacsony teljesítményen, immunreaktív jelet mutat (barna) mesenchyme és ureteric rügyben. B: nagyobb teljesítményű kép A. Vegye figyelembe a citoplazmatikus jelet az ureter rügyek epitheliájában és a kondenzáló mesenchyme-ben, míg a stromális sejtek nem mutattak szignifikáns jelet. C: hasonló szakasz B, foszforilezett kofilin-1-re specifikus antitesttel vizsgáltuk. D: az E15.0 metanephros központi régiója immunreaktivitást mutat a mély ureterás rügyágakban/gyűjtőcsatornákban; vegye figyelembe, hogy a környező sztróma negatív volt. Bar = 100 μm in A és 25 μm B – D.
Az apoptózissal kapcsolatos Bax és Bcl-2 gének expressziója.
A különböző táplálkozási csoportokban a Bax proapoptotikus gén és a Bcl-2 antiapoptotikus gén expresszióját mértük. Az E13.0 metanephroi valós idejű PCR-jének alkalmazásával mindkét gén expressziója lépésenként növekedett 9% és 6% LPD-vel (3. táblázat); az arányos növekedés nagyobb volt a Bax proapoptotikus génnél, mint a Bcl-2 antiapoptotikus génnél. A Bax expresszió növekedése a kontrollokhoz képest 560% volt 9% LPD-nél és 1269% 6% LPD-nél. Hasonló mintát figyeltünk meg a Bcl-2 esetében, ahol a 9% LPD 286% -os, a 6% -os LPD pedig 527% -os növekedést mutatott a kontrollokhoz képest. A Bax és a Bcl-2 arányának összehasonlítása azt mutatta, hogy ez nagyjából megduplázódott a kontrollokhoz képest 9% LPD (97% -os növekedés) és 6% LPD (141% -os növekedés) metanephroiban.
3. táblázat: Valós idejű PCR az apoptózissal kapcsolatos molekulákhoz
A különböző étrendek közötti relatív transzkriptumszintek az egyes étrendi minták három valós idejű PCR-reakciójának mért átlagos arányát képviselik. A valós idejű elemzés során használt primereket mutatjuk be.
Jelen tanulmányban olyan étrendi protokollt alkalmaztunk, amely a vemhes patkányoknak juttatott szintetikus étrend fehérjetartalmát változtatta. Ha ez lett volna az egyetlen manipuláció, akkor az étrend teljes energiatartalma csökkenne az LPD-vel szemben a normál étrenddel. Annak érdekében, hogy következtetéseket lehessen levonni az étkezési fehérje korlátozásának következményeiről, szemben a globális energiacsökkentéssel, vissza kellett állítani az étrend energiatartalmát; ennek érdekében megnöveltük a szénhidrát mennyiségét az étrendben. A szénhidrátok növekedése 15% körüli volt az LPD-ben, míg a fehérje csökkenése 50%, illetve 66% volt a 9% -os, illetve 6% -os LPD esetében. A szénhidráttartalom növekedése az LPD-ben ezért meglehetősen szerény volt, és valószínűtlennek tekintjük azt a jelenséget, amelyről ebben a tanulmányban beszámoltunk; bár egy zavaró hatás nem zárható ki, nincs olyan független publikált adat, amely igazolná, hogy a szénhidrátok ilyen szerény növekedése zavarja az embrionális növekedést.
A jelenlegi tanulmány azt is sugallja, hogy számos molekula, amelyekről korábban nem számoltak be, hogy expresszálódtak a metanephrosban, fontosak lehetnek a vesék fejlődésében.
A 9% LPD és a kontroll étrend jelen elemzésében a kvantitatív PCR elemzések adatai megerősítették az RDA szűrőn differenciálisan expresszált gének fel- és lefelé történő szabályozását; ezenkívül egy súlyosabb étrend-korlátozás, azaz 6% LPD kvantitatív PCR-analízise azonos génkészlet hasonló fel- vagy lefelé történő szabályozását mutatta. Ezekkel a vizsgálatokkal kapcsolatban meg kell jegyezni, hogy az RDA-hoz és a kvantitatív PCR-elemzésekhez használt mRNS-t az egyes étrendek külön embriószervekből nyerték.
A jelenlegi RDA-szűrés számos más gént azonosított, amelyeket az anyai LPD fel- vagy le-szabályozott. Noha a tér nem teszi lehetővé mindegyikük részletes leírását, figyelemre méltó, hogy laktát-dehidrogenáz enzimeket detektáltak az egér metanephroiban (29), és a kadherin-11-ről beszámoltak a vese- és más szervi ruderek mesenchyme-jén belüli expresszióról (10); Megjegyzendő, hogy egy cDNS microarray analízissel a cadherin-11-et génként azonosították indukálatlan egér vesemesenchimában (9). Megállapítottuk, hogy a kalmodulint az anyai LPD szabályozta, mások pedig beszámoltak arról, hogy a nefronok kialakulásában kalmodulint kötő fehérjét-1 detektáltak (38). Az a-tubulin LPD általi csökkentése szintén figyelemre méltó, mert ez a molekula a citoszkeleton egyik fő alkotóeleme, és kritikus a vese hám polaritásának és a differenciált állapot fenntartásának a szubapikális hálóban és az alaptestekben végződő mikrotubulusokban való jelenlétével (5)., 43).
Tekintettel arra, hogy korábbi LPD-tanulmányunk (56) az uregulált metanephricis apoptózist az anyai LPD-hez kötötte, figyelemre méltó volt, hogy a jelen tanulmányban teljesített RDA-szűrés nem azonosította az apoptózishoz „klasszikusan” társított gének megváltozott expresszióját. Baxról és Bcl-2-ről ismert, hogy normális vesefejlődésben expresszálódnak, és expressziójukról ismert, hogy a perturbált nephrogenesishez és az apoptózishoz kapcsolódó bizonyos körülmények között, például a magzati vizeletáramlás elzáródásában, deregulációjuk van (53, 36). Az E13.0 metanephroi valós idejű PCR-jével mindkét gén expressziójának lépésenkénti növekedését figyeltük meg 9% és 6% LPD-vel; Érdekes módon az arányos növekedés nagyobb volt a Bax proapoptotikus génnél, mint a Bcl-2 antiapoptotikus gén, ami talán arra utal, hogy az LPD elmozdítja az expresszió egyensúlyát a metanephricus prekurzor sejtek halálának upregulálása érdekében. Az a tény, hogy az RDA nem azonosította ezeket a változásokat, aláhúzza azt a tényt, hogy ez a technika, bár hasznos a génexpresszió néhány változásának kimutatására, egyáltalán nem teljes körű.
Hogyan változtathatja meg a génexpressziót az anyai étrend? A glükokortikoidok közvetítik az embrionális programozást, mert a dexametazon vemhes patkányokban vese hypoplasiát és hipertóniát okoz az utódokban (8), az LPD pedig csökkenti a placenta 11β-hidroxi-szteroid dehidrogenázt, egy enzimet, amely megvédi a fogamzót az anyai glükokortikoidoktól, és emeli fel a magzat biokémiai markereit a glükokortikoid expozícióval (31). . A fejlődő húgyutak expresszálják a glükokortikoid receptorokat (27), és informatív lenne megvizsgálni a glükokortikoidok hatásait a jelen RDA-képernyőn azonosított gének expressziójára. A kísérleti intrauterin növekedési retardáció egy másik forgatókönyv, amely a megnövekedett vese apoptózissal és glomeruláris hiányokkal társul (50); érdekes módon ugyanez a tanulmány arról számolt be, hogy ezekben a kísérleti állatokban megváltozott a p53 génmetilációs állapota. Érdekes módon az emberi prox-1 gén megváltozott metilációja egyes hematológiai rosszindulatú daganatokban fordul elő (44). Összességében érdekes lenne biokémiai kísérleteket végezni annak megállapítására, hogy az anyai LPD megváltoztatja-e a gének, például a prox-1 és a kolfilin-1 metilációs állapotát és transzkripciós sebességét.
Ezt a tanulmányt az Országos Vese Kutatási Alap és a Vese Kutatás Segély Alap támogatta.
- Living Fit HMR diéta és fogyókúrás programok - közlemény Meghatározatlan változó rekord
- A hosszú távú, magas sótartalmú étrend magas vérnyomást okoz és csökkenti a vaszkuláris endoteliális vese expressziót
- A magas zsírtartalmú étrendbevitel modulálja az anya bélének terhességhez való alkalmazkodását, és azt eredményezi
- HILL S ELŐÍRÁS DIÉTA kd Veseápolási fajtacsomag nedves; Száraz macskaeledel
- HILL S ELŐÍRÁSI DIÉTA kd Vesemondás mobilitási ellátás csirkével; Zöldséges pörkölt macskakonzerv