Az axon regenerációjának sejten belüli szabályozása
Fernando M márc
1 Idegregenerációs csoport, Instituto de Biologia Molecular e Celular-IBMC, Portói Egyetem, Porto, Portugália
Azad Bonni
2 Harvard Medical School, Boston, MA, USA
3 Washington Egyetem Orvostudományi Kar, St. Louis, MO, USA
Mónica M Sousa
1 Idegregenerációs csoport, Instituto de Biologia Molecular e Celular-IBMC, Portói Egyetem, Porto, Portugália
Absztrakt
Bár a neuronok a fejlődés során az axonális növekedés sejten belüli programját hajtják végre, a kapcsolatok létrejöttét követően a fejlődési növekedési képesség csökken. A környezeti kihívások mellett ez a váltás nagyrészt a felnőttkori központi idegrendszer (CNS) axonjainak regenerációs kudarcát okozza. Itt tárgyaljuk az axonregeneráció sejtek belső szabályozását, beleértve nemcsak a transzkripciós és epigenetikai mechanizmusok szabályozását, hanem a lokális fehérje transzláció, a retrográd és anterográd axon transzport modulációját és a mikrotubulusok dinamikáját is. Tovább vizsgáljuk azokat az okokat, amelyek a központi idegrendszer neuronjainak erőteljes regeneratív választ eredményeznek, és a sejtek belső axon növekedési programjainak aktiválását bemutató paradigmákat. Végül bemutatjuk az axonregeneráció támogatásának lehetséges mechanizmusait, mivel ezek a jövőbeni terápiás megközelítéseket jelenthetik a központi idegrendszeri sérülés és betegség utáni gyógyulás elősegítésére.
Bevezetés
Az axonregeneráció sejten belüli mechanizmusai a PNS-ben
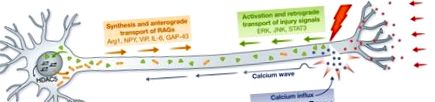
A kalcium beáramlása az axoplazmába az egyik első jel, amelyet a sérülés okoz, és a kalcium/nátrium fluxus inverziója által kiváltott depolarizáció az axon mentén halad a sejttest felé. A kalcium beáramlását itt tárgyaljuk az axonregenerációt szabályozó sejten belüli tényezők összefüggésében, mivel a sejtek különféle autonóm mechanizmusait váltja ki, amelyek szükségesek az axon sikeres növekedéséhez, kezdve az intracelluláris utak szabályozásától az epigenetikus változások kialakulásáig. A Caenorhabditis elegans szenzoros neuronokban az axonális kalciumhullámok amplitúdója korrelál a regeneráció mértékével, és fordítva, a feszültségtől függő kalciumcsatornák vagy a belső raktárakból történő kalcium felszabadulás gátlása csökkenti az axonok regeneratív növekedését [3]. Bár az elektromos stimuláció következményei ellentmondásos eredményeket hoznak, valószínűleg a stimulációs paradigmák különbségei miatt, egy gyenge inger javíthatja a patkány motorjának [4] és az érzékszervi idegsejtek [5] regenerálódását. A felnőtt rágcsáló dorsalis gyökér ganglionjainak (DRG) fiziológiai aktivitását utánzó erős elektromos impulzus azonban erősen gátolja az axon kinövését, és a PNS sérülést követő elektromos aktivitás elvesztése elősegíti az axon regenerációt a PNS-ben [6].
Az axonális megnyúlás visszaszorítása sérülés esetén enyhíthető a célból származó negatív sérülési jelek és az elektromos aktivitás megszakításával. Az axoplazmába történő kalcium beáramlás aktiválja a cAMP-t és a PKA-t, jelezve a DLK-1-nek, elősegítve a növekedési kúp kialakulását, a helyi fehérjeszintézist és az axonális membrán visszazárását. A kalcium hullám visszajut a sejt testébe, ami HDAC5 nukleáris exporthoz vezet, aktiválva a proregeneratív transzkripciós programot. A kalciumfüggő korai fázist követően a sérülési jelek, köztük az ERK, a JNK és a STAT3 retrográd transzportja következik be. A sejttestben RAG-k (többek között Arg1, NPY, VIP, IL-6, GAP-43) fejeződnek ki, amelyek szükségesek a regeneratív válasz kialakításához. cAMP, ciklikus adenozin-monofoszfát; DLK-1, kettős leucin cipzár kináz 1; ERK, extracelluláris szignál által szabályozott kináz; HDAC5, hiszton-dezacetiláz 5; JNK, c-Jun amino-terminális kináz; RAG, regenerációval társult gén.
Helyileg aktivált sérülési jelek retrográd szállítása
Sérülést követően a helyi fehérjeszintézis aktiválódik. Az axotomia kiváltja az importin β1 és a vimentin mRNS transzlációját. A Vimentin úgy kapcsolja össze a PERK-t az importin – dynein komplextel, hogy a sérülési jel retrográd módon továbbjut a sejttestbe. A ZBP1 szükséges a sérülés után transzlálódó β-aktin és GAP-43 mRNS axonális lokalizációjához. A mitokondriumok fokozott anterográd transzportját a sérülés is kiváltja. GAP-43, növekedéssel társult fehérje-43; pERK, foszforilezett extracelluláris szignál-szabályozott kináz; ZBP1, irányítószám-kötő fehérje 1.
Az idegkárosodásra adott válasz számos transzkripciós faktor aktivációján alapszik. A transzkripciós faktorok egy részét a fenti sérülési jelek aktiválják. Az ERK aktiválja az ETS doméntartalmú fehérjét (Elk-1) [26], míg a JNK aktiválja a c-Jun-t és a 3-as transzkripciós faktort (ATF3) [32]. A regeneratív válaszban szerepet játszó egyéb transzkripciós faktorokat szintén azonosítottak patkány és egér DRG neuronokat alkalmazó vizsgálatokban, beleértve a cAMP válasz elem-kötő fehérjét (CREB) [31], az SRY-vel kapcsolatos HMG-boxot (Sox11) [33], a foszfatidil-inozitolt 3 -kináz (PI3K) és Smad1 [13, 34]. Együtt változtatják meg a sérült idegsejtek transzkripciós profilját, hozzájárulva túlélésükhöz és regenerációjukhoz [33]. Ebben az összefüggésben és a korábbi adatok integrálásával bebizonyosodott, hogy a PNS sérülés aktiválja a PI3K jelátvitelt, ami a glikogén szintáz kináz 3 (GSK3) inaktiválásához vezet, és arra utal, hogy a PI3K-GSK3-Smad1 útvonal központi szerepet játszik a szenzoros axon regenerációjának elősegítésében [ 13]. Az aktivált transzkripciós faktorok számos RAG expresszióját is indukálják, beleértve az argináz-1 [34], NPY, VIP [35], interleukin-6 (IL-6) [36], GAP-43 és CAP-23 [37], többek között (1. ábra).
A sérülés következtében a negatív sérülési jelek, esetleg a célból származó molekulák retrográd transzportjának megszakadása felszabadíthatja az idegsejteket az elnyomásból, hogy megnyúljanak, lehetővé téve a regenerációt. Ebben az összefüggésben bebizonyosodott, hogy az elváltozást követően az idegi növekedési faktor (NGF) szintjének csökkenése a szimpatikus és szenzoros neuronokban hozzájárul a neuropeptid expressziójának megnövekedett szintjéhez [38]. Hasonlóképpen, az elektromos aktivitás megszűnése a perifériás elváltozás után hozzájárul a regeneratív válaszhoz [6]. Mint ilyen, mind a célból származó NGF, mind az elektromos aktivitás negatív sérülésjeleknek tekinthető. Összefoglalva, a regenerációt elősegítő sérülésjelek mellett felnőtt naiv PNS idegsejtekben enyhülhet az axonális megnyúlás visszaszorítása sérülés esetén.
Anterográd axonális transzport a hatékony regeneratív válasz érdekében
A megvitatott bizonyítékok ellenére, amelyek arra engednek következtetni, hogy az axonális transzport központi szerepet játszik az axonregeneráció során, a transzport sérülés általi modulációja nem jól ismert. Pontosabban meg kell határozni azokat a mechanizmusokat, amelyek az axon transzport növekedését szolgálják a PNS sérülés után, és a jövőbeni vizsgálatoknak meg kell határozniuk, hogy a molekulamotorokat érinti-e az elváltozás, vagy ha alternatív megoldásként a mikrotubulus-pályák módosulnak.
Irányítószámok és helyi fehérjeszintézis az axonális regeneráció során
Miért nem képesek a központi idegrendszeri idegsejtek létrehozni egy robusztus regeneratív programot?
A PNS-sel ellentétben a sérült központi idegrendszeri axonok korlátozottan képesek regenerálódni. A nagymértékben gátló glia heg kialakulása mellett számos különbség is felvethető a regenerációs képesség hiányának magyarázatára, ideértve a nem hatékony Waller-féle degenerációt, a sérülés jelzésének lehetséges hibáit, a sérülésre adott robusztus válasz hiányát, a fehérjék lokális szintetizálásának korlátozott képességét, és az axonális újranövekedés gátlóinak létezése. Valójában a patkány központi idegrendszeri idegsejtjei nem képesek hatékonyan aktiválni az axonregeneráció megvalósulásához szükséges gének sokaságát [54]. Érdekes módon a sejttest kalciumváltozásainak amplitúdója és időtartama magasabb a patkány DRG-ben, mint a kortikális neuronokban [55], és a DRG idegsejtek túl tudják élni a magas kalcium-periódusokat, míg ezek károsak a központi idegrendszer neuronjaira [56]. Ezenkívül a retina ganglionsejtjeiben (RGC) megnövekedett hiszton-acetiláció nem fordul elő [10]. Ezek a különbségek együttesen hozzájárulhatnak a proregeneratív program aktiválásának kudarcához (3. ábra).
A fejlesztés során a sejtek több útvonalból álló belső programja révén az idegsejtek robusztus megnyúlási képességgel rendelkeznek. A kapcsolatok létrejötte után a felnőtt központi idegrendszeri idegsejtek korlátozott regenerációs képességgel rendelkeznek a csökkent kalciumváltozások, a hiszton-acetiláció növekedésének, a RAG-ok robusztus szintézisének hiánya, a korlátozott helyi fehérjeszintézis és az axon visszanövekedés gátlóinak (PTEN, SOCS3 és EFA-6). A felnőtt PNS idegsejtek azonban magas belső növekedési képességgel rendelkeznek egy regeneráció-specifikus program aktiválása következtében, és valószínűleg a fejlődéssel összefüggő utak összefoglalása révén is. CNS, központi idegrendszer; EFA-6, Arf6 átváltási tényezője; PNS, perifériás idegrendszer; PTEN, foszfatáz és tenzin homológ; RAG, regenerációval társult gén; SOCS3, a citokin szignál szupresszora 3.
A különböző mutáns egérvonalak axonregenerációjának elemzésével kimutatták, hogy a JAK-STAT3 útvonal gátlója, a citokin szignál 3 szuppresszorának (SOCS3) törlése elősegíti a sérült látóideg axonok robusztus regenerációját [60]. Megjegyzendő, hogy a PTEN és az SOCS3 egyidejű törlése tovább növeli az axonregenerációt, mivel ezek a jelek két független utat szabályoznak, amelyek szinergikusan hatnak [61]. Összefoglalva, az mTOR és a STAT3 útvonal kulcsfontosságú szabályozóként jelent meg a felnőtt távolsági axon regenerációjának elősegítésére a felnőtt központi idegrendszerben. Ennek a nézetnek a megerősítése, a PTEN vagy SOCS3 deléció javítja a különféle központi idegrendszeri axonok regenerálódását [57, 60, 62, 63], a STAT3 tartós aktiválása pedig elősegíti a kortikospinális átalakulást és a gerincvelő sérülése utáni funkcionális helyreállítást [64]. A közelmúltban a C. elegans mechanosensoros neuronokban a konzervált Arf guanin nukleotidcserefaktorról, az EFA-6-ról beszámoltak arról, hogy az axon újranövekedés belső gátlója, amely az axon mikrotubulus dinamikájának befolyásolásával működik, a DLK-tól lefelé és/vagy azzal párhuzamosan hat. 1 [65].
Ezek a tanulmányok együttesen azt jelzik, hogy az axonregenerációt nemcsak az extrinsic gátló jelek, hanem az intrinsic tényezők is korlátozzák. Mint ilyen, a belső növekedési szabályozási utak manipulációját aktívan folytatják terápiás megközelítésként az axon regenerációjának elősegítésére a központi idegrendszeri sérülés után.
A felnőtt központi idegrendszeri neuronok sejtek belső növekedési képessége aktiválható
A cAMP mellett számos tanulmány széles körű változásokat azonosított a rágcsálók kondicionált neuronjaiban a génexpresszióban [36, 69], amelyet több transzkripciós faktor aktiválása szabályozott [76]. A lefelé irányban a hagyományos RAG-ok, például a GAP-43 és a CAP-23 [77] kifejeződése indukálódik, és új RAG-okat azonosítottak ezzel a modellel, beleértve az argináz-1-et [34] és az IL-6-ot [36]. Ugyanakkor az azonosított transzkripciós faktorok vagy RAG-k egyike sem reprodukálja a teljes kondicionáló hatást [74], ami arra utal, hogy a kondicionálást nem lehet utánozni egyetlen út manipulálásával. Ezt a nézetet alátámasztva a HDAC5 nukleáris export által kiváltott epigenetikai változások részben reprodukálják a kondicionáló elváltozás hatását [10]. Számos kérdés továbbra is nyitott, köztük a sérülés okozta jelátvitel különbségei, amelyek lehetővé teszik a perifériás sérülés erős regenerációs válasz kiváltását, míg ugyanannak az idegsejtnek a központi elváltozása ezt nem teszi meg (Sidebar A.
Az axonális mikrotubulusok dinamikájának manipulálása a regeneráció elősegítése érdekében
Számos olyan útvonal, amely hozzájárul a sejtek regenerációjának belső kontrolljához, részt vesz az axonális citoszkeleton átalakításában, különösen a mikrotubulusok dinamikájának modulálásával. Mint ilyen, a mikrotubulusokkal kapcsolatos fehérjék szintjén beavatkozó potenciális terápiás stratégiákat aktívan folytatták. Ebben a tekintetben, és az ezen áttekintésben már tárgyaltakon kívül, ideértve a HDAC5-et és a 6-ot is, számos más lehetséges célpontot azonosítottak, köztük a GSK3β-t, mivel számos szubsztrátja mikrotubulus-kölcsönhatásban lévő fehérje [84].
A kinezin család tagjai szintén fontos szereplőként szerepelnek a mikrotubulusok dinamikájának szabályozásában az axonális regeneráció során. Kimutatták, hogy a KIF3C sérülésspecifikus kinezin, mikrotubulus-destabilizáló funkcióval, kulcsszerepet játszik az axon újranövekedése során [83]. A KIF3C kimerülése felnőtt idegsejtekben a stabil és hurkolt mikrotubulusok növekedéséhez vezet, és késlelteti az axonális regenerációt a sérülés után [83]. A KIF3C mellett a C. elegans mechanosensory axonokban a depolimerizáló kinezinszerű fehérjecsalád 7-es tagja (KLP-7) korlátozza a mikrotubulus növekedését egyensúlyi állapotban [85]. Az axon sérülés után a növekvő mikrotubulusok száma megnő a sérülés helyén, egyidejűleg a KLP-7 downregulációjával, a DLK-1 által koordinált kaszkádban [85]. Ezt a mechanizmust javasolták egy érett idegsejt stabil mikrotubulus citoszkeletonjának átalakítására egy regeneráló axon dinamikusan növekvő mikrotubulus citoszkeletonjává.
A visszahúzódó gömb vagy a növekedési kúp kialakulásában részt vevő mikrotubulus-kölcsönhatásban lévő fehérjék azonosításának fontossága mellett további elemzésre van szükség a sérülés utáni transzláció utáni mikrotubulus-módosítások szabályozásának, mivel ezek szabályozzák a mikrotubulusok dinamikáját, és zavarhatnak is. axonális transzporttal, ezért befolyásolja az axonális újranövekedést.
Következtetések és kilátások
A C. elegans szisztematikus genetikai szűrésével nyert legfrissebb bizonyítékok azt mutatják, hogy az érett idegsejtekben elnyomható fejlődési programok kiváltása mellett a regeneratív növekedés olyan specifikus utakat is magában foglal, amelyek érzékelik és specifikusan reagálnak a károsodásokra [65] (3. ábra). Bár az axonális regeneráció nem tekinthető az axon megnyúlásának puszta összegzésének a fejlődés során, a működési mechanizmusok egy része közös. Az axon növekedése a fejlődés során két különböző szakaszban történik: a növekedés kezdeti szakaszában és egy későbbi szakaszban, amely a metszés során játszódik le [86]. Úgy tűnik, hogy az axon növekedése a fejlődési átalakítás során mechanikailag megkülönbözteti az axon kezdeti kinövésétől. Érdekes módon a közös útvonalak, például az mTOR jelátvitel, a fejlődési axon újranövekedés és az axonális regeneráció során működnek [86].
Az ubiquitin ligáz Cdh1-anafázist elősegítő komplex (Cdh1-APC) útvonala szintén kritikus sejt belső mechanizmus, amely szabályozza az axon növekedését a rágcsálóban kialakuló kisagykéregben [87]. A Cdh1-APC gátlása az elsődleges idegsejtekben fokozza az axonális növekedést, és felülírja az axon újratermelésének mielin-gátlását is [87]. Elképzelhető, hogy a Cdh1-APC ezért potenciálisan korlátozhatja az axon növekedést a felnőtt központi idegrendszerben. A kulcsfontosságú nyomonkövetési vizsgálatok során az SnoN transzkripciós szabályozót a Cdh1-APC kritikus szubsztrátjaként határozták meg az idegsejtekben [88], és olyan útvonalon működnek, amelyet a növekedési faktor β-Smad2 jelátvitel átalakítása szabályoz [89]. A Smad2 leütése felülírja az axon növekedésének mielin gátlását is [89]. Újabban kimutatták, hogy egy lebomlásnak rezisztens mutáns SnoN expresszió fokozza az axonális regenerációt patkányok gerincvelői sérülését követően [90]. Ezek a megállapítások együttesen felvetik azt az izgalmas kilátást, hogy a fejlődés során működő utak a sérülés után axonális regenerációt is vezethetnek. Ezen utak reaktiválását célzó terápiás stratégiák a sérült központi idegrendszeri idegsejtekben sikeresek lehetnek a képességünk fokozásában az idegsejtek regenerálódására a sérülés vagy betegség hatására.
Oldalsáv A. Válaszokra van szükség
Hogyan modulálja az axonális transzportot a sérülés? Pontosabban, melyek a PNS sérülés utáni megnövekedett axon transzport hátterében álló mechanizmusok? Befolyásolják-e a molekulamotorokat, vagy megváltoznak-e a transzláció utáni mikrotubulus-módosítások?
Milyen különbségek vannak a sérülés által kiváltott jelátvitelben, amelyek lehetővé teszik a DRG neuronok perifériás ágának sérülése esetén az erős regenerációs választ, míg a központi ág elváltozása nem váltja ki ezt a választ?
Van-e oksági összefüggés az axonregeneráció és a mikrotubulusok dinamikája között?
Újraszámolódnak-e a fejlődési utak a sérülést követő axonális regeneráció során?
Köszönetnyilvánítás
Elnézést kérünk minden olyan kollégától, akinek munkáját helyszűke miatt nem lehetett idézni. Köszönetet mondunk Dr. Valeria Cavallinak (Washington Egyetem Orvostudományi Kar) a kézirat kritikus olvasatáért. A szerzőket a FEDER támogatta a COMPETE-n keresztül és az FCT (FCOMP-01-0124-FEDER-017455; HMSP-ICT/0020/2010 - M.M.S. és A.B. projekt). M.M.S. támogatja az FCOMP-01-0124-FEDER-015781; PTDC/SAU-GMG/111761/2009, valamint a Paraplegia Kutatásának Nemzetközi Alapítványa. A.B. az NIH NS051255 támogatása is támogatja.
Szójegyzék
| AKT | protein-kináz B |
| APC | anafázist elősegítő komplex |
| Arg1 | argináz 1 |
| ATF3 | a 3. transzkripciós faktor aktiválása |
| tábor | ciklikus adenozin-monofoszfát |
| CNS | központi idegrendszer |
| CREB | cAMP válasz elemkötő fehérje |
| DLK | kettős leucin cipzár kináz |
| DRG | háti gyökér ganglionjai |
| EFA-6 | árfolyamtényező Arf6-ra |
| Elk-1 | ETS doméntartalmú fehérje |
| ERK | extracelluláris szignál által szabályozott kináz |
| GAP-43 | növekedéshez kapcsolódó fehérje-43 |
| GSK3 | glikogénszintáz kináz 3 |
| HDAC | hiszton-dezacetiláz |
| IL-6 | interleukin-6 |
| JAK | janus kinase |
| JNK | c-június amino-terminális kináz |
| KIF3C | kinezin családtag 3C |
| KLP-7 | kinezinszerű fehérje 7 |
| MAP1B | mikrotubulusokkal társult 1B fehérje |
| TÉRKÉP | mitogén-aktivált protein-kináz |
| mTOR | a rapamicin emlős célpontja |
| NLS | nukleáris lokalizációs jel |
| NPY | Y neuropeptid |
| PI3K | foszfatidil-inozitol-3-kináz |
| PKA | protein-kináz A |
| PKC | protein-kináz C |
| PNS | perifériás idegrendszer |
| PTEN | foszfatáz és tenzin homológ |
| RONGY | regenerációval társult gén |
| RanBP1 | Ras-rokon nukleáris fehérjét kötő fehérje 1 |
| RGC | retina ganglion sejt |
| SC | az axonális szállítás lassú komponense |
| SOCS3 | a citokin szignál szuppresszora 3 |
| Sox11 | SRY-vel kapcsolatos HMG-doboz 11 |
| STAT3 | jelátalakító és a 3. transzkripció aktivátora |
| TSC2 | gumós szklerózis komplex 2 |
| UTR | lefordítatlan régió |
| VIP | vazointesztinális peptid |
| ZBP1 | irányítószám-kötő fehérje 1 |
Összeférhetetlenség
A szerzők kijelentik, hogy nincsenek összeférhetetlenségük.
- A fogamzásgátló tabletták híznak-e
- Kutyaepilepszia - fenobarbitál használata a görcsrohamok kezelésére kutyáknál
- Fit Body Weight Control Kis fajta száraz kutyaeledel - Eukanuba
- Végezzen szénhidrátokat a testzsír ellen
- Irányítsd téli étvágyadat