Az elhízás terhe a jelenlegi világban és az elérhető új kezelések: a 3,0 mg liraglutidra kell összpontosítani
Absztrakt
Háttér
Az elhízás nem csupán a rossz életmódválasztás következménye, hanem összetett, poligénes, multifaktoriális, krónikus és a kezelés számos formájának ellenálló betegség. Az elhízás hajlamosítja a szív- és érrendszeri betegségek (CVD), a 2-es típusú diabetes mellitus (T2D), a magas vérnyomás és számos más betegség kialakulását [1].
Az 1980 és 2014 közötti időszakban az elhízás világszerte több mint kétszeresére nőtt. Az Egészségügyi Világszervezet (WHO) adatai szerint több mint 1,9 milliárd 18 éven felüli felnőtt volt túlsúlyos (a férfiak 38% -a és a nők 40% -a), ebből 600 millió felett elhízott (a férfiak 11% -a és a nők 15% -a) Negyvenkétmillió, 5 év alatti gyermek volt túlsúlyos vagy elhízott 2013-ban. A feltörekvő országokban a gyermekkori túlsúly és az elhízás növekedése több mint 30% -kal haladta meg a fejlett országokét [2]. Például Brazíliában a férfiak 16,8% -a és a nők 24,4% -a volt elhízott, míg a felnőtt lakosság 56% -a volt túlsúlyos 2013-ban [3].
A testtömeg-index (BMI) egy kísérlet a szöveti tömeg (izom, zsír és csont) egyedileg történő számszerűsítésére, és a BMI-kategóriákat a következőképpen határozzák meg: sovány 18,5 alatt, normál súly 18,5–24,9, túlsúlyos 25–29,9 és 30 kg/m 2 feletti elhízás [2]. A WHO szerint a normál testsúlyú kelet-ázsiaiak BMI-je 18,5–23, túlsúlyos 23–27,4 és elhízott 27,5 kg/m 2 felett [4]. A BMI-nek jelentős korlátai vannak, mivel nem mindig mutat más krónikus, súlyhoz kapcsolódó állapotok kockázatát [5]. Sharma és mtsai. javaslatot tettek egy egyszerű klinikai és funkcionális stádiumrendszerre, nevezetesen az Edmonton Obesity Staging Systemre (EOSS). Más antropometriai besorolással együtt alkalmazva az EOSS pontosabb mérést nyújt az elhízással kapcsolatos egészségügyi kockázatokról, mivel a klinikai gyakorlatban a döntéshozatal megkönnyítésére társbetegségek jelenlétét is magában foglalja [6], ami fontos, mivel a metabolikusan egészséges elhízottak az elhízott emberek körülbelül 20% -a [7].
Az Egyesült Államokban az elhízás megnövekedett előfordulása 2006-ig csaknem 40 milliárd dollár megnövekedett orvosi kiadást eredményez, beleértve a Medicare vényköteles gyógyszerek költségeit 7 milliárd dollár. Finkelstein és mtsai. kimutatták, hogy a túlsúly milyen mértékben növelte az éves orvosi kiadásokat: a túlsúly és az elhízás költségei 1998-ban akár 78,5 milliárd, 2008-ban pedig 147 milliárd dollárra rúghattak [8]. A 2000 és 2005 közötti adatok alapján Cawley és Meyerhoefer becslései szerint az elhízással összefüggő betegségek Egyesült Államok egészségügyi költségei 209,7 milliárd dollár, ami a nemzeti egészségügyi kiadások 20,6% -ának felel meg [9].
Az elhízás kialakulásához vezető tényezőket alaposan tanulmányozták az elmúlt években. Az étvágy központi szabályozása, különös tekintettel a hedonikus étvágyra, nagyon izgalmas terület. A közelmúltban új gyógyszereket hagytak jóvá az elhízás kezelésére az Egyesült Államokban: liraglutid, fentermin/topiramát, naltrexon/bupropion és lorcaserin.
A liraglutid egy glükagonszerű peptid 1 (GLP-1) receptor agonista, amely 97% -ban homológiát mutat a natív GLP-1-gyel, meghosszabbítva a GLP-1 keringési felezési idejét 1-től 2 percig-13 óráig. A liraglutidot Európában először 2009-ben engedélyezték a T2D kezelésére [10]. Az új elhízás elleni gyógyszerek közül a liraglutidot tanulmányozzák a legjobban, különös tekintettel a limbikus rendszerre gyakorolt hatásokon keresztüli fontos hatásaira [11].
Ez a felülvizsgálat foglalkozik az étvágy központi szabályozásával kapcsolatos főbb megállapításokkal és az új elhízás elleni gyógyszerekkel végzett főbb vizsgálatokkal, nagyobb hangsúlyt fektetve a 3,0 mg liraglutidra.
Az elhízás kórélettana
Az elhízáshoz vezető olyan ismert tényezők mellett, mint például az energiafogyasztás növekedése a magas energiasűrűségű feldolgozott élelmiszerek bevitele és a fizikai aktivitás csökkentése mellett, számos különböző tényezőt kell figyelembe venni. Az elhízás feltételezhető közreműködői közé tartozik a bél mikrobiota, az endokrin rendellenességek, az epigenetika, az anya életkorának növekedése, a nagyobb zsírosodású emberek nagyobb termékenysége, az asszortatív párosodás, az alvási adósság, a gyógyszerészeti iatrogenezis, a környezeti hőmérséklet változékonyságának csökkenése, valamint az intrauterin és generációközi hatások [12 ]. Az emberi zsírosságot és a súlygyarapodás iránti hajlamot több gén befolyásolja, és a testzsír öröklődésének legvalószínűbb becslése az embereknél körülbelül 25-75% között mozog [13]. Az emberi elhízás előidézéséhez önmagában elegendő génmutációk rendkívül ritkák. Csaknem 176 emberi elhízásról számoltak be több mint tíz különböző gén mutációi miatt. Figyelemre méltó, hogy ezeknek a mutációknak szinte mindegyike a hipotalamusz leptin/melanocortin útjában van megkötve, ami kritikus fontosságú az egész test energia homeosztázisának kiigazításában [14].
A gyakori elhízás vagy a poligénes elhízás tanulmányozását összekapcsolódási vizsgálatok, a génjelölt asszociációs tanulmányai és a genom egészére kiterjedő asszociációs vizsgálatok (GWAS) segítségével próbálják megtalálni az összefüggéseket a genetikai variációk és az elhízással kapcsolatos tulajdonságok között. Eddig a GWAS csaknem 100 lokuszt azonosított az elhízással kapcsolatos tulajdonságokkal, ezek közül a legrelevánsabb az FTO génben található rs9939609 polimorfizmus [15, 16].
A túlzott táplálékfogyasztás korlátozásának képtelensége valószínűleg kulcsfontosságú folyamat, amely hozzájárul a kontrollálatlan súlygyarapodáshoz, főleg azért, mert úgy tűnik, hogy kielégítőbb egy kellemesebb energikus és obesogén típusú ételt fogyasztani. A magas hedonikus érték és a csábító ételek okozzák a túlevést vagy az étkezést a közvetlen anyagcsere-szükségleten túl (étel-jutalom viselkedés) [17]. Az energiafogyasztás és a ráfordítás közötti kapcsolatot nemcsak a környezeti és viselkedési tényezők, hanem a genetikai meghatározók és a neuroendokrin visszacsatolási mechanizmusok is modulálják. Ezeket a mechanizmusokat a hipotalamus szabályozza, a testtömeg homeosztatikus szabályozásának központi helye. A hipotalamusz integrálja a gyomor-bél traktus perifériás hormonális szignáljait [ghrelin, kolecisztokinin, YY peptid, hasnyálmirigy-polipeptid (PP), GLP-1], hasnyálmirigy (inzulin) és zsírszövet (leptin), amelyek módosítják a központi orexigén [pl. neuropeptid Y (NPY)], agouti-rokon peptid (AgRP) és anorexigén [pl. alfa-melanocita stimuláló hormon (α-MSH), egy proopiomelanocortin (POMC) -eredetű peptid], kokain- és amfetamin-szabályozott transzkriptum [CART]) neuropeptidek [18].
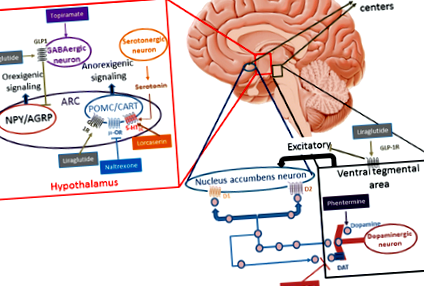
Állatkísérletek során a GLP-1 közvetlenül stimulálja a POMC/CART idegsejteket, és közvetett módon gátolja a neurotranszmissziót az NPY-t és az AgRP-t expresszáló neuronokban gamma-amino-vajsav (GABA) -függő jelzés útján [19,20,21]. Ezek a megállapítások azt jelzik, hogy a POMC/CART-expresszáló íves (ARC) neuronokon található GLP-1 receptorok (GLP-1R) valószínűleg közvetítik a liraglutid által kiváltott fogyást (1. ábra). A súlycsökkenést csökkenti a GLP-1R helyi blokkolása az ARC neuronokon a GLP-1R antagonistájával [22]. Bár állatmodellekben jól dokumentálták, a liraglutid hatása az emberi hipotalamuszban nehezebben bizonyítható. Emberekben végzett funkcionális mágneses rezonancia képalkotással (fMRI) végzett vizsgálatok nem azonosították a neuronális aktivitás módosulását a liraglutid alkalmazásával; a jel hiánya a hipotalamusz kis méretének és az orrmelléküregekhez való közvetlenségének tudható be [23, 24].
(Kim és mtsai., Baggio és mtsai. És Wang és mtsai. [19,20,21] adaptációja)
Az elhízás elleni gyógyszerek hatásmechanizmusa. 5-HT2C-R: 5-hidroxi-triptamin (szerotonin) 2C receptor; ÍV íves mag, KOSÁR kokain és amfetamin által szabályozott átirat, D1 dopamin receptor D1, D2 dopamin receptor D2, DAT dopamin transzporter, GABA gamma-amino-vajsav, GLP-1R glukagonszerű peptid-1 receptto, NPY/AgRP az Y neuropeptidet és az agouti-rokon peptidet expresszáló neuronok, POMC proopiomelanokortin, μ-OR μ-opioid receptor
A hedonikus étvágyszabályozást olyan limbikus régiókban hajtják végre, mint a hippocampus, az amygdala, a nucleus accumbens, a ventrális tegmentális terület, a cingulate gyrus, az orbitofrontalis kéreg, az insula és a prefrontális kéreg. Ezek a területek részt vesznek a feltételes válasz és jutalom kialakításában. Habár az ebben a hálózatban szerepet játszó klasszikus neurotranszmitterek a dopamin, a szerotonin és a GABA, számos állatkísérlet hangsúlyozza a GLP-1 hozzájárulását a rendszerben [25, 26]. Hsu és mtsai. értékelte azoknak a patkányoknak az étkezési viselkedését, amelyek exedin-4-et kaptak a hippocampus képződésének hasi részében. A teljes energiafogyasztás és a tömeg csökkentése mellett a zsírbevitel jelentős csökkenését és a szokásos takarmányfogyasztás növekedését figyelték meg, amikor megengedték maguknak, hogy melyik ételt fogyasszák. Ez a megállapítás rávilágít a GLP-1 fontosságára az agyi régiókban, amelyek részt vesznek a tanult és motivációs viselkedés ellenőrzésében az élelmiszer-fogyasztásban [26].
Farr és munkatársai. immunhisztokémiai analízissel azonosították a GLP-1R jelenlétét az emberi agy hipotalamusz magjában, medulla oblongatájában, a területi postrémában és a parietalis kéregben [23]. Az alsó parietális kéreg a figyelemhálózat része, amelyet fontos vagy nagyon kívánatos ingerek aktiválhatnak, például ízletes étel. A liraglutidot szedő emberek az fMRI-ben a parietális kéreg aktivációjának csökkenését mutatták ki a kívánatosabb ételekre reagálva. Ez a nagy energiájú ételre adott parietális aktiváció fordított összefüggésben van a fogyással. A legkevésbé alacsonyabb parietális aktivációval rendelkező betegek beszámoltak arról, hogy kevésbé lenne kellemes enni liraglutid mellett, éhgyomorra. Ugyanebben a tanulmányban arról számoltak be, hogy az insula és a putamen aktivációjának csökkenése tapasztalható azoknál a betegeknél, akik liraglutidot szedtek, amikor ízletes ételjeleknek voltak kitéve. Az inzula részt vesz az ételek feldolgozásában és az ájtatosságban, viszont úgy tűnik, hogy a putamen hozzájárul az ételjutalom feldolgozásához [23]. Egy korábbi vizsgálat az exenatiddal, egy másik GLP-1 receptor agonistával (amely az exendin-4-ből származik) szintén alacsonyabb reakciót mutatott az ízletes ételképekre az insula, az amygdala, a putamen és az orbitofrontalis kéregben [27].
Egy másik, az fMRI-t alkalmazó tanulmány meghatározta az endogén GLP-1 (GLP-1 antagonistát használó) és a liraglutid hatását a sovány egészséges egyének, valamint a T2D-betegek központi idegrendszeri (CNS) aktiválására. Kimutatták, hogy az endogén GLP-1 befolyásolja az ízletes ételfogyasztás központi reakciókészségét. Egészséges sovány alanyokhoz képest a T2D-betegek csökkent csokoládétejjel aktiválták a jobb oldali inzulát. Elhízott T2D-s betegeknél a liraglutid javította az ízletes ételre adott válaszként megfigyelt hiányt, ami hozzájárulhat a liraglutiddal megfigyelt súlycsökkenéshez [28].
Az elhízás vizsgálatában nemrégiben figyelembe vett szempont a fogyáshoz való hormonális alkalmazkodás. Sumithran és mtsai. 50 túlsúlyos vagy elhízott nem cukorbeteg beteget vont be egy 10 hetes súlycsökkentő programba, amely nagyon alacsony energiatartalmú étrendből állt. A 10 hét végén, átlagosan 13,5 ± 0,5 kg súlycsökkenés után jelentősen csökkentek az anorektikus peptidek, a leptin, az YY peptid, a kolecisztokinin, az inzulin és az amilin koncentrációja. A ghrelin, a glükózfüggő inzulinotróp polipeptid (GIP) és a PP koncentrációja szintén növekedett. Egy évvel a kezdeti súlycsökkenés után még mindig jelentős különbségek mutatkoztak ezen peptidek átlagos koncentrációiban az alapszinthez képest; A GLP-1 szintje szintén alacsonyabb volt, mint a kiindulási érték. A szerzők arra a következtetésre jutottak, hogy az étvágy keringő mediátoraiban a súly visszanyerésére ösztönző módosítások egy év fogyás után is fennmaradnak. Kiemelik a változás ellensúlyozására irányuló stratégiák fontosságát az elhízás visszaesésének megakadályozása érdekében, különben a hosszú távú eredmények továbbra sem lesznek kielégítőek [29].
Az elhízás kezelése
Az elhízás nem gyógyszeres kezelése hatékony lehet, de a hosszú távú sikerességi arány alacsony, és a lefogyott súly visszanyerése nagy problémát jelent. Véletlenszerű vizsgálatok kimutatták, hogy a más stratégiákkal (pl. Folyékony tápszerű étrend vagy anorektikus gyógyszerek) társuló életmódváltásokkal elért nagyobb kezdeti súlycsökkenés javítja a hosszú távú testsúly fenntartást, feltéve, hogy ezt 1-2 év integrált súlymegőrzés követi. program, amely életmódbeli beavatkozásokból áll, beleértve az étrend megváltoztatását, táplálkozási nevelést, viselkedésterápiát és fokozott fizikai aktivitást. Ezért egy nagyobb kezdeti súlycsökkenés a farmakológiai beavatkozás első lépéseként javított tartós testsúly-fenntartást eredményezhet [30].
Wing és mtsai. kimutatta, hogy az 1 éves súlycsökkenés nagysága szorosan összefügg a vérnyomás (BP), valamint az éhomi éhgyomri, triglicerid és HDL koleszterinszint javulásával, de nem az LDL koleszterinszinttel. A súlystabil résztvevőkhöz képest azokat, akik 5–2-t vesztettek), a következő liraglutid dózisokhoz rendelték: 1,2, 1,8, 2,4 és 3,0 mg (n = 90–95) vagy a placebót (n = 98) naponta egyszer ( QD) szubkután vagy orlistatra (120 mg; n = 95) naponta háromszor orálisan. Ezenkívül a résztvevők napi 500 kcal energiahiányos étrendet tartottak, és fokozták fizikai aktivitásukat. A súlyváltozást a kezelés szándékával (ITT) elemezték, és ez volt az elsődleges végpont. Egy 84 hetes nyílt meghosszabbítás következett. Amint a 2. ábra mutatja, a liraglutid súlycsökkenést váltott ki, amely lényegesen nagyobb volt, mint a placebóé (P = 0,003 1,2 mg liraglutid esetében és P 2. ábra
Adaptálva Astrup et al. [35]
A testtömeg változása az elhízott egyének négy liraglutid-dózissal (1,2, 1,8, 2,4 vagy 3,0 mg), vagy naponta egyszer szubkután, vagy orlisztáttal (120 mg) szájon át alkalmazott placebó után. Az adatok átlagos (95% CI) az ITT populációra vonatkozóan az utolsó megfigyeléssel (LOCF)
- A világ éhsége három év után sem csökken, és az elhízás továbbra is növekszik - az ENSZ jelentése
- World Live Obesity - COVID-19 és Obesity Webinar Series Obesity World Federation
- Bad Ragaz legnépszerűbb klinikája az elhízás legjobb kezeléseivel
- Az elhízás terhe a reproduktív korú nőknél és a terhesség közepes jövedelmű környezetben
- Az elhízás világszövetsége az elhízást krónikusan kiújuló progresszív betegségként ismeri el