Az emberi IL-37 szelektív hematopoietikus expressziójának hatása a szisztémás gyulladásra és az ateroszklerózisra LDLr-hiányos egerekben
Geerte Hoeke
1 Orvostudományi Osztály, Endokrinológiai Osztály, Leideni Egyetem Orvosi Központ, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Kísérleti Érgyógyászat Einthoven Laboratóriuma, P.O. Box 9600, 2300 RC Leiden, Hollandia
P. Padmini S.J. Khedoe
1 Orvostudományi Osztály, Endokrinológiai Osztály, Leideni Egyetem Orvosi Központ, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Kísérleti Érgyógyászat Einthoven Laboratóriuma, P.O. Box 9600, 2300 RC Leiden, Hollandia
3 Leideni Egyetem Orvosi Központ Pulmonológiai Osztálya, Leiden P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected]
Janna A. van Diepen
4 Általános Belgyógyászati Klinika és Radboud Fertőző Betegségek Központja, Radboud Egyetem Nijmegeni Orvosi Központ, 6525 HP Nijmegen, Hollandia; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
Karin Pike-Overzet
5 Immunohematológiai és Vértranszfúziós Osztály, Leideni Egyetem Orvosi Központ, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (K.P.-O.); [email protected] (F.J.T.S.)
Britt van de Ven
1 Orvostudományi Osztály, Endokrinológiai Osztály, Leideni Egyetem Orvosi Központ, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
Nadia Vazirpanah
1 Orvostudományi Osztály, Endokrinológiai Osztály, Leideni Egyetem Orvosi Központ, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
Isabel Mol
1 Orvostudományi Osztály, Endokrinológiai Osztály, Leideni Egyetem Orvosi Központ, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Kísérleti Érgyógyászat Einthoven Laboratóriuma, P.O. Box 9600, 2300 RC Leiden, Hollandia
Pieter S. Hiemstra
3 Leideni Egyetem Orvosi Központ Pulmonológiai Osztálya, Leiden P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected]
Frank J.T. Staal
5 Immunohematológiai és Vértranszfúziós Osztály, Leideni Egyetem Orvosi Központja, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (K.P.-O.); [email protected] (F.J.T.S.)
Rinke Stienstra
4 Általános Belgyógyászati Klinika és Radboud Fertőző Betegségek Központja, Radboud Egyetem Nijmegeni Orvosi Központ, 6525 HP Nijmegen, Hollandia; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
Az emberi táplálkozás osztálya, Wageningen Egyetem, 6708 PB Wageningen, Hollandia
Mihai G. Netea
4 Általános Belgyógyászati Klinika és Radboud Fertőző Betegségek Központja, Radboud Egyetem Nijmegeni Orvosi Központ, 6525 HP Nijmegen, Hollandia; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
7 Genomikai és immunregulációs tanszék, Élettani és Orvostudományi Intézet (LIMES), Bonni Egyetem, 53113 Bonn, Németország
Charles A. Dinarello
4 Általános Belgyógyászati Klinika és Radboud Fertőző Betegségek Központja, Radboud Egyetem Nijmegeni Orvosi Központ, 6525 HP Nijmegen, Hollandia; [email protected] (J.A.v.D.); [email protected] (R.S.); [email protected] (M.G.N.); moc.loa@333eranidc (C.A.D.)
8 Orvosi Tanszék, Colorado Egyetem, Aurora, CO 80045, USA
Patrick C.N. Rensen
1 Orvostudományi Osztály, Endokrinológiai Osztály, Leideni Egyetem Orvosi Központ, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Kísérleti Érgyógyászat Einthoven Laboratóriuma, P.O. Box 9600, 2300 RC Leiden, Hollandia
Jimmy F.P. Berbée
1 Orvostudományi Osztály, Endokrinológiai Osztály, Leideni Egyetem Orvosi Központ, Post Zone C7Q, P.O. Box 9600, 2300 RC Leiden, Hollandia; [email protected] (G.H.); [email protected] (P.P.S.J.K.); moc.liamg@nevednavttirb (B.v.d.V.); [email protected] (N.V.); [email protected] (I.M.); [email protected] (P.C.N.R.)
2 Kísérleti Érgyógyászat Einthoven Laboratóriuma, P.O. Box 9600, 2300 RC Leiden, Hollandia
Absztrakt
1. Bemutatkozás
Az ateroszklerózis krónikus gyulladásos állapot, amelyet a különböző immunsejtek fokozatos felhalmozódása jellemez az artériás falon [1]. A makrofágok nagyon fontos szereplők az érelmeszesedés kialakulásában. A lipidek felhalmozódása mellett ismert, hogy nagy plaszticitással rendelkeznek a funkcióban, az anti-gyulladásos fenotípusoktól kezdve, az atherosclerotikus plakkban található specifikus ingerektől függően [2]. Kiterjedt kutatás a pro-atherogén citokinek és receptorok jellemzésére összpontosított, amelyek elősegítik az érelmeszesedéses elváltozás progresszióját (áttekintés [1] -ben). Mindazonáltal csak korlátozott számú tanulmány vizsgálta a gyulladáscsökkentő citokinek ateroprotektív hatását és terápiás potenciálját immunszuppresszív mediátorként az érelmeszesedés kialakulása során [3]. Eddig a gyulladáscsökkentő mediátorok interleukin (IL) -10 [4], transzformáló növekedési faktor (TFG) -β [5], IL-33 [6] és IL-1 receptor antagonista (IL-1ra) [7] kimutatták, hogy markáns antiateroszklerotikus és atheroprotektív aktivitást fejtenek ki egerekben.
Az IL-37 gyulladáscsökkentő citokin, korábban IL-1 családtagként (IL-1F7), a veleszületett gyulladásos és immunválasz endogén szuppresszoraként jelent meg [8]. Az IL-37 az IL-1 családhoz tartozik, amely magában foglalja például az IL-1a IL-1β, IL-1ra, IL-18 és IL-33 csoportokat is. Emberben különféle szövetek és sejttípusok, beleértve a vér monocitákat [9], az endothel sejteket [10], az adipocitákat [11] és a hámsejteket [12], expresszálják az IL-37-et. Az egér homológját azonban még nem fedezték fel. Az IL-37 mRNS transzkriptum olyan instabilitási komponenst tartalmaz, amely stabilizálódik a sejtek gyulladásos ingereknek való kitettségénél [13], ami az IL-37 fehérje expressziós szintjének növekedését idézi elő, reagálva pl. α [8]. Az IL-37 képessége a gyulladás elnyomására nyilvánvaló azokból az in vitro kísérletekből, amelyekben az IL-37 indukció jelentősen csökkentette a pro-gyulladásos citokinek és kemokinek expresszióját monocita és makrofág sejtvonalakban [8,14].
Az IL-37 öt izoformából áll (azaz IL-37a – e), amelyek közül az IL-37b a legelterjedtebb [9]. A humán IL-37b (IL-37tg) transzgénikus expresszióját mutató egereket megvédtük a lipopoliszacharid (LPS) által kiváltott szeptikus sokktól, és csökkent LPS-re [8] és konkanavalin A-indukált hepatitisre adott válaszként csökkent szöveti és szisztémás gyulladásos citokinek szintje volt [15]. ]. Ezenkívül az IL-37tg egereket megvédték a dextrán-nátrium-szulfát (DSS) által kiváltott vastagbélgyulladástól, amit a leukociták, köztük a makrofágok erősen csökkent gyulladása és vastagbélbe való beszűrődése jelez. Érdekes módon az IL-37tg egerek csontvelőjével helyreállított vad típusú (WT) egereket is megvédték a DSS által kiváltott vastagbélgyulladásoktól, ami azt jelzi, hogy a hematopoietikus IL-37 expresszió elegendő ehhez a védőhatáshoz [16].
Ezek az adatok arra utalnak, hogy a hematopoietikus sejtekben az IL-37 expressziója csökkentheti a sejtek helyi beáramlását és a gyulladásgátló citokinek szekrécióját gyulladásos betegségekben, beleértve az érelmeszesedést is. Ezt támasztja alá egy nemrégiben végzett tanulmány, amelyben a szisztémás IL-37-kezelés az immunsejt-válaszok modulálásával védett az érelmeszesedéstől [17]. Ezért a jelen vizsgálat célja annak értékelése volt, hogy a vérképző sejtekben az IL-37 transzgénikus expressziója gátolja-e a makrofágok felhalmozódását a plakkban, és elegendő-e az érelmeszesedés előrehaladásával szembeni védelemhez. A WT vagy IL-37tg egerekből csontvelőt ültettünk át LDL-receptor-hiányos (Ldlr⁻/⁻) egerekbe, és értékeltük a metabolikus és gyulladásos paramétereket, valamint az érelmeszesedéses elváltozás méretét és összetételét. Az egereket 1% koleszterint tartalmazó Western típusú étrenddel (WTD) etették, hogy hiperlipidémiát és alacsony fokú szisztémás gyulladást idézzenek elő. Kimutattuk, hogy az IL-37 hematopoietikus expressziója mérsékelten csökkentette a hiperlipidémiás Ldlr⁻/⁻ egerek gyulladásos állapotát, de az érelmeszesedés nagysága vagy a plakk makrofágtartalma változatlan maradt.
2. Eredmények
2.1. A hematopoietikus IL-37 expresszió nem befolyásolja az anyagcsere paramétereit
A humán IL-37 szelektíven expresszálódott az ateroszklerózisra hajlamos Ldlrl/⁻ egerek vérképző sejtjeiben, beleértve a makrofágokat is IL-37tg egerek csontvelősejtjeinek átültetésével. Kontrollként Ldlr⁻/⁻ egereket transzplantáltunk WT egerek csontvelőjével. A rendszeres chow-étrenden végzett kilenc hetes gyógyulási időszak után a hiperlipidémiát úgy indukálták, hogy az egereket nyolc hétig magas koleszterinszintű (1% koleszterint tartalmazó) Western-típusú diétával (WTD) dúsították (1% koleszterint tartalmazó). IL-37tg csontvelő sejtekkel átültetett Ldlr⁻/⁻ egerek csontvelője a vizsgálat végén humán IL-37 mRNS-t expresszált, míg a WT-transzplantált egereknél nem volt kimutatható (az adatokat nem közöljük), ami megerősíti a sikeres hematopoietikus helyreállítást.
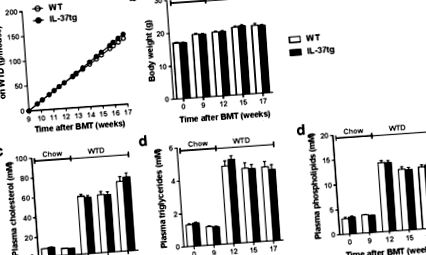
A vizsgálat során felmértük a hematopoietikus IL-37 expressziójának metabolikus paraméterekre gyakorolt hatását. A hematopoietikus IL-37 expresszió nem befolyásolta a kumulatív táplálékfelvételt a gyógyulási periódusban (nem látható) vagy a WTD-etetés során (1.a ábra). A testtömeg sem különbözött a csoportok között (1. b ábra). Továbbá a hematopoietikus IL-37 expresszió a vizsgálat során nem befolyásolta a plazma teljes koleszterinszintjét (1. c ábra), a plazma triglicerid (1. d ábra) vagy a plazma foszfolipid (1. e ábra) koncentrációját.
Az emberi IL-37 sikeres expressziója vérképző sejtekben nem befolyásolja az anyagcsere paramétereit. Az Ldlr⁻/⁻ egereket IL-37tg vagy kontroll vad típusú (WT) egerek csontvelőjével ültettük át. Kilenc hét gyógyulás után a rendszeres chow-étrenden az egereket nyolc hétig nyugati típusú étrenddel (WTD) etették. Halmozott táplálékfelvétel (a) testsúly (b) és 4 órás éheztetett plazma koleszterinszint (c) trigliceridek (d) és foszfolipidek (e) vizsgálatát a vizsgálat során követtük. Az adatokat átlagként ± az átlag standard hibájaként (SEM) fejezzük ki; n = 14–15 csoportonként. BMT, csontvelő transzplantáció.
2.2. A vérképző IL-37 expresszió mérsékelten csökkenti a gyulladásos állapotot
Ezután értékeltük a hematopoietikus IL-37 expresszió hatását a gyulladásos paraméterekre. A WTD-táplálás megnövelte a plazma sE-szelektin szintjét a chow-etetéshez képest, ezzel megerősítve a WTD által alacsony fokú gyulladás indukcióját, de a hematopoietikus IL-37 expresszió nem csökkentette a plazma sE-szelektint (2. a ábra). A vérsejtek áramlási citometriája azonban azt mutatta, hogy a hematopoietikus IL-37 expresszió csökkentette a keringő immunsejtek számát, ami a redukált keringő granulocitákból (2. b ábra), neutrofilekből (2. ábra c) és eozinofilekből (2. ábra d) látható) a WTD alatt. táplálás. Ezenkívül a teljes T-limfociták csökkentek a chow- és WTD-etetés során (2. e ábra), a citotoxikus T-sejtek pedig szignifikánsan csökkentek a chow-etetés során (2. f ábra). Ezzel szemben az IL-37 expressziója nem befolyásolta a segítő T-sejteket (2. g ábra) és a szabályozó T-sejteket (2. ábra h). Bár a hematopoietikus IL-37 expresszió nem befolyásolta az összes keringő monocita (2. ábra i) vagy a Ly6C lo monociták százalékos arányát (2. ábra j), az IL-37 expresszió csökkentette az újonnan felvett Ly6C hi monociták számát (2. k ábra). A Ly6C lo és a Ly6C hi monociták aránya nem nőtt szignifikánsan (2. I. ábra). Ezek az adatok együttvéve csökkent gyulladásos állapotot jeleznek a hematopoietikus IL-37 expresszióval.
2.3. A hematopoietikus IL-37 expresszió nem befolyásolja az ateroszklerózis kialakulását
Végül felmértük, hogy a hematopoietikus IL-37 expresszió csökkent gyulladásos állapota gyengíti-e az érelmeszesedés kialakulását. Ennek érdekében meghatároztuk az ateroszklerotikus elváltozás területét a szív aortagyökér szelepes területén, valamint az érelmeszesedéses elváltozás összetételét nyolc hét WTD-táplálás után. Noha az érelmeszesedéses elváltozás területe a szív aorta gyökérzetében nem változott (4. a – c. Ábra), az IL-37 expresszió csökkentette az érelmeszesedéses elváltozások simaizomsejt-tartalmát (4. ábra d, g). A kollagéntartalom (4. e, h ábra) és a makrofág-tartalom (4. f, i. Ábra) mindkét csoportban változatlan maradt. Ezek az eredmények együttesen azt jelzik, hogy a hematopoietikus IL-37 expresszió marginálisan befolyásolja az elváltozás összetételét, anélkül, hogy erősen befolyásolná az érelmeszesedés méretét.
Annak ellenére, hogy csillapította az egerek gyulladásos állapotát, a hematopoietikus IL-37 expresszió a jelen vizsgálatban sem az ateroszklerotikus elváltozás méretét, sem az elváltozások makrofágtartalmát nem csökkentette. Ez látszólag ellentétes más közelmúltbeli tanulmányokkal, ahol a rekombináns IL-37-gyel végzett kezelés csökkentette az érelmeszesedés kialakulását a streptozotocin által kiváltott diabéteszes apolipoprotein E-hiányos (Apoe -/-) egerekben [25], és megvédte a WT egereket az endotoxemia által kiváltott szívműködési zavaroktól [ 26] és a károsodás okozta szívizom ischaemia/reperfúziós sérülés a gyulladásos állapot csökkenése révén [27]. Két ok magyarázhatja a hematopoietikus IL-37 hatásának hiányát az érelmeszesedés kialakulásában.
4. Anyagok és módszerek
4.1. Állatok
4.2. A csontvelő sikeres helyreállításának értékelése
A vizsgálat végén a csontvelőt izoláltuk a sípcsontból, és a hematológiai kimérizmust genomi DNS alkalmazásával határoztuk meg polimeráz láncreakcióval (PCR) a BMT után 17 héttel, amelyet a Gentra Pure Blood Kit (Qiagen, Venlo, The Hollandia). Az IL-37 relatív jelenlétét a csontvelőben humán IL-37 primerek alkalmazásával értékeltük (előre: 5′-CGATTCTCCTGGGGGTCTCTA-3 '; fordított: 5′-CGGCGTGCTGATTCCTTTTG-3').
4.3. Plazma lipid és szisztémás gyulladás elemzése
4 órán át éheztetett egerek farokvénájából vért vettünk a megjelölt időpontokban. Nyolc hetes WTD után orbitális exsanguinnal etilén-diamin-tetraecetsavval (EDTA) bevont csövekben gyűjtöttünk ki nem vérképeket. Az összes mintából származó plazmát centrifugálással izoláltuk, és megvizsgáltuk az összkoleszterin, trigliceridek (Roche Diagnostics, Mannheim, Németország) és foszfolipidek (Instruchemie, Delfzijl, Hollandia) kereskedelemben kapható enzimatikus kolorimetriás készletét. Az oldható E-szelektin (sE-szelektin) plazmaszintjét egér E-szelektin ELISA kit segítségével határoztuk meg (R&D, Minneapolis, MN, USA). Minden vizsgálatot a gyártók protokolljainak megfelelően készítettünk el.
4.4. Áramlási citometria
A vért a kezdés előtt („chow”) és a WTD-etetés („WTD”) során gyűjtötték EDTA-val bevont csövekben. A teljes eritrocita lizálása után a T-limfociták, monociták és granulociták részhalmazait standard fluoreszcenciával aktivált sejtválogatási (FACS) analízissel értékeltük. A sejteket fluorokróm konjugált monoklonális antitestekkel festettük CD4 (eBioscience, San Diego, CA, USA), CD8 (Biolegend, San Diego, CA, USA), CD11b, CD25, Ly6G 1A8 klón és Ly6C (mindegyik BD Pharmingen, San Diego) alkalmazásával., Kalifornia, USA). Az intracelluláris FoxP3 festést FoxP3 festési készlet (eBioscience) segítségével végeztük. Az adatokat egy FACSAria vagy egy FACSCanto II (BD Biosciences, San Diego, Kalifornia, USA) állományból gyűjtöttük, és a FlowJo szoftver segítségével elemeztük (Treestar, Ashland, OR, USA). Az adatokat az élő sejtek százalékában adjuk meg.
4.5. A peritoneális makrofágok ex vivo stimulálása
A vizsgálat végén a peritoneális makrofágokat izoláltuk és ex vivo stimuláltuk 10 ng · ml -1 Escherichia coli lipopoliszachariddal (E. coli LPS; O55 szerotípus: B5, Sigma Aldrich, St. Louis, MO, USA), amelyet tovább tisztítottuk a [30] -ben leírtak szerint, vagy sóoldatban tartottuk kontrollként 24 órán át. A keratinocita kemoattraktáns (KC) és az IL-6 koncentrációt a táptalajban kereskedelmi ELISA készletekkel (Biosource, Camarillo, CA, USA) határoztuk meg a gyártó utasításai szerint.
4.6. Gén expressziós elemzés
RNS-t extrahált fagyasztott egér májmintákból (kb. 30 mg) extraháltunk tripure RNS izoláló reagens (Roche) alkalmazásával a gyártó protokollja szerint. Az összes RNS-t (1 μg) reverz átírással írtuk le Moloney egér leukémia vírus (M-MLV) reverz transzkriptáz (Promega) segítségével qRT-PCR-re a gyártó utasításainak megfelelően a cDNS előállításához. Az mRNS expresszióját β2-mikroglobulin mRNS expresszióra normalizáltuk és a WT egerekhez viszonyítva ΔΔCt módszerrel fejeztük ki. Az alkalmazott primer szekvenciákat az alábbi 1. táblázat tartalmazza.
- Milyen hatással van az alacsony zsírtartalmú vegán étrend a hasnyálmirigy működésére túlsúlyos, nem cukorbetegekben
- Milyen hatással van az alacsony fehérjetartalmú étrend krónikus vesebetegségben szenvedő, nem cukorbeteg felnőtteknek
- A joghurt baktériumok túlélése az emberi bélben
- A központi elhízás hatása a gyulladásra, a hepcidin és a vas anyagcseréjére fiatal nőknél
- A náci ikerkísérletek túlélője beszél az orvosokkal az emberi alanyok kutatásáról - ScienceDaily