Az étrendi glikémia, mint az egészség és a hosszú élettartam meghatározó tényezője
Absztrakt
Az étrend szerepe az élettartam és az egészség növelésében sok kutatás és vita tárgyát képezte. Legutóbbi epidemiológiai és in vivo adataink arra utalnak, hogy a szénhidrát minősége meghatározó lehet a szem egészségének meghosszabbításában. Ezenkívül a túlzott szénhidrátfogyasztás hozzájárulhat számos betegség súlyosbodásához. A túlzott szénhidrátbevitel által érintett szövetek metabolikus sokfélesége arra utal, hogy az étrendi szénhidrát minősége befolyásolhatja a sejtek homeosztázisát.
1. A glikémiás index bevezetése és meghatározása
1.1. Bevezetés
1.2. A glikémiás index meghatározása
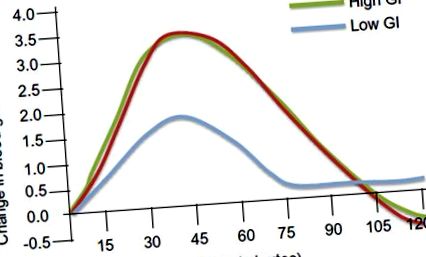
A vércukorszint változásai magas és alacsony glikémiás ételek fogyasztása után. A vércukorszint változását mmol/l-ben ábrázoljuk az idő függvényében percekben.
2. Glikémiás index, betegség és proteopoise
A munka során a proteosztázist proteopoise-nak nevezik, jelezve, hogy a fehérjék, az inzultusok és a sejtmechanizmus között dinamikus, nem pedig statikus kapcsolat van, amelynek fel kell ismernie és szelektíven el kell távolítania a sérült fehérjéket.
2.1. Az életkorral összefüggő makula degeneráció (AMD) kockázata
Laboratóriumunkban végzett munka az életkorral összefüggő szembetegségek kockázata, elsősorban az életkorral összefüggő makula degeneráció (AMD) vagy szürkehályog és a magas GI diéták fogyasztása közötti összefüggésekre összpontosított. Az AMD a visszafordíthatatlan vakság vezető oka az időseknél. Az AMD-nek két típusa van: a „nedves AMD” a retina choroidjának neovaszkularizációjából származik, míg a „száraz AMD” összefüggésben van a drusen megjelenésével, amelyek fehér vagy sárga extracelluláris anyag lerakódások, amelyek felhalmozódnak Bruch membránja és a retina pigment hám (RPE). A száraz AMD a legelterjedtebb típus, amely az összes AMD-eset közel 90% -át képviseli. Míg a nedves AMD-ben a neovaszkularizációt számos kezelés célozza, jelenleg nincs olyan kezelés, amely késleltetné vagy visszafordítaná a száraz AMD-t. Az AMD mindkét típusa a fotoreceptor sejtek halálát és látásvesztést eredményez. A késői stádiumban lévő száraz AMD összefüggésben áll az RPE és a földrajzi atrófiának nevezett fotoreceptorok nagy területeinek elvesztésével.
Epidemiológiai adataink azt mutatják, hogy a magas GI diéták fogyasztása az AMD fokozott prevalenciájával és fokozott progressziójával jár (2. ábra) (Chiu et al., 2006a, 2007a, 2007b); akkor is, ha a diéták ugyanolyan mennyiségű teljes szénhidrátot tartalmaznak. A GI-bevitel legmagasabb kvintilisében lévő személyeknél megnőtt a nagy drusen, a neovascularisatio és a földrajzi atrófia kockázata a legalacsonyabb kvintilishez képest (Chiu et al., 2007a). Más csoportok munkája megerősíti, hogy a magas GI diéták növelik az AMD kockázatát, beleértve a lágy druseneket is (Kaushik et al., 2008). Ezek a tanulmányok azt sugallják, hogy az étrend megváltoztatása csökkentheti az AMD kialakulásának kockázatát és a betegség előrehaladását. Az AMD dohányzással (Smith et al., 2001) és a genetikai variációkkal (Fritsche et al., 2013) kapcsolatos kockázatai hasonló tartományban vannak, mint a magas GI-diéták fogyasztásával járó kockázatok (2. ábra).
Az AMD kialakulásának kockázata. A magas glikémiás indexű diéták (az első 7 pont (Chiu et al., 2006a, 2007b; Kaushik et al., 2008)), a dohányzás (Smith et al., 2001) vagy a ARMS2 vagy CFH gének (Fritsche et al., 2013). A középpontok (piros) esélyek vagy kockázati arányok, míg a vonalak a felső és az alsó konfidencia intervallumot mutatják. (Az ábraszínben a színre történő hivatkozások értelmezéséhez az olvasót a cikk webes változatára kell hivatkozni.)
Sok más, az életkorral összefüggő betegséget súlyosbít a magas GI-diéta is: a magas GI-diétát fogyasztó személyek fokozottan veszélyeztetettek a II-es típusú cukorbetegség, a szív- és érrendszeri betegségek, valamint a szürkehályog miatt (Chiu et al., 2011). Mivel a szürkehályog a lencsefehérjék, az úgynevezett kristályok poszt-szintetikus módosulásából származik, úgy tűnik, hogy a megnövekedett cukorszintek is szerepet játszhatnak a kataraktogenezisben. Ezek a kapcsolatok érdekesek, mert a lencse avaskuláris, anoxikus környezet, amely valószínűleg a leglassabb anyagcsere a szervezetben. Közvetlenül mellette található a retina, a szervezet leginkább oxigéntartalmú és legérzékenyebb szövete. A magas GI szénhidrátbevitel által hátrányosan befolyásolt szövetek metabolikus sokfélesége arra utal, hogy az étrendi szénhidrát minőség és a sejtes homeosztázis közötti kapcsolat alapvető fiziológiai jelentőséggel bír, és valószínűleg közös etiológiai összefüggés van az étrendi glikémia és a különféle betegségek között.
2.2. Fejlett glikációs végtermékek (AGE) felhalmozódása
Az időskor az öregedés és a magas GI diéták fogyasztása során halmozódik fel. (A) Az emberi lencséket fiatal (22 éves) vagy idős (76 éves) donorok rokkantáitól szerezték be. A lencséket fiatal (korhónapos) és idős (korhónapos) egerekből gyűjtötték be. Az AGE-ket anti-MG-H1 alkalmazásával detektáltuk, a leírtak szerint (Uchiki et al., 2012). A legfrissebb bizonyítékok azt mutatják, hogy ez az antitest valóban felismeri az MG-H3 izomert (Wang és mtsai., 2015), és ezeket annak is megjelöltük. A mennyiségi meghatározáshoz Ponceau, teljes fehérje festést (humán minták) vagy GAPDH expressziót alkalmaztunk. (B) Ugyanazon idős egerek mintái: agy, lencse, retina és máj azoktól az egerektől, akiket alacsony vagy magas glikémiás indexű táplálékkal etettek 10 hónapig.
Noha a fruktóz definíció szerint alacsony GI-tartalmú cukor, a magas fruktóz-tartalmú étrend az egészségkárosodáshoz is társul (Lim et al., 2010; Lustig, 2013). Az egyik lehetséges mechanizmus az lehet, hogy a fruktóz képes a glükózhoz képest megnövekedett sebességgel képezni az AGE-ket (Bousova et al., 2011; Sadowska-Bartosz et al., 2014). Így a fruktóz toxicitása annak köszönhető, hogy képes AGE-ket képezni. Az élesztőmodellben azonban az in vivo fruktóz nem glikozálóbb, mint a glükóz (Semchyshyn et al., 2014), és egy friss tanulmány azt sugallja, hogy a fruktóz önmagában nincs összefüggésben az egészségkárosodással, ami nem tulajdonítható a megnövekedett teljes kalóriabevitelnek (Chung et al., 2014). Így nem világos, hogy a fruktóz glikáló aktivitása károsabb-e in vivo, mint a glükóz. Figyelembe véve az étrendünkben előforduló sok fruktózt, a fruktózfogyasztás és az AMD kockázat közötti kapcsolat további figyelmet érdemel.
2.3. A proteopoise és az AGE in vitro elemzése
Feltételezzük, hogy az AGE által módosított fehérjék fokozott felhalmozódása a sejtek homeosztázisának hosszú távú megzavarásához és az általános egészségi állapot csökkenéséhez vezet. A proteopoise fenntartásához a sérült fehérjék megfelelő azonosítása és eltávolítása szükséges. Számos proteolitikus út képes a nem kívánt fehérjéket ártalmatlanítani, ha azok megsérültek vagy már nem szükségesek.
A proteaszóma egy több alegységből álló proteáz, amely lebontja vagy kibontja a fehérjéket (Dudek et al., 2005; Marques et al., 2006; Shang et al., 2001; Zhang et al., 2007), és amelyeket gyorsan el kell távolítani. . Ez számos sejtciklus-szabályozó fehérjét tartalmaz (Buschhorn és Peters, 2006; Peters, 2002; Yew, 2001). A proteaszóma lebonthatja az ubiquitinált fehérjéket. Az ubiquitin út három különböző enzimcsalád közvetítésével adja hozzá a szubsztrátokhoz a kis fehérje ubiquitint. A többszörös ubiquitin enzimek lehetővé teszik a szubsztrát tökéletes specifitását a lebomlás irányításában (Pickart és Fushman, 2004). Így a károsodott fehérjék azonosíthatók és célba vehetők a proteazomális lebontáshoz az ubiquitin-részek hozzáadásával. Amikor az út megfelelően működik, a szubsztrát nagyon nagy tömeget érhet el, amikor multiubiquitinizálódik. Ha ezek a nagy tömegű, ubiquitinezett szubsztrátok nem bomlanak le, aggregálódhatnak és oldhatatlanná válhatnak. A lebontás előtt az ubiquitint eltávolítják és újrahasznosítják, míg a szubsztrát peptidekké bomlik.
A lizoszóma lebontja az extracelluláris környezetből az endocitózis révén származó fehérjéket, valamint az autofágia útján szállított intracelluláris fehérjéket. Az autofágia kezdetben olyan útként került azonosításra, amely táplálékhiányos körülmények között képes visszaszerezni az ömlesztett sejtfehérjéket (Cuervo és Dice, 1998; Mortimore et al., 1988). Az autofágia teljes organellákat is lebonthat, és szubsztrát-specifitást mutathat (Tolkovsky, 2009; Wong et al., 2012). Mind a proteázóma, mind az autofág/lizoszomális proteolitikus kapacitás csökken az öregedés során (Cuervo és Dice, 2000; Pereira és mtsai, 2003), így potenciálisan hozzájárulhat a sérült fehérjék felhalmozódásához.
Az MGO kezelés AGE felhalmozódást és csökkent fehérjebontást eredményez. (A) Az RPE sejteket 1 mM MGO-val kezeltük 2 órán át. Ezután az MGO-t eltávolítottuk, és a sejteket inhibitorok jelenlétében vagy hiányában inkubáltuk a megadott ideig. Az AGE-ket anti-MG-H3 segítségével detektáltuk (Wang et al., 2015). (B) Az RPE sejteket 60 órán át 3H-Tyr-vel jelöltük, majd a sejteket 2 órán át MGO-val kezeltük. Az MGO eltávolítása után a fehérjeforgalom sebességét a TCA-ban oldódó radioaktivitás időbeli vizsgálatával határoztuk meg.
Megvizsgáltuk azt is, hogy a lizoszóma és az autofág út gátlói befolyásolták-e az AGE clearance-ét. A klorokin, amely megemeli az intralysosomális pH-t, és ezáltal gátolja a lizoszomális proteázokat, csökkenti az AGE clearance-ét (vö. A 3–5. És a 7–9. Sávot). Ezek az eredmények arra utalnak, hogy a lizoszóma részt vesz az AGE-vel módosított szubsztrátok kiürülésében. Megjegyezzük, hogy a klorokinkezelés során felhalmozódó nagyon nagy tömegű ubiquitinált és AGE-módosított fehérjét is megfigyelhetjük (5. sáv), ami arra utal, hogy egyes ubiquitinizált AGE-módosított fehérjék lebomlanak a lizoszómán keresztül. Ezek az adatok egyetértenek a legújabb irodalommal, jelezve, hogy a lizoszomális és a proteasomális útvonalak együttműködnek a károsodott fehérjék lebontásában (Park és Cuervo, 2013). További adatok azt mutatják, hogy míg a glikált fehérjék a lizoszómába érkeznek, úgy tűnik, hogy inkább a belső membránon halmozódnak fel, mintsem hogy elérnék a lizoszómán belüli proteolitikus mechanizmust (Uchiki et al., 2012). Mint ilyenek, a proteolitikus kapacitás csökkentésével súlyosbíthatják a proteopoise megszakadását. Ezeket a megfigyeléseket megerősítették, amikor megvizsgáltuk az MGO-val kezelt RPE sejtek teljes proteolitikus forgalmát; Az MGO-kezelés 50% -kal csökkentette a proteolitikus forgalmat (4B. Ábra). Ezek az adatok arra utalnak, hogy a hosszú távú hiperglikémia csökkent proteolízishez vezet.
Annak meghatározásához, hogy az autofág útvonal részt vesz-e az AGE-k kiürülésében, az autofágia inhibitor 3-metil-adenint (3MA) használtuk. A 3MA kezelés az AGE-módosított fehérjék clearance-ét is csökkentette (hasonlítsa össze a 3–6. És a 7–10. Sávot). Eredményeink együttesen azt mutatják, hogy mind a proteaszóma, mind az autofág proteolitikus utakat alkalmazzák az AGE-vel módosított fehérjék tisztítására.
3. Modell és következtetések
Az AGE felhalmozódásának és a proteopoise modellje. A magas GI diéta fogyasztása fokozott oxidációt és glikációs indukált fehérje károsodást okoz. Ha a károsodott fehérjék szintje alacsony, az ubiquitin és a lizoszomális/autofág proteolitikus rendszerek lebontják a sérült fehérjéket, és a toxicitás elkerülhető (felső). Krónikus glikatív stressz alatt a glikált fehérjék felhalmozódnak. Ide tartozhatnak az AGE-k a módosítatlan fehérjékkel együtt, egyesek az ubiquitin konjugátumokat is tartalmazzák (doboz). Néhányan oligomerizálódhatnak és térhálósíthatják a nagyobb tömegű aggregátumokat. A nem lebomlott konjugátumok szintén felhalmozódhatnak, ha nincs elegendő proteazomális, ideértve a deubikvitinizáló aktivitást. A felhalmozódott oligomerizált megváltozott fehérjék károsíthatják a proteolitikus mechanizmust, felidézhetik a stressz ördögi körforgását, korlátozhatják a proteolitikus szerkesztést, és további károsíthatják a proteomot, ami az AGE-k és a konjugátumok in vivo megfigyelt, betegséggel összefüggő felhalmozódását eredményezheti.
Köszönetnyilvánítás
Ez az anyag az Egyesült Államok Mezőgazdasági Minisztériuma - Agrárkutatási Szolgálat (ARS) által támogatott munkán alapul, az 58-1950-4-003 számú megállapodás alapján. További támogatás a Nemzeti Szemészeti Intézettől az AT EY-13250, EY-21212 címre. Köszönetet mondunk Dr. Sheldon Rowannak a 2. ábrán végzett munkáért .
Életrajzok
Elizabeth A. Whitcomb Ph. D. a Tufts Egyetem humán táplálkozás-kutató központjának öregedésével foglalkozó tudós. Munkája az ubiquitin út szerepére összpontosít a sejtosztódásban, migrációban és differenciálódásban részt vevő szubsztrátok sorsának szabályozásában.
- DIET @ NET legjobb gyakorlati útmutató az étrend értékeléséhez az egészségkutatásban
- Diétás zsírok és egészsége HealthLinkBC File 68f
- Az egészséggel és az elhízással kapcsolatos étrendi szempontok Williams-szindrómában, Down-szindrómában és Prader – Willi-ben
- Étrend-irányelvek az amerikaiak egészségügyi ügyeihez
- Gale OneFile Egészség és Orvostudomány - Dokumentum - Diétás rézkorlátozás Wilson-kórban