Az étrendi olajösszetétel differenciálisan modulálja a bél endotoxin transzportját és az étkezés utáni endotoxémiát
Absztrakt
Háttér
A bélből származó endotoxin és az azt követő endotoxémia fő hajlamosító tényezőknek tekinthető olyan betegségek esetében, mint az érelmeszesedés, a szepszis, az elhízás és a cukorbetegség. Az étkezési zsír kimutatta, hogy növeli az étkezés utáni endotoxémiát. Ezért ennek a tanulmánynak a célja a különféle étrendi olajok hatásának értékelése a bél endotoxin transzportjára és az étkezés utáni endotoxémiára a sertés modelljeként. Feltételeztük, hogy a telített zsírsavakban (SFA) gazdag olajok megnőnek, míg az n-3 többszörösen telítetlen zsírsavakban (PUFA) gazdag olajok gyengítik a bél endotoxin transzportját és a keringő koncentrációkat.
Mód
Az étkezés utáni endotoxémiát huszonnégy sertésben mértük egy zabkása után, amelyet vízzel (kontroll), halolajjal (FO), növényi olajjal (VO) vagy kókuszolajjal (CO) készítettek. A vért az étkezés után 0, 1, 2, 3 és 5 órával vettük fel, és mértük az endotoxin szintjét. Ezenkívül az ex vivo ileum endotoxin transzportot módosított Ussing-kamrák alkalmazásával értékeltük, és a beleket vagy olaj nélkül, vagy 12,5% (v/v) VO, FO, tőkehalmájolajjal (CLO), CO-val vagy olívaolajjal (OO) kezeltük. Ezután az ex vivo nyálkahártya és a szerosális endotoxin transzport permeabilitását (Papp) mértük fluoreszcensen jelölt lipopoliszacharid hozzáadásával.
Eredmények
Az étkezés utáni szérum endotoxin koncentrációja telített zsírsavakban gazdag étkezés után nőtt, és magasabb n-3 PUFA bevitel mellett csökkent. Az olajmentes kontrollhoz képest az n-3 zsírsavakban gazdag halolaj és CLO 50% -kal csökkentette az ex vivo endotoxin Papp értéket (P
Háttér
Az étrendi zsír és az endogén vér endotoxin közötti kapcsolat az elmúlt években fokozott orvosi és orvosbiológiai érdeklődést váltott ki. Továbbá a magas zsírtartalmú táplálkozással járó hyperphagia, megnövekedett zsírbetegség és anyagcsere-változások összefoglalhatók egerekben, amelyeket négy hétig tartósan infundáltak LPS-sel [1]. Beszámoltak arról, hogy az elfogyasztott zsír szerkezete (emulzió vs. szabad olaj) megváltoztatja az endotoxémia mértékét, és hogy az étkezési zsírok összetételének, szerkezetének és minőségének megváltoztatása javíthatja az egészséget [2]. Egészséges emberekben az étkezés utáni plazma endotoxin-koncentráció a magas zsírtartalmú étkezés után (kb. 380 kcal zsírból, a teljes energia 42% -a) átlagosan 18% -kal nő az éheztetett állapothoz képest [3]. Ezek a szerzők arra a következtetésre jutottak, hogy az étkezés utáni LPS növekedése hozzájárulhat az étkezés utáni gyulladás és betegség kialakulásához. Ghanim és mtsai. [4, 5] azt is kimutatta, hogy egészséges felnőtteknél a magas zsírtartalmú, magas szénhidráttartalmú étkezés (
900 kcal) 70% -kal növelte az étkezés utáni plazma LPS-koncentrációt. Laugerette és mtsai. [6] nemrégiben beszámolt arról, hogy az étrendi olajösszetétel eltérően modulálja az egér gyulladását és az endotoxin transzportját. Ezek a szerzők azt is kimutatták, hogy a zsírösszetétel, nem az étrendben lévő mennyiség (22 vs. 3%) volt kritikus a plazma endotoxémia modulálásában. Ezek az adatok együttesen azt mutatják, hogy az étrendi zsírbevitel és -összetétel képes modulálni a vér endotoxint, és ez heveny gyulladással, valamint az elhízás és a cukorbetegség anyagcserebetegségeivel van összefüggésben.
Ezért ennek a tanulmánynak a célja a különféle étkezési zsírok in vivo és ex vivo bél endotoxin transzportjára és a keringő koncentrációkra gyakorolt hatásainak felmérése volt a disznó biomedicinális modellként. Feltételezzük, hogy a telített zsírsavakban (SFA) gazdag olajok megnövekednek, míg az n-3 PUFA-t (dokozahexaénsavat [DHA] és eikozapentaénsavat [EPA]) tartalmazó olajok gyengítik a bél endotoxin transzportját és az étkezés utáni endotoxémiát.
Mód
Anyagok és állatok
Az ebben a vizsgálatban használt összes vegyszert a Sigma-Aldrich-től (St. Louis, MO) vásároltuk, hacsak másképp nem jelezzük. Minden állat-felhasználást és eljárást az Iowa Állami Egyetem Intézményi Állattenyésztési és Felhasználási Bizottsága hagyott jóvá.
Az étrendi olaj hatása az étkezés utáni szérum endotoxin koncentrációra
Huszonnégy sertést (49 ± 7 kg testtömeg) neveltek egy tipikus kukorica-szójabab-étrenden, amely kielégítette vagy meghaladta tápanyagigényüket [21], és véletlenszerűen kiosztották a négy kezelés egyikét. A kezelések 500 g őrölt kukorica-szójabab liszt tésztából (2145 kcal ME) álltak, 1 vagy 50 ml vízzel (kontroll) készültek; 2) 50 ml halolaj (FO) (Spring Valley Inc., UT); 3) 50 ml növényi olaj (VO) (Hy-Vee Inc., IA); vagy 4) 50 ml kókuszolaj (CO) (Spectrum Naturals Inc., NY). Egy éjszakai böjt után hat disznót etettek minden zabkása étkezés egyikével. A sertések önként elfogyasztották az egész zabkását étkezés után tíz perc alatt. A vért az étkezés után 0, 1, 2, 3 és 5 órával vénaszúrás útján vettük fel pirogénmentes vakcinázó csövek és steril tűk segítségével. Megfelelő óvintézkedéseket hoztak a vér külső endotoxin-szennyeződésének megelőzésére. A szérumot 2000 x g és 4 ° C hőmérsékleten végzett centrifugálással választottuk el. A szérumot ezután pirogénmentes csövekben -80 ° C-on tároltuk a további elemzésig.
A keringő szérum endotoxin-koncentrációt a végpont fluoreszcens vizsgálattal mértük, a rekombináns C faktor (rFC) rendszert (Lonza ™, Svájc) alkalmazva. Röviden, a szérummintákat 1000-szer hígítottuk, és 100 μl mintát vagy standardot adtunk egy 96-lyukú lemezre, és inkubáltuk 37 ° C-on 10 percig. Ezt követően 100 μl rFC enzimet, rFC vizsgálati puffert és rFC szubsztrátot adtunk 1: 4: 5 arányban a lemezhez, és kezdeti leolvasást, majd 1 órás inkubálást végeztek 37 ° C-on. Meghatároztuk az egyes üregek relatív fluoreszcencia egységét (RFU) (gerjesztés 380 nm és emisszió 440 nm). A tesztkészletből származó pozitív kontroll standardot használtuk a vizsgálat érvényességének megállapításához, és az endotoxin koncentrációját interpoláltuk a standardokból összeállított standard görbéből, és korrigáltuk a minta hígításával.
Ex vivo bélintegráció és endotoxin transzport
Tizenegy (21–28 napos) sertés frissen izolált ileumszegmensét hűtött Krebs-Henseleit pufferbe helyeztük (amely mmol/L-ben tartalmazta: 25 NaHCO3, 120 NaCl, 1 MgSO4, 6,3 KCl, 2 CaCl2, 0,32 NaH2PO4; pH 7.4) laboratóriumba történő szállításhoz állandó levegőztetés mellett. A bélszöveteket ezután lehúzták külső szerosális rétegükről, és azonnal beépítették a módosított Ussing-kamrákba (Physiologic Instruments Inc., San Diego, Kalifornia és World Precision Instruments Inc., New Haven, CT). Mindegyik kamrát és bélszegmenst (0,71 cm2) a nyálkahártya és a szerosa oldalán 5 ml Krebs-Henseleit pufferrel fürdettük, és folyamatosan gázosítottuk 95% O2-5% CO2 keverékkel. A kamrákat egy kétcsatornás áram- és feszültségelektród-párhoz kapcsoltuk, amely 3% nemes agar-hidat tartalmazott, és 3 M kálium-kloriddal töltöttük fel a bélmembránok elektrofiziológiai paramétereinek mérésére vagy az endotoxin nyálkahártya-szerózis transzportjának mérésére. A transzepithelialis rezisztencia (TER) nem volt különbözõ sertések között, ami azt jelzi, hogy nincs különbség a paracelluláris permeabilitásban vagy a szivárgó bélben (az adatokat nem mutatjuk be).
Az epesavaknak a bél integritására gyakorolt bármilyen hatásának kizárása érdekében a TER és a makromolekulák permeabilitását először izolált ileum mintákon tesztelték, amelyeket sertés epesavval (0, 3, 6 és 9 mg/ml) harminc percig inkubáltak. Ezt követően a FITC-jelölt dextránt (FITC-Dextran, 4,4 kDa) a nyálkahártya és a szeroszula transzportját mértük a korábban leírtak szerint [22]. Röviden: a nyálkahártya kamrákat 2,2 mg/ml FITC-Dextran-nal fertőztük, és mindkét oldalról 10–15 percenként nyolcvan percig gyűjtöttük a kamramintákat. Ezután a relatív fluoreszcenciát fluoreszcens lemezleolvasóval (Bio-Tek, USA) határoztuk meg, gerjesztési és emissziós hullámhossza 485, illetve 520 nm volt. Ezt követően minden egyes kezelésre kiszámoltuk a látszólagos permeabilitási együtthatót (Papp):
Ahol: dQ/dt = szállítási sebesség (μg/perc); C0 = kezdeti koncentráció a donorkamrában (μg/ml); A = a membrán területe (cm 2).
Az étkezési zsír endotoxin transzportra gyakorolt hatását a módosított Ussing-kamrákba szerelt fluoreszcein-izotiocianát (FITC) jelzett LPS (Escherichia coli 055: B5) ex vivo permeabilitásának felhasználásával vizsgálták. Röviden, a sertés bélszöveteinek szegmenseit 12,5% (v/v) pufferolt sóoldat-kontrollal (CON), halolajjal vagy tőkehalmájjal (CLO) kezelték, amelyet a Spring Valley Inc., UT készített, vagy növényi olajjal, kókuszolajjal vagy olívaolaj (OO), amelyet a Hy-Vee Supermarkets Inc.-től (IA) vásároltak. Minden olaj kereskedelmi forgalomban kapható volt, majd 20 mM nátrium-taurodeoxikoláttal (epesavval) keverték a micella képződését a bél miliőjének szimulálására. Ezután mindegyik nyálkahártya kamrát 20 μg/ml FITC-LPS-szel fertőztettük, és a kamra mintáit 10-15 percenként, nyolcvan percig gyűjtöttük. Ezután az egyes minták relatív fluoreszcenciáját fluoreszcens lemezolvasóval (Bio-Tek, USA) határoztuk meg, gerjesztési és emissziós hullámhossza 485, illetve 520 nm volt. A látszólagos permeabilitási együtthatót ezután a FITC-Dextran esetében fent leírtakhoz hasonlóan számoltuk.
Lipid tutajok, diétás olaj és ex vivo bél endotoxin transzport
A lipid tutajoknak a bél endotoxin transzportjában betöltött szerepének vizsgálatához 16 sertés (56 ± 4 napos) ileum szegmenseit szereltük fel Ussing kamrákba a fent leírtak szerint. A szegmenseket előkezeltük 25 mM metil-P-ciklo-dextrinnel vagy anélkül (MβCD, szintetikus lipid raft módosító) 30 percig. Ezt követően a nyálkahártya-kamrát só-epesavval (CON) vagy kókuszdióolaj-epesavval (12,5 térfogat/térfogat%) megkötötték, és kiszámították az egyes szövetek FITC-LPS látszólagos permeabilitási együtthatóját.
Zsírsav-elemzés
A zabkása elkészítéséhez használt étrendi olajok zsírsavprofiljait GC-MS-sel határoztuk meg és elemeztük [23, 24]. 1 ml olajat összekevertünk 0,5 ml 4: 1 arányú hexánnal, és 125 μg/l heptadekánsavat adtunk mindegyik mintához belső standardként. A FAME-t GC-vel analizáltuk Hewlett-Packard 6890-es modellel, Omegawax 320 (30 m x 0,32 mm i.id. 0,25 um) kapilláris oszloppal felszerelve. A hordozógáz a hidrogén volt. A hőmérsékleti program 80 és 250 ° C között mozgott, 5 ° C/perc hőmérsékletemelkedéssel. Az injektor és a detektor hőmérséklete 250 ° C volt, és 1 μL mintát injektáltunk, és osztva futtattuk. A zsírsav-metil-észtereket relatív retenciós idejük alapján azonosítottuk az oszlopon a megfelelő standardok és a heptadekánsav szempontjából.
Adatelemzés
Az eredményeket átlagként ± S.E.M adtuk meg, és az SAS Proc Mixed eljárásával (Cary, NC) elemeztük. A modellben az Ussing-kamra futtatásának ismétlését vagy napját alkalmazták véletlenszerű hatásként. A különbség statisztikai szignifikanciáját a varianciaanalízissel (ANOVA) elemeztük, amelyet Tukey tartománytesztje követett az összes kezelési eszköz páros összehasonlítására. A különbségeket szignifikánsnak tekintettük P ≤ 0,05 és tendenciát P ≤ 0,10 esetén.
Eredmények
Diétás olaj zsírsavprofilok
A zabkása elkészítéséhez és/vagy az ex vivo transzport vizsgálatban használt olajok zsírsavösszetételét az 1. táblázat ismerteti. A kókuszolaj magas koncentrációban tartalmaz telített zsírsavakat (89%), különösen laurinsavat, mirisztinsavat és palmitinsavat. . Az olívaolaj nagyon magas egyszeresen telítetlen olajsavat és mérsékelt mennyiségű palmitinsavat tartalmazott, telített zsírtartalma 29% volt. A tanulmányban használt növényi olaj nagy mennyiségben (50%) arachidonsavat (20: 4n6), 32% olajsavat és 13% palmitinsavat tartalmazott. A felhasznált halolaj 35% dokozahexaénsavat (DHA) és 19% eikozapentaénsavat (EPA) tartalmazott, míg a tőkehal májolaj 32% palmitinsavat, 25% arachidonsavat, 8,6% EPA és 4,3% DHA-t tartalmazott. Az n6: n3 arány az olívaolaj> növényi olaj> tőkemájolaj> halolaj> kókuszolajban volt a legmagasabb.
Az étrendi olaj hatása az étkezés utáni szérum endotoxin koncentrációra
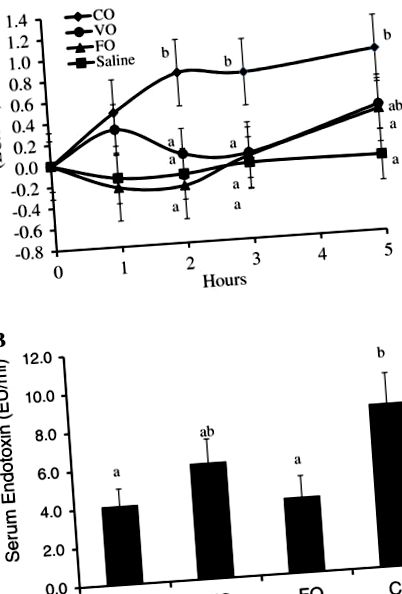
Az étrendi lipidek étkezés utáni szérum endotoxin-koncentrációra gyakorolt hatásának értékeléséhez a sertések egy zabkása ételt kaptak, amely 50 ml sóoldatot, CO-t, VO-t vagy FO-t tartalmazott. A felhasznált különféle olajok endotoxin-koncentrációja nem különbözött (az adatokat nem mutatjuk be). Az étkezés utáni szérum endotoxin-koncentráció változását a különféle étkezési kezelések miatt az 1A. Ábra mutatja be. A teljes étkezés utáni szérum endotoxin-koncentráció szignifikánsan alacsonyabb volt a fiziológiás sóoldatot vagy FO-t tartalmazó étkezésekben, az átlagos teljes szérum endotoxin-koncentráció kétszeresére nőtt a telített kókuszolaj-étkezésekhez képest (P 1. ábra
Az exogén sertés epesav hatása az ex vivo bél integritására
Az epesavakról kimutatták, hogy növelik a tenyésztett Caco-2 sejtvonalak béláteresztő képességét [25]. Annak kizárására, hogy az exogén epesav csökkentheti a bél integritását, frissen izolált sertés ileum szegmenseket használtunk a TER (2A ábra) és a FITC-Dextran permeabilitás (2B ábra) mérésére. Mivel ezeket a szegmenseket ex vivo növekvő sertés epe koncentrációknak tették ki, a bél integritásában nem tapasztaltak különbségeket (P> 0,10, 2. ábra). Ennek oka lehet a bélszövetek epesavval szembeni toleranciája a korábbi in vivo expozíció miatt, ellentétben a sejttenyészetekkel, ahol a sejteket nem érik korábban az epesavak.
Az étrendi olaj hatása az ex vivo bél endotoxin transzportjára
Az ex vivo nyálkahártya és a szerosalus ileum endotoxin transzportját módosított Ussing-kamrák és FITC-LPS permeabilitási assay alkalmazásával értékeltük (3. ábra). A sóoldat nélküli olajkontroll kezeléshez képest az endotoxin Papp szignifikánsan alacsonyabb volt mind az FO, mind a CLO kezeléseknél (P 0,05), de még mindig gyengített endotoxin Papp volt a kókuszolaj kezeléssel szemben (P 3. ábra
A lipid raft módosulásának hatása a telített zsír indukálta endotoxin transzportra
Annak a hipotézisnek a tesztelésére, miszerint a bél lipid raftjainak destabilizálása csökkentené a telített zsír által indukált endotoxin permeabilitást, az ileum mintákat előkezeltük a lipid raft módosító metil-β-ciklodextrinnel (MβCD) és kókuszolajjal ex vivo. Ezután megmértük a FITC-LPS endotoxin transzportáteresztő képességét (4A. Ábra). A várakozásoknak megfelelően a CO-kezelés jelentősen megnövelte az ileum endotoxin Papp-ot a sóoldat-kontrollhoz képest (P 4. ábra
Vita
Feltételeztük, hogy a DHA-ban és az EPA-ban gazdag olajok étrendi bevitele gyengíti a bél endotoxin transzportját és az étkezés után keringő endotoxint. Megállapítottuk, hogy az étkezési csukamáj- és halolajok gyengítették a szérum endotoxin-koncentrációit a kókuszolajhoz képest, és ezekben a sertésekben az endotoxin-szint hasonló volt a kontrollcsoporthoz (1. ábra). Legjobb tudomásunk szerint nincs más olyan tanulmány, amely kimutatta volna a DHA és az EPA ezen hatását az endotoxin transzportra és a vér endotoxémiájára.
A bélstressz, az ischaemia, a gyulladás és a megbetegedések során a paracelluláris transzport a szűk kereszteződésen, ún. Alternatív megoldásként transzcelluláris vagy intracelluláris transzport fordulhat elő, különösen egészséges egyéneknél [40]. Kimutatták, hogy a sejtmembránon át szállított transzcelluláris endotoxin a TLR4-en és az oldható GPI-re rögzített CD14 receptoron keresztül lipid raft által közvetített mechanizmusban fordul elő [41, 42]. Ezen túlmenően a chilomicronhoz kapcsolódó LPS transzport szintén kulcsfontosságú szerepet játszik a bél LPS transzportjában a bél hámsejtjeiből [11, 43, 44]. Fontos, hogy nem észleltük a bél integritásának csökkenését, amely javíthatná a paracelluláris permeabilitást, a transzepithelialis rezisztencia vagy a FITC-dextran permeabilitás értékelése alapján, kezelés vagy rövid távú tutaj destabilizáció következtében (4B. Ábra). Ezek az adatok azt sugallják, hogy egészséges bélhámkörülmények között az endotoxin valószínűleg lipid tutaj által közvetített endocitózis útján szállul.
Az in vitro kísérletek egyértelműen azt mutatják, hogy az n-3 PUFA megzavarja a TLR4 jelátvitelt és az NFκB LPS általi aktiválását egér monocita sejtvonalban [50]. Ezenkívül a DHA in vitro modulálja a TLR4 jelátvitelt RAW 264,7 makrofágokban és 293 T-sejtekben [49], humán monocitákban és dendritikus sejtekben [51] és zsírszövetekben. Sertéseknél korábban kimutattuk, hogy az étrendi EPA és a DHA hatékony eszköz az LPS által indukált TLR4 jelátvitel által befolyásolt gyulladásos állapot és útvonalak befolyásolására [52] és a bélműködés megváltoztatására [24, 53]. Ezért feltételezhető, hogy a TLR4 toborzás antagonizálása lipid tutajokra, és ezt DHA és EPA jelzi, vagy telített zsírsavakkal stimulálja ezeket a folyamatokat, megváltoztatja az endotoxin transzportot és a keringést az étkezés utáni endotoxinnal.
Egy másik mechanizmus, amelyen keresztül az endotoxin bejuthat a keringésbe, a micellákon keresztül történik. Mivel az endotoxin mellékláncok zsírsavakból állnak, az endotoxinok beépülhetnek a micellákba és a bél hámsejtjeibe szállíthatók [54]. A bélhámsejtekben a chilomicronok szállítják az abszorbeált lipideket a test különböző részeibe. Kimutatták, hogy a magas zsírbevitel arányosan növeli a chilomicron endotoxintartalmát, ami azt jelzi, hogy a magas zsírfogyasztás valóban fokozza az endotoxin magasabb transzportját a bél hámsejtjébe és a chilomicronba való beépülést [11, 28]. Továbbá, annak ellenére, hogy a mechanizmus nem világos, a magas zsírbevitel kimutatta, hogy a szűk kereszteződésű fehérjék internalizálódását idézi elő, és növeli a paracelluláris permeabilitást a makromolekulák, beleértve az endotoxint is [30]. Annak ellenére, hogy ez az endotoxin transzport mód nem zárható ki, feltételezzük, hogy a zsírsavak micellákba való beépülésének sebessége az olaj összetételének függvényében nem változik. Ezért azt javasoljuk, hogy a bél endotoxin transzportjában megfigyelt különbség elsősorban transzcelluláris transzport, amely lipid tutajokat és receptor által közvetített endocitózist foglal magában [42].
Összefoglalva, ezek az adatok arra utalnak, hogy az étrendi olajok differenciálisan megváltoztathatják a bél endotoxin transzportját. A DHA-ban és EPA-ban gazdag olajok gyengítik az endotoxin transzportot, míg a magas telített zsírsavtartalmú olajok fokozzák az endotoxin transzportot. Ezenkívül a bél endotoxin transzportja egészséges egyénekben lipid tutaj által közvetített mechanizmus révén szabályozható. A telített zsírsavak stabilizálhatják a lipid tutajokat, lehetővé téve a nagyobb endotoxin transzportot.
- 2–9 éves amerikai gyermekek táplálkozási szokásai összefüggenek a bél mikrobiom-összetételével
- A gyermekek mikrobiota összetételéhez kapcsolódó étrendi minták Élelmiszertudományi Tanszék
- Az étrendi fruktóz és glükóz differenciálisan befolyásolja a lipid- és glükóz homeosztázist
- Négy népszerű étrendi trend összehasonlítása Paleo vs Keto vs 5 2 vs Dukan - Saját blog
- Diéta és a stroke elsődleges megelőzése Szisztematikus áttekintés és étrendi ajánlások ad hoc által