Az étrendi sóváltozások hatása a renin-angiotenzin rendszerre patkányokban
Institut de Pharmacologie, Faculté de Médecine, Université Louis Pasteur és
Institut de Pharmacologie, Faculté de Médecine, Université Louis Pasteur és
Service d'Hypertension, des Maladies Vasculaires et Pharmacologie Clinique, Hôpitaux Universitaires de Strasbourg, 67085 Strasbourg, Franciaország
Institut de Pharmacologie, Faculté de Médecine, Université Louis Pasteur és
Institut de Pharmacologie, Faculté de Médecine, Université Louis Pasteur és
Institut de Pharmacologie, Faculté de Médecine, Université Louis Pasteur és
Service d'Hypertension, des Maladies Vasculaires et Pharmacologie Clinique, Hôpitaux Universitaires de Strasbourg, 67085 Strasbourg, Franciaország
Absztrakt
a renin-angiotenzin rendszer (RAS) kritikus szerepet játszik a vese hemodinamikájának és a tubuláris transzport funkciójának szabályozásában. Számos tanulmány kimutatta, hogy a vesében a szövet ANG II szintje szignifikánsan magasabb, mint a keringő szint (3, 6, 31). (10) megerősítettük ezeket az eredményeket a patkány vese kéregében és medullájában. Egyes adatok a keringő és a vese angiotenzinek differenciális szabályozásának létezésére is utalnak (2, 6,9).
Az angiotenzin képződését lehetővé tevő RAS fő komponenseinek, az angiotenzinogénnek (7, 16, 19), a reninnek (29, 33) és az angiotenzin-konvertáló enzimnek (ACE) (1, 17) jelenlétét a vesében bizonyították. Ezért az intrarenalis ANG II szintek helyi szintézisből származhatnak. Meg kell jegyezni, hogy ezen komponensek lokalizációja a vesében eltér. Az angiotenzinogén és a renin főleg a vesekéregben található, míg az ACE-aktivitás ötször magasabb a vesemagban, mint a vesekéregben (10). Ezek az adatok a RAS eltérő funkcionalitására utalnak a vesekéregben és a medullában.
Kísérleti terv
A hím Wistar-Kyoto patkányokat az Iffa-Credo-tól (l'Arbresle, Franciaország) szereztük be, és laboratóriumunkban elhelyeztük 1 héttel a kezelések megkezdése előtt. 12: 12 órás sötét fény ciklust alkalmaztunk (a fények 6: 00-18: 00 között világítanak). Az állatok szabadon hozzáférhettek a csapvízhez, és patkánytojást fogyasztottak (UAR, Epinay sur Orge, Franciaország). A megváltozott étrendi sóbevitel kísérleteihez az állatokat alacsony sótartalmúakkal etették (LS csoport, 0,025% NaCl; n = 8), normál só (NS csoport, 1% NaCl; n = 7), vagy magas sótartalmú (HS csoport, 8% NaCl; n = 7) diéta 21 napig. A különböző sótartalmú étrendek (UAR 212, UAR 210, illetve UAR 210+) és desztillált ivóvíz ad libitum volt elérhető. Valamennyi állat 10 hetes volt a mintavétel napján, és a plazma- és szövetmintavétel előtti éjszaka élelemtől, de nem víztől szenvedtek. Mivel az érzéstelenítés a RAS erős stimulálását váltja ki, a patkányokat lefejezéssel leölték.
Plazma és vese mintavétel
Lefejezés után ~ 5 ml törzsvizet gyorsan összegyűjtöttünk jéghideg csövekbe, amelyek 0,25 ml inhibitor koktélt [2,5 mM fenantrolin, 3 mM EDTA, 0,1 mM pepstatint, 3 μM patkány renin inhibitor Ac-His-Pro-Phe-Val -Sta-Leu-Phe-NH2 (Néosystem), 0,11 mM neomicin-szulfát; végkoncentrációk] az ANG I és ANG II mérésére 1 ml-t használtunk a plazma renin aktivitáshoz (PRA) és a plazma angiotenzinogént (EDTA cső), és 1 ml-t ACE aktivitáshoz (lítium-heparin cső). A vért azonnal 4 ° C-on 10 percig 2000 ° C-on centrifugáltuk g. A plazmamintákat folyékony nitrogénben lefagyasztották, és a vizsgálatig -80 ° C-on tárolták.
A lefejezés után a veséket azonnal eltávolították és kettévágták. A jobb vese mindkét felét jéghideg tányéron gyorsan boncolták a kéregbe és a medullába. Alapos gondot fordítottak a külső kéreg finom csíkjainak levágására és a medulla belső szakaszára korlátozására, hogy korlátozzák a juxtamedullaris glomerulusok jelenlétét. Minden szövetminta felét felhasználtuk az ANG I és az ANG II mérésére; ezeket lemértük, majd jéghideg metanolban homogenizáltuk (9). A homogenizátumokat 4 ° C-on 10 percig 2000 ° C-on centrifugáltuk g, és a felülúszókat szárazra pároljuk és -80 ° C-on tároljuk. Az egyes szövetminták másik felét a vese RA meghatározására használtuk, és foszfátpufferben homogenizáltuk 144 mM PMSF-10 mM fenil-higany-acetáttal (etanolban), és 4 ° C-on 20 percig 5000 ° C-on centrifugáltuk. g (6) A felülúszókat a vizsgálatig -20 ° C-on tároltuk.
A bal vese mindkét felét szintén kéregre és velőre boncoltuk, majd lemértük. Az egyes szövetminták felét felhasználtuk a vese angiotenzinogén meghatározására, és foszfátpufferben homogenizáltuk 1,5 M ammónium-szulfáttal, 1,5 mM pepstatinnal (etanolban) és 144 mM PMSF-10 mM fenil-higany-acetáttal (etanolban); a homogenizátumot 4 ° C-on 20 percig 5000 ° C-on centrifugáltuk g, és a felülúszót dekantáltuk. Az angiotenzinogén kicsapásához az ammónium-szulfát koncentrációját 2,5 M-ra állítottuk 4 M ammónium-szulfát hozzáadásával, és a felülúszót centrifugáltuk, mint korábban. Az ammónium-szulfát csapadékot vízben újraszuszpendáljuk és -20 ° C-on tároljuk a 6. vizsgálatig. Az egyes szövetminták másik felét folyékony nitrogénben lefagyasztották; a kéreg és a medulla felolvasztása után Triton X-100-at (0,3%) adtunk hozzá, a szöveteket homogenizáltuk és 4 ° C-on 20 percig 11 500 ° C-on centrifugáltuk. g szonikálás után. A felülúszókat Triton X-100-ban hígítottuk az ACE aktivitás meghatározása céljából, és a vizsgálatig -20 ° C-on tároltuk.
A RAS-alkatrészek mérése
Plazma és vese angiotenzinogén.
A plazma angiotenzinogént úgy határoztuk meg, hogy hígított plazmát inkubáltunk foszfátpufferrel, exogén patkány renin-készlettel és 144 mM PMSF-rel (etanolban) (6). 60 percig 37 ° C-on végzett inkubálás után az ANG1 keletkezését RIA-val számszerűsítettük az alábbiakban leírtak szerint. A kortikális és medulláris angiotenzinogén mintákat foszfátpufferrel, exogén patkány renin-medencével és 144 mM PMSF-10 mM fenil-higany-acetáttal (etanolban) inkubáltuk. 120 percig 37 ° C-on végzett inkubálás után 0,5 ml 1% -os trifluor-ecetsavat adunk hozzá; minden egyes inkubációt Sep-Pak C18 patronnal (Oasis Waters, Milford, Ma) extraháltunk, az eluátumot szárazra pároltuk, és az ANG I-t RIA-val meghatároztuk (6). A plazma és a vese angiotenzinogént a milliliter plazmában képződött ANG I nanogrammban és a szövet tömegének grammjában képződött ANG I nanogrammban fejezzük ki.
A plazma és a vese szövet renin aktivitása.
A PRA-t úgy mértük, hogy meghatároztuk az ANG I szintjét, amelyet a plazma 30 perces inkubálása során 37 ° C-on 5 mM 8-hidroxi-kinolin jelenlétében végeztünk. ANG I-t RIA-val mértem. A kéregben és a medullában RA-t mértünk, miután meghatároztuk a hígított felülúszók 30 perces inkubálása során keletkezett ANG I-t, patkányoktól kapott angiotenzinogénnel dúsított plazma jelenlétében 48 órával a binephrectomia után (6). ANG I-t RIA-val mértem. A PRA-t és a vese RA-ját nanogramm ANG I-ben fejezzük ki milliliter plazma/órában, és mikrogramm ANG I-t termeljük/gramm szöveti tömeg óránként, ill.
Plazma és vese ACE aktivitás.
Az ACE-aktivitást in vitro enzimatikus módszerrel határoztuk meg. Az in vitro plazma és vese ACE aktivitást Unger és mtsai. (35) mesterséges szubsztrát jelenlétében (10 mM N-karbobenzoxi-Phe-His-Leu, 67 mM foszfátpuffer, pH 8,0, 300 mM NaCl, 10 μM ZnSO4). A reakció során keletkező dipeptidet (His-Leu) spektrofluorimetriásán mértük, miután összekapcsoltuk o-ftalaldialdehid. Az ACE-aktivitás mérésének linearitásának biztosítása érdekében a vizsgálatban a fehérje-koncentrációt -1,1 h -1 értéken tartották;P 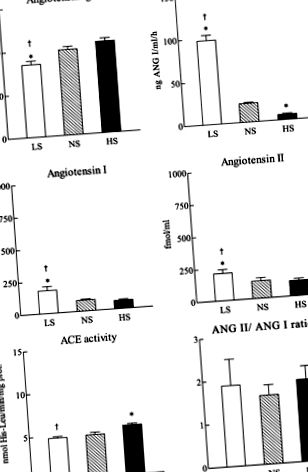
1. ábra.Alacsony nátriumtartalmú patkányok renin-angiotenzin rendszerének plazmakomponensei (LS; 0,025% NaCl; n = 8), normál-nátrium (NS; 1% NaCl; n = 7) vagy magas nátriumtartalmú (HS; 8% NaCl;n = 7) diéta 21 napig. Az értékek átlag ± SE. *P
A HS-diéta nem változtatta meg szignifikánsan a plazma angiotenzinogén szintjét, az ANG I és az ANG II szintet, illetve az ANG II/ANG I arányt az NS diétához képest (1. ábra). A HS-diéta csökkentette a PRA értékét (6,16 ± 1,28 vs. 21,82 ± 1,21 ng ANG I · ml -1 -1 h -1;P −1 · mg fehérje −1; P −1 · h −1; P
2. ábra.A renin-angiotenzin rendszer elemei az LS-t fogyasztó patkányok vesekéregében (n = 8), NS (n = 7), vagy HS (n = 7) diéta 21 napig. Az értékek átlag ± SE. *P
A HS diéta nem változtatta meg a kortikális angiotenzinogén szintjét, az RA-t, az ANG II/ANG I arányt vagy az ACE aktivitást az NS diétához képest. A HS-diéta csökkentette az ANG I szintet (196,92 ± 22,26 vs. 317,53 ± 16,99 fmol/g szövet; P −1 · h −1; P
3. ábra.A renin-angiotenzin rendszer elemei az LS-t fogyasztó patkányok vese medullájában (n = 8), NS (n = 7), vagy HS (n = 7) diéta 21 napig. Az értékek átlag ± SE. *P
- Diétás savterhelés és metabolikus acidózis a veseátültetésben részesülőknél
- A homeosztatikus étvágyrendszer változásai a fogyás után tükrözik a normalizálást az alsó felé
- Étrendi és életmódbeli tényezők a magas vérnyomásban Journal of Human Hypertension
- Az étrend fenntarthatóságának javításához szükséges étrendi változások hasonlóak az egész Európában PubMed-ben
- Étrendi változások a lisztérzékenység miatt John Hopkins Medicine