Az interferon 7-es faktorának hiánya megakadályozza a diéta okozta elhízást és inzulinrezisztenciát
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Országos Orvosi Molekuláris Biológiai Laboratórium, Általános Orvostudományi Intézet, Kínai Orvostudományi Akadémia és Peking Union Orvosi Főiskola, Peking, Kína;
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Kardiológiai Osztály, Szív- és érrendszeri Betegségek Intézete, Union Kórház, Tongji Orvosi Főiskola, Huazhong Tudományos és Technológiai Egyetem, Wuhan, Kína;
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Sanford-Burnham Orvosi Kutatóintézet, Rákközpont, La Jolla, Kalifornia; és
Élettudományi Főiskola, Wuhani Egyetem, Wuhan, Kínai Népköztársaság
Kardiológiai Osztály, Wuhani Egyetem Renmin Kórháza, Wuhan, Kína;
Kardiovaszkuláris Kutató Intézet, Wuhani Egyetem, Wuhan, Kína;
Az újranyomtatási kérelmek és egyéb levelezések címe: H. Li, Kardiológiai Tanszék, Wuhan Univ. Renmin Kórház, Kardiovaszkuláris Kutató Intézet, Wuhan Univ., JieFang Road 238, Wuhan 430060, PR China (e-mail: [email protected] ).
Absztrakt
Az elhízással kapcsolatos gyulladás szerepet játszik az inzulinrezisztencia és a 2-es típusú cukorbetegség patogenezisében. Ebben a tanulmányban az I. típusú interferon-szabályozó faktor (IRF7), az I. típusú interferon-függő immunválaszok fő szabályozójának potenciális szerepével foglalkoztunk az energia-anyagcsere szabályozásában. Az IRF7 expressziós szintje megnőtt a fehér zsírszövetben, a májszövetben és a gastrocnemius izomban mind a diéta okozta elhízott egerek, mind a ob/ob egerek összehasonlítva sovány társaikkal. 24 hetes magas zsírtartalmú étrend (HFD) táplálása után az IRF7 knockout (KO) egerek kisebb súlygyarapodást és zsírosodást mutattak, mint a vad típusú kontrollok. Az IRF7 KO javította a glükóz és lipid homeosztázist és az inzulinérzékenységet. Ezenkívül az IRF7 KO enyhítette az étrend által kiváltott máj steatosist. Ezután értékeltük az IRF7 KO egerek gyulladásos állapotát a HFD-n. Ezek az egerek kevesebb szervbe beszivárogtak a makrofágokba, és védettek voltak a helyi és szisztémás gyulladásoktól. Ez a tanulmány bemutatja az IRF7 szerepét az étrend által kiváltott energia-anyagcserében és az inzulinérzékenységben. Eredményeink azt is sugallják, hogy az IRF7 részt vesz a metabolikus rendellenességek etiológiájában, ami új stratégiát javasol az elhízás és a 2-es típusú cukorbetegség kezelésére.
Az interferon (IFN) α és az IFNβ, együttesen I. típusú IFN-ként ismertek, a gazdaszervezet vírusfertőzések elleni immunválaszának fő közvetítői (14, 31). Az IFN szabályozó tényezők (IRF) egy transzkripciós faktor család, amely kilenc tagból áll (IRF-1 - IRF-9) emlősökben (36). A legtöbb IRF részt vesz a veleszületett immunitásban és a kórokozók elleni védekezésben (1, 17). Az IRF7-et először olyan tényezőként azonosították, amely látens fertőzés során kötődik az Epstein-Barr vírus EBNA1 Q promóteréhez (46). Ezt követően kiderült, hogy az IRF7 az I. típusú IFN-függő immunválaszok fő szabályozója (18). Az I. típusú IFN-ek különböző sejttípusokban indukálhatják az IRF7 expresszióját (40). Az elsősorban a citoplazmában található IRF7 foszforilezhető vírusfertőzés és Toll-szerű receptor-függő szignalizáció hatására. Ezután áttelepül a magba, hogy aktiválja az I. típusú IFN transzkripcióját, pozitív visszacsatolási hurok létrehozásával (40). Az IRF7 arról számolt be, hogy a tumor immunfelügyeleti mechanizmusainak aktiválásával elnyomja az emlőrák áttétjét (2). Az IRF családtagok szabályozhatják a hematopoietikus sejtek differenciálódását és szaporodását, ami ezeket a transzkripciós faktorokat bevonja a fejlődésbe és az onkogenezisbe (36).
Több közelmúltbeli bizonyíték arra utal, hogy az IRF-ek részt vesznek az anyagcserében. Korábbi munkánk megállapította, hogy az IRF9 kölcsönhatásba lép a peroxiszóma proliferátor-aktivált receptor (PPAR) -α-val a NAFLD csillapítására (42). Az IRF3-ról beszámoltak az anyagcserével kapcsolatos nukleáris receptorok, például a máj X receptor (LXR) és a retinoid X receptor α (4, 8) szabályozásáról. Egy másik csoport azt találta, hogy az IRF-ek szabályozzák az adipogenezist és a lipid anyagcserét az adipocitákban (10, 11). Az IRF-ek szisztémás hatása az anyagcserére azonban nagyrészt ismeretlen. Ebben a tanulmányban arra törekedtünk, hogy azonosítsuk az IRF7 metabolikus szerepét az elhízásban, és új perspektívát adjunk az anyagcserezavar kezelésére.
Állatok és diéták.
A C57BL/6 [vad típusú (WT)] egereket és az IRF7 kiütési (KO) egereket (C57BL/6 háttér, Dr. Tadatsugu Taniguchi, Tokiói Egyetem, Japán) szívesen látta el 12: 12 órás könnyű sötét ciklus a vízhez való szabad hozzáféréssel és a rágcsálók szokásos étrendjével a vizsgálat megkezdése előtt. Csak 8 hetes hím egereket használtak kísérletekhez. Az egereket véletlenszerűen két csoportra osztottuk: egy HFD csoportot, amely ad libitum táplálkozott magas zsírtartalmú étrenddel (60% kcal zsír, D12492; Research Diets), és egy NC csoportot normál chow étrenddel (10% kcal zsír, D12450B); Diéták) a következő 24 hétig. Kilenchetes nőstény ob/ob egereket a Jackson Laboratory-ból szereztük be (készletszám: 000632). ob/ob az egereket ad libitum-mal etettük standard rágcsáló-chow étrenddel. Az összes protokollt a Wuhani Egyetem Renmin Kórházának állatgondozási és felhasználási bizottsága hagyta jóvá.
Anyagcsere vizsgálatok.
A táplálékfelvételt hetente rögzítették. A testtömeg és az éhgyomri glükózszintet 4 hétenként mértük. Valamennyi egeret 6 órán át (8:00 és 14:00 óra között) éheztettük a szérum glükóz tesztje előtt. Vérmintákat kaptunk a farokvégi erekből. A vércukorszintet glükométerrel (One Touch Ultra Easy; Life Scan) detektáltuk. A szérumban lévő reprezentatív metabolitok és inzulin szintjét 8 hétenként teszteltük. Az egereket dietil-éter inhalációjával érzéstelenítettük, és a vért orbitális szúrással gyűjtöttük össze. Az összegyűjtött vért 4000 fordulat/perc sebességgel 30 percig 4 ° C-on centrifugáltuk, majd a későbbi elemzés céljából -80 ° C-on tároltuk. A trigliceridek (TG), az összes koleszterin (TC), a nagy sűrűségű lipoprotein (HDL) -koleszterin (C), a kis sűrűségű lipoprotein (LDL) -C, nem észterezett zsírsav (NEFA) és a β-hidroxi-butirát koncentrációja a a szérumot kereskedelmi készletekkel (Wako és Abcam) határoztuk meg. A szérum citokineket a RayBio (Norcross, GA), az MBL (Woburn, MA), az Invitrogen (Camarillo, CA), a Peprotech (Farmingdale, NY) és az R&D (Minneapolis, MN) cégektől beszerzett ELISA készletekkel mértük a gyártók beszámolói szerint. utasítás. Az éhomi szérum inzulinszintet inzulin ELISA készlettel (Millipore, Billerica, MA) mértük. Az inzulinrezisztencia (HOMA-IR) index homeosztázis-modelljének értékelését [éhomi vércukorszint (mmol/l) × éhomi inzulin (mIU/l)]/22,5. 23 és 24 hét HFD vagy NC táplálás után glükóz tolerancia tesztet és inzulin tolerancia tesztet hajtottak végre. Az egereket 6 órán át éheztettük, mielőtt glükózzal (1 g/testtömeg-kg; Sigma-Aldrich, St. Louis, MO) vagy inzulinnal (0,75 E/testtömeg-kg; Novolin R; Novo Nordisk, Bagsvaerd, Dánia) intraperitoneális injekciót adtunk volna. . Vérmintákat vettünk a farokvégi erekből az injekció beadása előtt, valamint 15, 30, 60 és 120 perccel a glükóz vagy inzulin beadása után.
Szövetfeldolgozás.
Az egereket 3% pentobarbitál-nátriummal altattuk a makroszkopikus képrögzítéshez, majd megöltük. A májszövetet, a zsigeri zsírszöveteket (beleértve az epididymális fehér zsírszöveteket (WAT), a mesenterialis zsírszövetet és a perirenalis zsírszövetet), valamint a gastrocnemius izmokat összegyűjtöttük és megmértük. A szöveteket azonnal folyékony nitrogénben lefagyasztották a valós idejű PCR és Western blot elemzésekhez. Szövettani elemzés céljából ezt a három típusú szöveget vagy Tissue-Tek OCT vegyülettel (Sakura; Finetek Japán, Tokió, Japán) fagyasztották szárazjégben, vagy 10% -os formalinnal rögzítették, majd paraffin beágyazás céljából feldolgozták. A máj steatosisának mértékének értékeléséhez a beágyazott máj paraffin szakaszokat (5 μm) és a fagyasztott szakaszokat (10 μm) festették hematoxilinnel, illetve eozinnal (H&E), illetve Oil red O-val (Sigma). Az adipociták hipertrófiájának kimutatására a paraffinba ágyazott epididymális WAT szakaszokat (5 μm) H&E-vel festettük. A digitális képeket fénymikroszkóppal rögzítették (Olympus, Tokió, Japán). Egyetlen adipocita területét mértük Image-Pro Plus (6.0 verzió) alkalmazásával, és 500 adipocitát használtunk a statisztikai elemzéshez. Az adatokat minden csoportra legalább három egérből nyertük.
Máj lipid mérések.
Minden mintához 50 mg májszövetet extraháltunk lipidmérés céljából. A TG, TC és NEFA szintjét a májszövetben kitek (Wako, Osaka, Japán) segítségével határozták meg, az előzőekben leírtak szerint (20).
Immunfluoreszcens festés.
A paraffinba ágyazott fagyasztott máj- és gastrocnemius izomszelvényeket (4 μm) és epididymális zsírszövet-szakaszokat (5 μm) használtuk immunfluoreszcens festésre. Nyúl anti-egér IRF7 antitestet (Santa Cruz Biotechnology, Santa Cruz, Kalifornia) alkalmaztunk az IRF7 expressziójának értékelésére. Patkány anti-egér 7/4 antitestet (Abcam, Cambridge, Egyesült Királyság), patkány anti-egér CD45 antitestet (BD, San Jose, Kalifornia) és patkány anti-egér CD68 antitestet (AbD, Oxford, Egyesült Királyság) használtunk a pan leukociták, neutrofilek és a gyulladásgátló M1 típusú makrofágok. Gyulladásgátló M2 makrofágokat patkány anti-egér CD206 antitesttel (AbD) és egér anti-argináz 1 antitesttel (BD) detektáltunk. DAPI-t (Invitrogen) alkalmaztunk az atommagok kimutatására.
Western blot.
A fehérjéket epididimális zsírszövetekből (200 mg/minta), a májszövetből (60 mg/minta) és a gastrocnemius-izomszövetből (150 mg/minta) extraháltuk RIPA lízispuffer segítségével [RIPA (720 μl) 20 μl fenilmetilszulfonilot tartalmaz] fluorid (P7626; Sigma), 100 μl Complete (04693124001; Roche), 100 μl Phosstop (04906837001; Roche), 50 μl NaF és 10 μl Na3VO4. A RIPA (100 ml, pH = 7,5) 0,7882 g Tris-HCl-t, 0,8766 g NaCl-ot, 1 ml Nonidet P-40-t, 0,5 g nátrium-deoxi-cholátot, 0,1 g SDS-t és 0,0292 g EDTA-t tartalmaz. A Western-blotokat a korábban leírtak szerint dolgoztuk fel (9, 23). A fehérje szinteket mennyiségileg meghatároztuk és normalizáltuk a terhelés kontroll GAPDH-val. Az ebben a vizsgálatban használt antitesteket a Cell Signaling Technology (Danvers, MA), a Santa Cruz Biotechnology, a Bioworld Technology (Minneapolis, MN), a Millipore és az Abcam cégektől szereztük be.
RNS izolálás és valós idejű PCR.
A teljes RNS-t extrahálták epididymális zsírszövetekből, májszövetből és gastrocnemius izomszövetből TRIzol reagenssel (Roche, Mannheim, Németország). A cDNS-t egy Transcriptor First Stand cDNS szintézis készlettel (Roche) szintetizáltuk. A valós idejű kvantitatív PCR-t egy Light Cycler 480 SYBR Green I Master (Roche) segítségével, a Light Cycler 480 valós idejű PCR-rendszer alkalmazásával, a gyártó utasításainak megfelelően (Roche) végeztük. A célgének expressziós szintjét β-aktinná normalizáltuk.
Statisztikai analízis.
Az adatokat átlag ± SE-ként fejezzük ki. Az összes statisztikai elemzést kétfarkú Student-ek végezték t-teszt vagy egyirányú ANOVA, majd Fisher legkevésbé szignifikáns eltérési eljárása a post hoc teszteléshez. A P érték 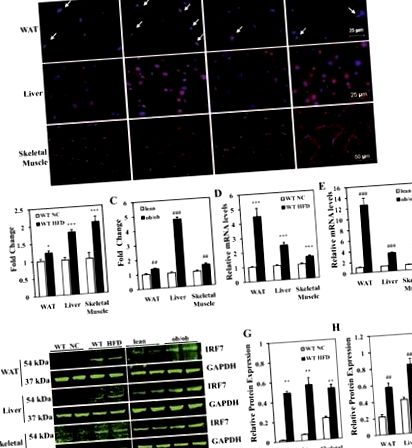
1. ábra.Az interferon szabályozó faktor 7 (IRF7) expressziója az inzulin célszervekben. A: az IRF7 (vörös) reprezentatív immunfluoreszcens expressziója az inzulin célszervekben: fehér zsírszövet (WAT), májszövet, vázizom (gastrocnemius izom) C57BL/6 egerekben [vad típusú (WT)] és ob/ob egerek. A WT egerek normál chow étrendet (NC) vagy magas zsírtartalmú étrendet (HFD) fogyasztottak 24 hétig. ob/ob az egereket és sovány kontrolljaikat (normál chow-on WT) standard rágcsáló-chow-táplálékkal etettük 9 hétig. Minden csoport négy szekciót tartalmazott a festés elemzéséhez. A nyilak a pozitív sejteket jelzik a WAT-ban. A mérlegsávok 25 μm (WAT), 25 μm (máj) és 50 μm (vázizom) állványok. B és C: az IRF7-pozitív sejtek relatív mennyiségi meghatározása WAT-ban, májszövetben és vázizmokban. Az adatok átlag ± SE; n = 4 egér. *P
Az IRF7 KO egerek csökkent súlygyarapodást és zsírosodást mutattak HFD-n.
2. ábra.Az IRF7 knockout egerek csökkent súlygyarapodást és zsírosodást mutattak egy HFD-n. A: a testtömeg-növekedés összehasonlítása WT vagy irf7 -/- (KO) egerekben a 24 hetes NC vagy HFD táplálással; n = 15–22/csoport. ###P
Az IRF7 KO javítja a glükóz és lipid homeosztázist, valamint az inzulinérzékenységet.
1. táblázat: A szérum metabolizmus paraméterei változóak a diéta kezelés megkezdése alatt és 24 hét után mind WT, mind KO egerekben
Az adatokat átlag ± SE-ként fejezzük ki; n, nem. egerek. NC, normál chow; HFD, magas zsírtartalmú étrend; WT, vad típusú; KO, kiesés; HDL, nagy sűrűségű lipoprotein; LDL, alacsony denditású lipoprotein; FFA, szabad zsírsav.
## P ** P
4. ábra.Az IRF7 knockout egereket megvédték a diéta okozta máj steatosis ellen. A: a HFD-vel táplált WT és KO egerek májának makroszkopikus képei. B: a máj tömegének és a testtömeghez viszonyított arányának meghatározása; n = 15–31/csoport. C: H&E-vel festett reprezentatív májszakaszok (tetejére) vagy olajvörös O (alsó) WT vagy KO egerekben 24 hét NC vagy HFD táplálékkal. A skálasávok 100 μm-t képviselnek. D: a triglicerid (TG), a koleszterin és a nem észterezett zsírsav (NEFA) szintjét kivontuk a májszövetből WT-ben KO egerekkel a HFD-n; n = 4-5/csoport. E: a májszövet zsírsavszintézisében, felvételében, lipogenezisében, lipolízisében és zsírsav oxidatív, koleszterin szintézisében és kiáramlásában részt vevő gének mRNS szintje; n = 6–12/csoport. Valamennyi értéket átlag ± SE értékben fejezzük ki. Ban ben B, D, és E, ##P
Az IRF7 KO egereket védjük az étrend okozta gyulladás ellen.
2. táblázat: Szérum gyulladásos citokinszintek WT és KO egerekben 24 hetes diétás kezeléssel
Az adatokat átlag ± SE-ként fejezzük ki; n, nem. egerek. MCP-1, monocita kemotaktikus protein-1.
## P ** P
5. ábra.Az IRF7 knockout egereket megvédték az étrend okozta gyulladástól. A: az F4/80 makrofág marker és a proinflammatorikus M1 típusú makrofágok mRNS szintjét valós idejű PCR-rel vizsgáltuk; n = 6–12/csoport. B: a gyulladásgátló M2 típusú makrofágok markereinek mRNS-szintjét valós idejű PCR-rel vizsgáltuk; n = 6–12/csoport. C: az NF-κB jelátviteli aktiválást immunblotolással jeleztük. D: a fehérje expressziós változásainak számszerűsítése átlag ± SE; n = 4/csoport. Ban ben A, B, és D, *P
Ebben a tanulmányban kimutatták, hogy az IRF7, az I. típusú interferon-függő immunválaszok fő szabályozója (18) mind az étrendi, mind a genetikai elhízott egerekben több szövetben növekedik. Az IRF7 teljes test KO egerek felhasználásával azt találtuk, hogy az IRF7 kritikus szerepet játszik az elhízás és a cukorbetegség kialakulásában. A HFD-n a WT egerek kompromittált energiaszabályozó funkciókat és jelentősen elhízott fenotípust mutattak be. Azonban az IRF7 KO egerek, még krónikusan HFD-vel fertőzve is, szinte intakt glükóz- és lipid homeosztázist, ellenállást mutattak az étrend okozta máj steatosis ellen, kevesebb adipozitást és viszonylag normális fizikai megjelenést mutattak. A máj ER stresszét, valamint a lokális és szisztémás gyulladást szintén gyengítették az IRF7 KO egerekben a WT egerekhez képest. Ezért az IRF7 célzása elősegítheti az energiamérleg fenntartását és az anyagcsere-betegségek megelőzését.
Bár túlsúlyuk a veleszületett immunválaszban és az onkogenezisben rejlik, az IRF családtagjairól jelenleg úgy gondolják, hogy szabályozza az energia-anyagcserét is. Eguchi és mtsai. számoltak be arról, hogy az IRF-ek szabályozzák az adipogenezist, és tovább azonosították az IRF4 anti-adipogén tulajdonságait (10, 11). Az IRF4-től eltérően, amelynek expressziója erősen korlátozódik a zsírszövetre és az immunsejtekre, az IRF7 széles körben elterjedt. Megerősítettük a diéta okozta elhízás, inzulinrezisztencia, ER stressz és gyulladás csillapítását IRF7-hiányos egerekben. Bár a mögöttes mechanizmus nem teljesen ismert, azt javasoljuk, hogy az IRF7 hiány metabolizmus javító hatásait részben a PPARγ közvetítheti. Eredményeink feltárják az IRF7 sokoldalú szerepét az anyagcserében, és új kapcsolatot javasolnak az immunitás és az anyagcsere között. A jövőbeni munkák középpontjában az IRF-ek szabályozása, valamint azok szabályozási funkciói és az IRF-család különböző tagjai közötti kölcsönhatás állhat. Összefoglalva, az IRF7 célzása remélhetőleg új stratégiává válik az elhízás és a kapcsolódó anyagcserezavarok kezelésében.
Ezt a tanulmányt a Kínai Nemzeti Természettudományi Alapítvány (81100230 és 81070089 sz.), A Nemzeti Tudományos és Technológiai Támogatási Projekt (2011BAI15B02 és 2012BAI39B05 sz.) És Kína Nemzeti Alapkutatási Programja (2011CB503902 sz.) Támogatta.
A szerzők nem jelentenek összeférhetetlenséget.
Xin-An Wang tervezte és hajtotta végre a kísérleteket, elemezte az adatokat és megírta a kéziratot; Ran Zhang írta a kéziratot; Shumin Zhang, Shan Deng, Dingsheng Jiang, Jinfeng Zhong, Li Yang, Tao Wang, Sen Guo végezte a kísérleteket; Shufen Hong elemezte az adatokat; Zhi-Gang Ő, Hsziao-Dong Zhang hasznos tanácsokat nyújt és segít a kéziratok felülvizsgálatában; Hongliang Li (a levelezés szerzője) kísérleteket tervezett és megírta a kéziratot.
KÖSZÖNETNYILVÁNÍTÁS
Köszönetet mondunk Dr. Tadatsugu Taniguchinak (Tokiói Egyetem, Japán) az IRF7 kieső egerek biztosításáért, és köszönjük a RIKEN BRC-nek, hogy az IRF7 kieső egereket szállította a The MEXT Japan Nemzeti Bio-Resource Projektjén keresztül.
- A GABA transzamináz gátlása az elhízás okozta hiperinsulinémia és inzulinrezisztencia enyhítésére -
- Az inzulinrezisztencia és az éhség a gyermekkori elhízásban A beteg és az orvos perspektívája
- A bél mikrobioma és szerepe az elhízásban és az inzulinrezisztenciában - Lee - 2020 - Annals of the New York
- Az interleukin-6 hiánya megkönnyíti a szívizom diszfunkcióját a magas zsírtartalmú étrend okozta elhízás során
- Inzulinrezisztencia gyermekkori elhízás esetén - élettani hatások és lehetséges diétás kezelés -