Bélmozgás
A bélmozgás olyan módon szerveződik, hogy a szervnek elegendő ideje legyen a szükséges tápanyagok felszívására a bevitt ételből, majd a fennmaradó tartalmat lefelé szállítsa az ileumba és a vastagbélbe.
Kapcsolódó kifejezések:
- Szekréció (folyamat)
- Fehérje
- Hasmenés
- Székrekedés
- Bél
- Emésztőrendszeri traktus
- Gyomorürítés
- Vékonybél
Letöltés PDF formátumban
Erről az oldalról
NEKROTIZTIKUS ENTEROCOLITIS
Marion C. W. Henry, MD, MPH, R. Lawrence Moss, MD, Ashcraft Gyermeksebészetében (Ötödik kiadás), 2010
Bélmozgás és emésztés
A bélmozgás általában a terhesség harmadik trimeszterében alakul ki, de lehet, hogy csak a terhesség nyolcadik hónapjában érik meg teljesen. A bélmozgás mechanikai hatása nemcsak az emésztést segíti elő, hanem az epitheliális gát integritásának első lépéseként is szolgál azáltal, hogy korlátozza az anyag mennyiségének érintkezésének idejét az enterociták felületével. Koraszülötteknél az éretlen bélmozgás a hám megnövekedett potenciálisan káros anyagoknak való kitettségéhez vezet, rossz baktériumtisztítással és az azt követő baktériumok elszaporodásával. Ezenkívül az éretlen belekben csökkent a tápanyagok emésztése és felszívódása, ami az alacsonyabb pH-szint révén közvetlen hámkárosodáshoz vezethet. 23-25
Más vizsgálatok szerint a megnövekedett ileális epesavszint szerepet játszhat a NEC patogenezisében. Az epesavak felhalmozódása a bél lumenében és az enterocitákban az ileális epesavat megkötő fehérje éretlen szintjének tudható be, amely döntő fontosságú az epesavak enterocitán és portális keringésen történő szállításához 26, valamint ezek elnyomásához. epesav transzporterek proinflammatorikus citokinek, például tumor-nekrózis faktor-a (TNF-a) révén. 27-29 A NEC két másik kockázati tényezője is hozzájárulhat a kóros epesavszintek kialakulásához. A tápszeres táplálás mérgezőbb epesavakat vált ki, mint a szoptatás, 30 és a másodlagos epesavak képződése, amelyeket NEC-ben szenvedő állatoknál találtak, baktériumok által kiváltott dekonjugációt igényel. 31
Táplálkozás és anyagcsere a súlyos betegségben szenvedő, szívbetegségben szenvedő gyermeknél
Aaron L. Zuckerberg, MD, Maureen A. Lefton-Greif PhD, kritikus szívbetegség csecsemőknél és gyermekeknél (második kiadás), 2006
Bélmozgási hormonok (gasztrin és motilin)
Az enterális táplálás után a bélmozgás fokozódik. A gasztrointesztinális gasztrin, neurotenzin és motilin peptidek modulálják a bél motoros aktivitását. Az intragasztrikus táplálékok gyorsan növelik a gasztrin és a motilin plazmaszintjét. A kizárólag parenterálisan táplált csecsemőknél a plazmaszint nem emelkedik hasonlóan. Azonban 1 ml/óra enterális takarmányok hozzáadása jelentősen megnöveli a plazma gasztrinszintet. 85 Újszülött patkányokban a plazma gasztrin táplálkozásból eredő emelkedése párhuzamos a táplálkozás által kiváltott trofikus változásokkal a bél nyálkahártyájában. A plazma gasztrin hasonló változásai figyelhetők meg a nasojejunális táplálékok során. 85
A zebrafish: sejt- és fejlődésbiológia, B. rész
Iain Shepherd, Judith Eisen, a Sejtbiológia módszereiben, 2011
A bélmozgás szabályozása
A bélmozgás három különböző sejtpopuláció, az ENS, a Cajal intersticiális sejtjei (ICC-k) és a bél simaizmai koordinált aktivitásából adódik (Furness, 2006; Rich et al., 2007). Az élő zebrafish lárvákban a mozgékonyság közvetlen leképezésének képessége (Holmberg és mtsai, 2003, 2004, 2006, 2007; Kuhlman és Eisen, 2007) feltárta a bélmozgás mintáinak bonyolultságát in vivo. Az első spontán összehúzódások körülbelül 3,5 nappal a termékenyítést követően (dpf) jelentkeznek a zebrafish bélben (Kuhlman és Eisen, 2007), jóval az 5–6 dpf-os táplálkozás megkezdése előtt (Olsson et al., 2008). A legkorábbi összehúzódások fókuszosak, de 4 dpf-vel kezdenek terjedni a bél mentén, és az összehúzódások szabályossága a következő néhány napban növekszik (Holmberg et al., 2006, 2007; Kuhlman és Eisen, 2007). Mielőtt a lárvák táplálkozni kezdenek, rendszeres anterográd és retrográd összehúzódások terjednek a középső bél közös pontjáról. Az elülső bélben lévő retrográd összehúzódások keverhetik az ételt, kompenzálva a gyomor hiányát, míg a hátsó összehúzódások elsődlegesen meghajtónak tűnnek. A bél hátsó része szintén rövid összehúzódási hullámokat terjeszt mindkét irányba (Holmberg et al., 2004).
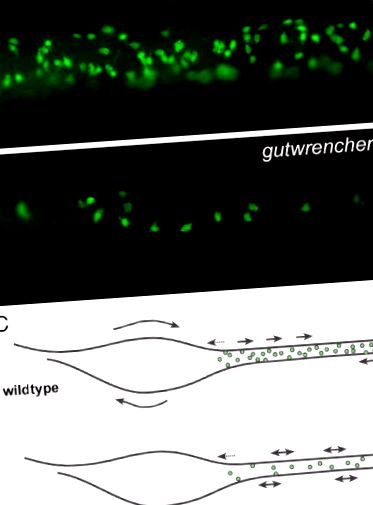
4. ábra a gutwrencher mutánsoknak kevesebb az ENS neuronja és kevésbé szabályos a bélmozgása, mint a vad típusoknak. (A-B) Az 5,5 dpf vad típusú (A) bél középső részének Elavl-festése és a gutwrencher mutáns (B) lárvák azt mutatják, hogy a gutwrencher mutánsoknak kevesebb az enterális neuronja. (C) Az enterális neuronok száma és a GI motilitása közötti összefüggést bemutató vázlat. A kikelt nyilak spontán, fokális összehúzódásokat mutatnak. A hosszú nyilak a kontrakciós hullámok irányát mutatják. A zöld pontok enterális neuronokat képviselnek. Kuhlman és Eisen (2007) szerkesztette John Wiley és Sons, Inc. engedélyével (Az ábraszínben a színre történő hivatkozások értelmezéséhez az olvasót a könyv webes változatára kell utalni.)
A zebrafish-ban spontán bélösszehúzódások megindítását az ICC-k közvetíthetik. Az ICC-k kiemelkedően expresszálják a Kit receptor tirozin-kinázt, és mezodermális eredetűek (Lecoin és mtsai., 1996), ugyanazokból a prekurzorokból származnak, mint a bél simaizomsejtjei (Young, 1999). Az ICC-k ingerlő jeleket generálnak, amelyek vezérlik a bél simaizmainak összehúzódását és koordinálják az idegsejtek bemenetét (Furness, 2006). Ez a sejttípus jelen van a zebrafish-ban, bár az ICC-ket a 7 dpf előtti szakaszokban nem detektálták Kit antitestfestéssel (Rich et al., 2007), így jelenleg nem ismert pontosan, hogy ezek a sejtek mikor fejlődnek zebrafish-ban. Azonban az ENS-hez hasonlóan az ICC-k is elengedhetetlenek az egerek legkorábbi bélmozgásához, ezért Young és munkatársai azt sugallják, hogy a legkorábbi bélösszehúzódások valószínűleg myogének lehetnek (Roberts et al., 2010). Sem az ICC aktivitást, sem a bél izomzatának myogén aktivitását nem vizsgálták zebrafish-ban, így nyitva hagyva a legkorábbi összehúzódások eredetének kérdését. Az ENS működésének teljesebb elemzéséhez technikák kifejlesztése szükséges az elektrofiziológiai felvételhez az ENS idegsejtjeiből, ICC sejtjeiből és bélizmaiból.
Gasztrointesztinális traktus és a máj és az epeutak csatornarendszere
67.3.2.6 Funkcionális és embriológiai szempontok
A bél mobilitását három különféle enterális idegfonat szabályozza: az Auerbach myentericus plexus, a muscularis propia kör- és hosszanti izomrétege között, valamint a submucosalis régióban található két plexus, a Meissner felületes submucosalis plexus, közvetlenül a muscularis nyálkahártya alatt., és Henle mély submucosalis plexusát. Az intramuralis bélganglion sejtek a cefalis neurális címerből az embriogenezis 6. és 12. hete között vándorolva jutnak el az emésztőrendszerbe. Ez meghatározott idõszekvenciában történik, koponya – caudalis gradienssel (74–77). 5 hetes terhesség esetén a párosodott vagális rostok a nyelőcső felső részéig terjednek, de a ganglion sejtek még mindig hiányoznak. A 6. héten neuroblasztok vannak jelen a nyelőcsőben a körrétegen és a gyomoron kívül. 8. héten (18 mm-es embrió) ganglionsejtek vannak a vékonybélben és a végbélben, de a vastagbélben nem. 12 hetes korban (70 mm) a teljes plexust innerválják, feltehetően további caudalis ganglionsejtek vándorlásával. Úgy tűnik, hogy a legkritikusabb időszak a 8. és 12. hét között van, amikor a disztális plexus nagy része kialakul.
Azok a neuroblasztok, amelyek először jutnak el a tápcsatornához, alkotják a mienterikus plexust. A submucosalis plexust a myentericus plexusból a körkörös izomrétegen át a submucosa felé vándorló neuroblasztok alkotják (76). A submucosalis plexus farokirányban is kialakul, de később, a terhesség 3. és 4. hónapjában. A külső hosszanti izomréteg az embrionális mesenchymalis szövetből fejlődik ki, miután a myentericus plexus a 12. héten kialakult (76). A vagális idegrostok látszólag közvetlen szerepével ellentétben a szimpatikus és a kismedencei parasimpatikus idegek nem vesznek részt az intramuralis plexus kialakulásában.
Az intramuralis intesztinális ganglion sejtek prekurzor sejtjei az ideggerincből származnak. Innen vándorolnak a belekbe, és differenciálódnak a normális idegsejtek hálózatába, az összes fázis különböző gének ellenőrzése alatt áll. Például úgy gondolják, hogy a migrációhoz és a differenciálódáshoz elegendő RET-expresszió szükséges az érintett sejtek felületén. A bélganglion sejtek kudarca az idegcsontról történő vándorlásban vagy a bélfalban történő szaporodásában, differenciálódásában és fennmaradásában számos genetikai okból ered, amelyeket együttesen neurokrisztopátiának neveznek (78). Mivel más sejttípusok is az idegi címerből származnak, érthetővé válik a Hirschsprung-kór és más neurokrisztopátia-szindrómák együttes előfordulása. Ezek a további sejtek szenzoros ganglionok, szimpatikus idegsejtek, az autonóm idegrendszer parasimpatikus idegsejtjei, endokrin és paraendokrin sejtek (pajzsmirigy C-sejtek, mellékvese medulla, carotis sejtek), pigment sejtek és craniofacialis mesectodermák (áttekintés céljából lásd: Irodalomjegyzék (40,117)).
Mágneses rezonancia képalkotás és spektroszkópia
3.11.2.2.4 Motilitási vizsgálatok
Gasztrointesztinális motilitási eljárások
Felszerelés
A vékonybél motilitásának tesztjei elvégezhetők szilárdtest nyomásmérőkkel, impedancia érzékelőkkel vagy perfúziós katéterekkel. 1 A katéterek konfigurációja testreszabható, de a minimálisan ajánlott rögzítési portok tartalmaznak egyet az antrumban és hármat a vékonybélben. 1 A duodenális és jejunalis portok távolsága a beteg életkorától függően változik, a portok között 3 és 10 cm közötti tartományban van. Gyermekeknél 3 cm, serdülőknél pedig 5 cm távolság elegendő. A folyamatos monitorozás fontos azoknál a betegeknél, akik perfúziós rendszereket használnak a vizsgálatok során, hogy elkerüljék a folyadéktúlterhelést, különösen csecsemőknél és kisgyermekeknél. A perfúzió sebessége portonként általában 0,1 és 0,4 ml/perc között változik. A koraszülött és a fiatal csecsemők vizsgálatának perfúziós arányát csökkenteni kell, és egyes egységek beszámoltak a perfúzió sebességéről, amely mindössze 0,01-0,02 ml/perc. 52,53 A felnőtt laboratóriumok többsége desztillált vizet használ, de a legtöbb gyermekközpont 0,2 - félig normális sóoldatot vagy orális hidratációs oldatokat 1,54 használ a hiponatrémia elkerülése érdekében. Az orális hidratáló oldatok helyett sóoldatokat javasolunk, hogy elkerüljük a rendszer eldugulását a glükózmaradványoktól és a baktériumok szaporodását az orális hidratáló oldatok szénhidráttartalmától.
Autonóm idegrendszer: Gasztrointesztinális kontroll
Víz és elektrolitok szekréciója
A bélmozgáshoz hasonlóan a víz és az elektrolitok kiválasztása a bél lumenébe elengedhetetlen az emésztéshez, és közvetlenül az ENS irányítja. Az idegi aktivitás blokádja a víz és a só nettó felszívódásához vezet. Számos, ideg által közvetített szekréciós reakciót azonosítottak a fiziológiai ingerekre, ideértve a bélfal meghúzódását és a nyálkahártya mechanikai deformációját. Ezenkívül a hasmenést termelő toxinok, például a kolera toxin, a hőre labilis Escherichia coli enterotoxin és a hőstabil E. coli enterotoxin A típusú hiperszekréció kritikusan függ az enterális idegi aktivitástól, annak ellenére, hogy ugyanazok a toxinok közvetlenül aktiválják a nyálkahártya enterocitáit elősegíti a szekréciót.
3. táblázat A VIP szekretomotoros neuronok bemeneti forrásai
| Myenterialis neuron | Gyors EPSP | ACh | Nikotinikus |
| Submucous neuron | Gyors EPSP | ACh | Nikotinikus |
| Myenterialis neuron | Gyors EPSP | ATP | P2X |
| Myenterialis neuron | Lassú EPSP | ATP | P2Y1 |
| Myenterialis neuron | Közbenső EPSP | ATP | P2Y1 |
| Submucous neuron | Lassú EPSP | ?VIP? | Ismeretlen |
| Myenterialis neuron | IPSP | Szomatosztatin | Ismeretlen |
| Szimpatikus ganglion sejtek | IPSP | Noradrenalin | α2-adrenoreceptor |
ACh, acetilkolin; ATP, adenozin-5′-trifoszfát; EPSP, gerjesztő posztszinaptikus potenciál; IPSP, gátló posztszinaptikus potenciál; P2X, P2Y1, purinerg; VIP, vazoaktív bélpeptid.
- Liraglutid - áttekintés a ScienceDirect témákról
- Magas fruktóz tartalmú étrend - áttekintés a ScienceDirect témákról
- Magas fruktóztartalmú kukoricaszirup - áttekintés a ScienceDirect témákról
- Limfoid hiperplázia - áttekintés a ScienceDirect témákról
- Mallory Body - áttekintés a ScienceDirect témákról