Biomarkerek a gluténmentes étrend betartásának monitorozására celiakia esetén
María de Lourdes Moreno
1 Departamento de Microbiología y Parasitología, Facultad de Farmacia, Universidad de Sevilla, c/Profesor García González 2, 41012 Sevilla, Spanyolország; se.su@oneroml (M.d.L.M); se.su@ramuosc (C.S.)
Alfonso Rodríguez-Herrera
2 Unidad de Gastroenterología y Nutrición, Instituto Hispalense de Pediatría, 41013 Sevilla, Spanyolország; moc.airtaidepphi@zeugirdorosnofla
Carolina Sousa
1 Departamento de Microbiología y Parasitología, Facultad de Farmacia, Universidad de Sevilla, c/Profesor García González 2, 41012 Sevilla, Spanyolország; se.su@oneroml (M.d.L.M); se.su@ramuosc (C.S.)
Isabel Comino
1 Departamento de Microbiología y Parasitología, Facultad de Farmacia, Universidad de Sevilla, c/Profesor García González 2, 41012 Sevilla, Spanyolország; se.su@oneroml (M.d.L.M); se.su@ramuosc (C.S.)
Absztrakt
1. Bemutatkozás
A glutén a búza, az árpa, a rozs és a zab vízben oldhatatlan fehérjéinek összetett keveréke, amelyek károsak a lisztérzékenységben szenvedők számára. A glutén kifejezés magában foglalja a prolaminokat (a búzában található gliadinokat) és a glutelineket (a búzában található glutenineket). A prolaminok, az alkoholban oldódó fehérjék komplex csoportja alkotják a gabonafélék fő magfehérjét, és az érett gabonamagvakban található fehérjék körülbelül 50% -át teszik ki. Egyéb gluténfehérjék, amelyek azt mutatják, hogy analóg immunogén tulajdonságok vannak az árpában (hordeinek), a rozsban (szekalinok), a zabban (aveninek) és más, egymással szorosan rokon szemcsékben is [1,2,3]. Ezek a fehérjék gazdag prolin- és glutaminmaradványokban, ellenállóvá teszik őket a gyomor-bél emésztésével szemben, és ösztönzik a szöveti transzglutamináz (tTG) általi dezaminálást.
A lisztérzékenység (CD) immunmediált szisztémás rendellenesség, amelyet genetikailag fogékony egyének glutén bevitele vált ki. A lakosság körülbelül 1% -át érinti, és a bél és az extraintesztinális tünetek, a lisztérzékenységre jellemző antitestek, a HLA-DQ2/DQ8 haplotípusok és az enteropathia változó kombinációján alapul.
Napjainkig a CD alappillére az egész életen át tartó szigorú gluténmentes étrend (GFD). Általános egyetértés van abban, hogy a CD-ben szenvedő betegek szigorú GFD-betartása teljes szövettani és klinikai remissziót, javul az életminőséget és csökkenti a hosszú távú szövődményeket [4,5,6]. Ezáltal a GFD szigorú betartása a csontsűrűség [7,8,9,10] jelentős javulásához, valamint a vitaminok (pl. Többek között a B12-vitamin) és az ásványi anyagok normalizálásához vezet, bár néha kiegészítőkre lehet szükség az optimális szint eléréséhez [ 11].
Az élelmiszerek gluténtartalmát a Codex Alimentarius szabályozza [12]. Ez a rendelet (CODEX STAN 118–1979, átdolgozva 2008-ban) kimondja, hogy a gluténmentes ételek azok, amelyekben a glutén összes szintje ≤20 ppm [3]. Gluténmentes gabonafélék, például rizs, hajdina, kukorica és köles helyettesíthetik a gluténtartalmú gabonaféléket. Néhány hüvelyes, például amarant, quinoa és szójabab, különösen magas fehérjetartalma és minősége miatt. Sőt, a nem feldolgozott élelmiszerek, mint hal, hús, baromfi, tojás, zöldségek és gyümölcs ajánlott a GFD betartásának elősegítése és az étrend tápértékének biztosítása érdekében [13].
Bár fogalmilag egyszerűek, az étrend változásai jelentősek és mély hatást gyakorolnak a beteg életére. Valójában vannak olyan akadályok, amelyek a GFD-vel kapcsolatosak, mint például a gluténmentes ételek elérhetősége, költsége és biztonsága, vagy a glutén keresztszennyeződése [14,15]. A megbecsült arányok jelentősen eltérnek (17% –80%), többek között olyan tényezőktől függően, mint a beteg kora vagy a CD diagnózisának kora [16,17,18,19]. A gyenge étrendi betartás negatívnak bizonyult más autoimmun betegségek [20,21], termékenységi problémák [22,23,24] és a csonttörés [25] vagy a lymphoma [26,27] fokozott kockázata szempontjából. Ezenkívül a GFD elfogadása után a CD-betegek 4–30% -a tartós tünetekről számolt be, és úgy vélik, hogy őket a nem reagáló CD (NRCD) befolyásolja [6]. Azonban ezeknek az NRCD-betegeknek csak 10% -a rendelkezik refrakter CD-vel (RCD), mivel ez az akaratlan vagy szándékos glutén-expozíció a leggyakoribb oka az NRCD-nek [28].
A CD-vel és a GFD monitorozásával kapcsolatos legújabb szakirodalom értékelése érdekében tudományos szakirodalmat kutattak a GFD-megfelelésről és a CD-ről szóló legújabb publikációk után. Ezen frissítések alapján ennek a cikknek az a célja, hogy bemutassa és megvitassa a GFD-ben szenvedő betegek nyomon követésére rendelkezésre álló eszközök jelenlegi koncepcióit.
A keresést a PubMed MEDLINE és SCOPUS adatbázisokban végeztük. A következő keresési kifejezéseket használták: „lisztérzékenység és gluténmentes étrend”, „követő lisztérzékenység”, „gluténmentes étrend monitorozása” és „celiakia kezelése”. A kulcsszavak: „tünetek és cöliákia”, „biopszia és cöliákia”, „szerológiai teszt és cöliákia”, „kérdőív és cöliákia”, „étrendi interjú és cöliákia”, „ürülék és cöliákia”, valamint „vizelet és cöliákia ”is alkalmazták.
2. A gluténmentes étrend betartásának ellenőrzése
2.1. Tünetértékelés
A kezdeti tünetek vagy az újonnan kifejlesztett tünetek nyomon követése a CD javulásának és evolúciójának ellenőrzésére szolgál. A bélbél tüneteiről beszámoltak a GFD-hez nem ragaszkodó CD-s betegeknél (valószínűségi arány 2,69; 95% -os konfidenciaintervallum 0,75–9,56), hét vizsgálat metaanalízise szerint, amelyen több mint 3000 alany vett részt [33]. Bár látszólag intuitívnak tűnik, a klinikai válasz nem lehet egyetlen módszer a GFD betartásának ellenőrzésére, mivel a cöliákia nagy része tünetmentes vagy minimálisan tüneti a bemutatáskor, és ezekben az esetekben nem lenne lehetséges a klinikai választ a nyálkahártya indikátoraként használni. gyógyulás és a GFD betartása [34]. A glutén okozta fertőzés hatásait vizsgáló kontrollált tanulmány megállapította, hogy a tünetek a cöliákia betegek 22% -ában hiányoztak, annak ellenére, hogy a vékonybél biopsziában jelentős villous atrófia volt jelen [35].
2.2. Validált felmérések és étrendi interjúk
A dietetikus vagy elkötelezett orvos felelős a dietetikai felülvizsgálatért. Az étkezési gyakoriságot és az ön által bejelentett GFD betartását értékelő számos kérdőív mellett van egy vizuális analóg pontszám skála, amely egy jelölés nélküli sorból áll, a „Soha nem tartom be az étrendemet” és „Mindig betartom az étrendemet” horgonymondatokkal. mindkét végén [36,37,38,39,40,41]. Ennek ellenére a diéták felülvizsgálatához nem áll rendelkezésre minőségellenőrzés vagy szabvány a helyi étrend és szokások miatt, amelyek egy speciális strukturált interjút céloznak meg az étrend minőségével kapcsolatban. A mai napig nincsenek tanulmányok a GFD felülvizsgálati eredményeiről a különböző országokban, és nincs bizonyíték arra, hogy a megfelelő felülvizsgálat más eszközöket (például biopsziát) pótolhatna a nyálkahártya károsodásának előrejelzésére. Ezenkívül az egyének hajlamosak pontatlanul beszámolni betartási szintjükről, akár szándékosan, akár nem, hogy a diétás felülvizsgálat szubjektív lehessen, és ne azonosíthassa az akaratlan jogsértéseket [42,43].
2.3. Biopsziák
Az objektív kvantitatív morfológiai paramétereken alapuló osztályozásokat, például a magasság-kriptamélység és gyulladásos változók mérését, például az IEL-ek sűrűségét megfelelő protokollal üdvözöltük. Taavela és mtsai. [53] ezeket a kvantitatív morfológiai és gyulladásos változásokat értékelte a károsodás különböző mértékének felmérésében, hogy meghatározza a határértékeket, amelyeket a rutin klinikai gyakorlatban alkalmaznak a CD-n. Az IEL-ek szövettani és immunológiai kutatásokkal történő altípusba helyezését, valamint az áramlási citometria és/vagy immunhisztokémia felhasználását az IEL-ek vizsgálatához kiemelt fontosságúnak találták a CD diagnosztizálásában és nyomon követésében [54,55,56] . A gluténérzékenység Marsh-Oberhuber besorolásának kritériumaként alkalmazott proximális vékonybélben az IEL felső normális határának arányát 40 IEL-ben határozták meg 100 hámsejtenként (EC) [57]. A legutóbbi tanulmányok szerint azonban a proximális vékonybélben a normál felső határ alacsonyabb volt, mint 20 IEL/100 EC öt villa csúcsain a hematoxilin-eozinnal festett szakaszokon és 25 IEL/100 EC immunhisztokémiai módszerrel, vékonyabb metszetek alkalmazásával. 3 µm és 4 µm metszetek és CD3 immunhisztokémia [58].
Annak ellenére, hogy az endoszkópiákat biopsziák összegyűjtésére és a nyálkahártya gyógyulásának értékelésére használják, ez egy invazív, drága és nem praktikus eljárás a betegség aktivitásának vagy súlyosságának gyakori ellenőrzésére [59]. A biopsziával nehezen ellenőrizhető és értékelhető esetek egy része azért van, mert enyhe szövettani változásaik vannak, vagy hiányzik a szerológia és a szövettan közötti összhang. Ezért örvendetes az a gondolat, hogy a CD nyomon követése során át kell értékelni a biopsziára mint aranystandardra helyezett hangsúlyt, a rendelkezésre álló kevésbé invazív tesztek fényében. Beszámoltak arról, hogy a nyombél nyálkahártyájának teljes helyreállítása egy éven át tart, az IEL-ek még a celiakia diagnózisa után 2–5 évvel is gyakoriak [60]. Egyes szakértők rutinszerűen nem végeznek nyomon követési biopsziát olyan tünetmentes betegeknél, akiknek negatív a szerológiája és jó tapadásuk van [61]. A bélnyálkahártya gyulladása azonban jóval a klinikai tünetek kialakulása vagy az antitest-titerek növekedése előtt jelentkezhet gluténfertőzés után. Másrészt az NRCD-ben szenvedő betegeknél, akiknek nincs szigorú GFD-re adott klinikai válaszuk, meg kell ismételniük a biopsziát és a további vizsgálatokat [62]. Ezért nincs egyetértés a nyomon követési biopsziák szerepével kapcsolatban [18,44].
2.4. Szerológiai tesztek
2.5. Egyéb jelölők
Más tanulmányok megfelelő étrend-monitorozásra javasolták a permeabilitási tesztet, a széklet kalprotektint, a REG Iα-t vagy a közelmúltban a plazma összes alkil-resorcinolt [71,72,73,74]. Számos tanulmány azonban beszámolt arról, hogy ezek a tesztek nem csak a CD-re jellemzőek, hanem korlátozott hatékonyságúak a nem komplikált CD diagnosztizálásában is [75,76,77]. Két másik marker a bél-zsírsavat megkötő fehérje (I-FABP), az enterocita károsodását tükröző marker és a citrullin, a funkcionális enterocita tömeg marker [64], de nem specifikusak a CD-re, ezért nem tesznek különbséget egy cöliákia relapszus vagy más emésztőrendszeri rendellenességek a betegben.
A hasnyálmirigy szekréciós granulátum membrán glikoprotein 2 (GP2), különösen az IgA izotípus elleni autoantitesteket kimutatták Crohn-betegségben szenvedő és nemrégiben CD-ben szenvedő betegeknél. Anti-GP2 antitest pozitivitású CD-betegeknél ez a marker használható a bélgyulladás indikátoraként és a nyomon követéshez. A CD-t azonban meg kell különböztetni a Crohn-kórtól a CD-specifikus EMA vagy anti-tTG párhuzamos tesztelésével [78,79].
Nemrég Ryan és mtsai. [80] jelentős potenciális eszközként áttekintette a CD diagnózisához és prognózisához kapcsolódó metabolomikát. Három fő komponens (malabszorpció, energia-anyagcsere és a bél mikrobiota változásai) azonosítása a mátrixokban, mint például a szérumok, a vizelet és az ürülék, különösen érdekes volt a CD metabolomja szempontjából. A felszívódási zavarok különböző vegyületei (csökkent aminosav-, lipid-, piruvát- és kolinszint a lisztérzékenységben szenvedő betegek szérumában), más komponensek az energia-anyagcseréhez (magasabb a glükóz és a 3-hidroxi-vajsav szintje a szérumokban) és harmadszor: azok, amelyek a bél mikrobiotájának és/vagy a bélpermeabilitásának megváltozásához kapcsolódnak, mint magasabb vizeletben levő indoxil-szulfát, meta- [hidroxi-fenil] propionsav és fenil-acetil-glicin szintjei [81,82].
2.6. Glutén immunogén peptidek (GIP) kimutatása
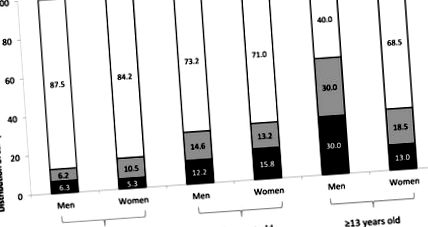
A cöliákia betegek százalékos megoszlása az ürülék GIP-tartalma szerint életkor és nem szerint. GIP, glutén immunogén peptidek. GIP pozitív (> 0,30 µg GIP/g ürülék, fekete sáv), gyenge pozitív (0,16–0,30 µg GIP/g ürülék, szürke sáv) és negatív (25 mg az alsó határnak megfelelő, hogy a legtöbb cöliákiás beteg károsodjon. GIP A gluténbevitel után 6–48 órával a vizeletmintákban kimutatták a módszert. A módszertan kimutatta a CD-ben szenvedő betegek magas szintű nem megfelelőségét, akik állítólag GIP jelenléte révén hosszú távú GFD-t fogyasztottak (felnőtteknél 48, illetve gyermekeknél 45% Ezek az eredmények összhangban voltak az ezt bemutató jelentésekkel
30% –50% folytatja a nyálkahártya atrófiáját CD-s betegeknél annak ellenére, hogy GFD-t követnek [5,104,105,106]. Érdekesebb, hogy közvetlen összefüggést mutattak ki a GIP hiánya a vizeletben és a bél bélhámjának gyógyulása között (2. ábra). A szövettani elemzés szerint továbbá az epitheliában (Marsh II/III) nagyobb károsodású felnőtt betegek 100% -ában GIP volt a vizeletben. Más fent említett tanulmányokkal [34,67,85] összhangban ez a tanulmány megerősítette a szerológiai vizsgálatok gyenge korrelációját a nyálkahártya gyógyulásával, valamint az étkezéstörténeti kérdőívek hiányosságait a GFD megfelelésének értékelésére.
GIP jelenléte felnőtt CD betegek vizeletében és összefüggés a vékonybél szövettanával. A nyálkahártya elváltozásának súlyossága (Marsh I – III) és szövettani megjelenése a Marsh skála alapján határozható meg. GIP negatív (fehér sáv), GIP hiánya a vizeletben; GIP gyenge pozitív (szürke sáv), a GIP vizuális jelenléte nem számszerűsíthető a vizeletben (> LDT QL). p = 0,0007 (Fisher pontos tesztje). Az értékeket a betegek százalékában fejezzük ki. CD, cöliákia; GIP, glutén immunogén peptidek; LDT, a technika kimutatásának határa; QL, számszerűsítési határ. Moreno és munkatársai szerint módosítva. [103].
A pontos, egyszerű és hatékony GFD-monitorozáshoz szükséges point-of-care eszközök kifejlesztése ösztönözte a rendkívül érzékeny felületi plazmon rezonancia bioszenzor létrehozását a GIP vizeletben történő kimutatására [107]. A könnyen kezelhető minták, például vizelet és felhasználóbarát bioszenzorok alkalmasak lehetnek a hordozható és egyszerű eszközökre a lisztérzékenységben szenvedő betegek GFD-megfeleléséhez. Soler és mtsai. [107] bebizonyította, hogy az érzékelési módszertan lehetővé teszi a vizeletben a GIP gyors és címke nélküli mennyiségi meghatározását G12 moAb alkalmazásával, elérve a kimutatási határértéket 0,33 ng/ml. Ez a tanulmány egyértelműen megkülönböztette a gluténfogyasztókat a nem fogyasztóktól azáltal, hogy több vizeletmintát mért mind egészséges (normál étrend), mind celiakia (GFD) alanyoktól. Ezért a bioszenzorok jelentős előnyöket kínálnak a hagyományos technikákkal szemben, lehetővé téve a biokémiai elemzést kiváló reprodukálhatósággal és nagy érzékenységgel percek alatt.
3. Következtetések és jövőbeli irányok
Köszönetnyilvánítás
Az IC-t a Contrato de Acceso al Sistema Español de Ciencia, a Tecnología e Innovación para El Desarrollo del Programa Propio de I + D + i támogatta a Universidad de Sevillától. Az MLM-et a Joy de Andalucía Proyecto de Investigación de Excelencia társult Contrato posztdoktor támogatta. Ezt a munkát a Ministerio de Ciencia, az Economía y Competitividad (AGL2013-48946-C3-2-R) és a FEDER alapok, a Corporación Tecnológica de Andalucía (Junta de Andalucía), az Agencia IDEA és az Asociación de Celíacos y Sensibles al gluten de támogatták. Madrid, Spanyolország).
Szerző közreműködései
Az összes szerző hozzájárult ennek a cikknek az elkészítéséhez.
Összeférhetetlenség
A szerzők nem jelentenek összeférhetetlenséget.
- Autizmus és gluténmentes étrend; Kanadai Celiac Podcast
- Gail Johnson 7 napos gluténmentes expressz étrend
- Allergia tej és szója felszámolási étrend Egészségügyi és táplálkozási tények a betegek számára; Családok
- 11 gluténmentes ösztönző ennek az étkezési tervnek a használatához Főzés könnyű étrend
- Egészséges étrend és testmozgás Fordított cukorbetegség a betegek több mint 60% -ában