c ‐ június N-terminális kináz szignálozás az alkoholmentes zsírmájbetegség patogenezisében: Több szerepkör több lépésben † ‡
Orvostudományi Kar, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia
Orvostudományi Kar, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia
Orvostudományi Tanszék, Kaliforniai Egyetem, San Diego, 9500 Gilman Drive, La Jolla, CA 92093 === A szerző további tanulmányainak keresése
Orvostudományi Kar, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia
Orvostudományi Kar, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia
Orvostudományi Tanszék, Kaliforniai Egyetem, San Diego, 9500 Gilman Drive, La Jolla, CA 92093 === A szerző további tanulmányainak keresése
Lásd a 86. oldalon található cikket
Lehetséges összeférhetetlenség: Nincs mit jelenteni.
A c-Jun N-terminális kináz (JNK) a mitogénnel aktivált protein-kinázok (MAPK) evolúciósan konzervált alcsaládjának tagja. A JNK különféle sejtreakciókat szabályoz, például differenciálódást, szaporodást, vándorlást, immunreakciót és sejthalált az extracelluláris ingerek sokféle tartományára adott válaszként. 1 A géntörlés és a farmakológiai beavatkozások azt mutatták, hogy a JNK jelátvitelre szükség van akut májsejtes sérülés, májregeneráció és karcinogenezis esetén. 2-7 Ezenkívül a JNK központi szerepet játszik az elhízásban és az inzulinrezisztenciában. 8 Ezért a JNK a nem alkoholos zsírmájbetegség (NAFLD) patogenezisében kulcsfontosságú szabályozóként hívta fel magára a figyelmet.
Rövidítések
AP-1, aktivátor fehérje-1; ASO, antiszensz oligonukleotid; ER, endoplazmatikus retikulum; FFA-k, szabad zsírsavak; IRS, inzulinreceptor szubsztrát; JNK, c-június N-terminális kináz; MAPK, mitogén-aktivált protein-kináz; NAFLD, alkoholmentes zsírmájbetegség; NASH, alkoholmentes steatohepatitis; NF-κB, nukleáris faktor-κB; TNF ‐ α, tumor nekrózis faktor ‐ α.
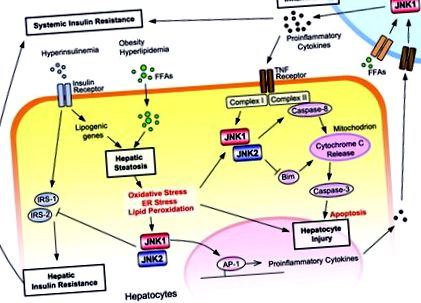
A JNK izoformák több szerepe a NAFLD patogenezisében. A szisztémás inzulinrezisztencia hátterében a hiperinsulinémia és a hiperlipidémia hozzájárul a máj steatosisának kialakulásához, de novo lipogenezis és fokozott FFA fluxus a májba. A steatosis okozta oxidatív stressz, az ER stressz és a lipidperoxidáció aktiválja a JNK-t. A JNK1 és a JNK2 egyaránt máj inzulinrezisztenciát okoz az IRS-1 és az IRS-2 szerin-foszforilezésével, míg csak a JNK1 indukálja a steatózist. Az oxidatív stressz és a proinflammatorikus citokinek a májsejtek károsodását a JNK aktiválásával közvetítik. A JNK1 és a JNK2 közvetve aktiválja a kaszpáz ‐ 8-at. A JNK2 citoprotektív funkciót is betölt, mivel gátolja az apoptózis Bim-függő mitokondriális útját. A JNK az AP ‐ 1-függő transzkripcióval elősegíti a gyulladás kialakulását. A JNK1 a gyulladásos sejtekben elősegíti a gyulladást.
Így mindkét JNK izoformának kritikus szerepe van az inzulinrezisztencia, a máj steatosis, a májkárosodás és a gyulladás minden egyes lépésében a NAFLD patogenezisében. Singh és mtsai. új betekintést nyújt a JNK izoformák működésébe a NAFLD patogenezisének több lépésében az ASO knockdown rendszer alkalmazásával a knockout egerek mellett. Különösen az a megállapítás, hogy a JNK1 abláció hatékony a kialakult inzulinrezisztencia és a máj steatosis kezelésében, míg a JNK2 abláció súlyosbítja a májkárosodást, rendkívül fontos a jövő terápiájának feltárása során. Ez riasztást vált ki a válogatás nélküli JNK gátlás miatt, és hangsúlyozza, hogy a JNK1 izoform szelektív gátlása nagyon hatékony kezelés lehet a NAFLD. Ugyanakkor új kérdések merülnek fel Singh és munkatársai kutatásai során. Hogyan szabályozzák a JNK izoformák a májban a lipogenezist? Kompenzálják-e egymást az izoformák, ha egyiküket leütik? Szükség van-e a sejtvonal-specifikus JNK1 ablációra a NAFLD terápiához? Az idő-specifikus és a sejtvonal-specifikus leütési rendszerek továbbfejlesztése választ ad ezekre a kérdésekre, és tovább terjeszti a JNK izoform-célzó terápia lehetőségét.
Köszönetnyilvánítás
Köszönjük Dr. Jerrold M. Olefsky, a Kaliforniai Egyetem, San Diego, a hasznos beszélgetéseket.
- Étrendi összetétel és alkoholmentes zsírmájbetegség SpringerLink
- Krónikus vesebetegség és alkoholmentes zsírmájbetegség - van-e összefüggés
- Az első nemzeti tanulmány a nem alkoholos zsírmájbetegség fokozódó járványát jósolja
- A széklet és a vér mikrobiota profiljai, valamint az alkoholmentes zsírmájbetegség jelenléte elhízottaknál
- Az étrendi lenmagolaj megakadályozza a nyugati típusú étrend okozta alkoholmentes zsírmájbetegséget