Exogén rekombináns emberi növekedési hormon hatása a szuboptimális energia- és cinkbevitel során
Absztrakt
Háttér
Az energia és a cink (Zn) hiányosságai összefüggenek a táplálkozással összefüggő növekedési retardációval, valamint a növekedési hormon (GH) rezisztenciával. Ebben a vizsgálatban meghatározták a szuboptimális energia és/vagy a Zn bevitel és növekedés közötti kapcsolatot patkányokban, valamint immunreaktív exogén rekombináns humán GH-ra (GHi) adott válaszukat.
Eredmények
A GHi-vel kezelt és ad libitum energiával táplált patkányok és a Zn (100/100) esetében az IGFBP-3 szintje megnőtt (p
Bevezetés
Noha a megfelelő energiafogyasztás nagy szerepet játszik a növekedésben, a mikrotápanyagok, mint például a Zn, szintén a növekedés és a GH hatásának alapvető szabályozói [22–24]. Megfelelő energiafogyasztással járó mély Zn-hiány gyakran társul növekedési kudarccal és késleltetett nemi éréssel, ami befolyásolja a sejtosztódást, a DNS, az RNS és a fehérjeszintézist [25, 26]. A cinkhiány csökkenti a máj GH-receptorainak, a szérum IGF-I, a GH-kötő fehérjék szintjét és mind a GH-receptorok mRNS-ét, mind az IGF-I szintjét [24, 26]. Továbbá, a tenyésztett patkány hepatocitákban a Zn kötése Zn kelátképző DTPA-val (dietilén-triamin-penta-ecetsav) nem csökkentette az IGF-I, GH receptorok vagy GH-kötő fehérjék mRNS-ét, míg a metallotionein gén expressziója erősen gátolt volt. Ezért úgy tűnik, hogy az in vivo Zn-hiányhoz kapcsolódó IGF-I csökkenése nem az extracelluláris Zn-koncentráció hepatocita-szintű változásainak tudható be [27]. Gyakran a Zn-hiány a csökkent energiafogyasztással jár [28, 29], és ezeknek a táplálkozási változásoknak önmagukban vagy egymással együttesen kifejtett hatása nem ismert. Továbbá, a GHi alkalmazásának patkányokban, kísérletileg indukált, optimális energiával járó hatása csökkent Zn bevitel mellett és anélkül sem tisztázott.
Ebben a cikkben beszámolunk az exogén GHi beadásának hatásairól a szuboptimális táplálkozás állatmodelljében, ahol az energia és/vagy a Zn bevitele a követelmények 30% -kal csökkent [5, 20, 21]. Célunk az volt, hogy meghatározzuk, vajon az exogén GHi beadás enyhíti-e az enyhe energia- és Zn-korlátozások káros hatásait külön-külön vagy egymással kombinálva. Feltételeztük továbbá, hogy enyhe tápanyag-korlátozásokkal csökkenteni fogják az energiafelhasználást és a fizikai aktivitást. Ezt egy új Enhanced Metabolic Testing Activity Chamber segítségével határoztuk meg.
Eredmények
A GHi hatása a súlygyarapodásra
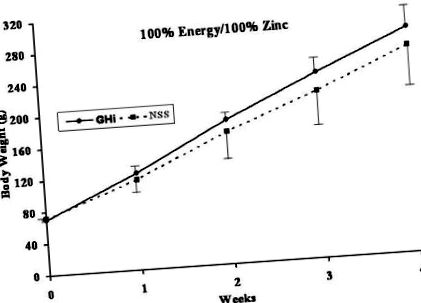
Valamennyi patkány egészséges volt a kísérlet során, nyilvánvaló betegség vagy fogyás nélkül. A GHi (folytonos vonalak) és az NSS (pontozott vonalak) adagolásának hatásait az egyes táplálkozási csoportokra a 3., 4., 5., 6. ábra mutatja.
A testtömeg-növekedésben nem találtak szignifikáns különbséget a kezelt GHi és az NSS kontrollcsoport patkányai között, akik 100% energiát/100% Zn-t adtak be (A diéta) (3. ábra). A 70% energia/100% Zn-t (B diéta) táplált és GHi-vel kezelt patkányok azonban szignifikánsan mutattak (p 3. táblázat: Hormonális profil enyhe energia és Zn-korlátozás után rhGH-val kezelt patkányokban
A kalória korlátozással járó anyagcsere-változások
Az NSS-vel kezelt patkányokhoz képest a GHi beadása nem befolyásolta a 24 órás energiafelhasználást és a fizikai aktivitás indexét egyik diétás kezelés során sem (4. táblázat). Az RQ azonban alacsonyabb volt a GHi-vel kezelt patkányokban, akik az ad libitum energia bevitel 70% -át táplálták. Energiafelhasználás (p 4. táblázat Patkányok metabolikus profilja enyhe energia- és cinkkorlátozás után
A GHi hatása a testösszetételre
A testösszetétel elemzését az 5. táblázat mutatja. Az FFM és a BF között nem volt szignifikáns különbség a GHi és NSS csoportok között, függetlenül az étrendi kezeléstől. Azonban NSS-kontrolljukhoz képest a GHi-vel kezelt és bármelyik energiával korlátozott étrenddel táplált patkányok Zn-hiány nélkül (B és D diéta) szignifikánsnak mutatkoztak (p 5. táblázat: A test összetétele tetemelemzéssel enyhe energia- és cinkkorlátozás után.
Vita
A csökkent testtömeg-növekedésről korábban beszámoltak enyhe szuboptimális energiafogyasztáskor patkányoknál, akiket az ad libitum energia bevitelének 60 és 80% -ával tápláltak [5]. Ezek a megállapítások azt mutatták, hogy az energiafogyasztás 40% -os csökkentése a kontroll szint 61% -ával csökkentette a súlygyarapodást egy négy hét alatt. Ha figyelembe vesszük, hogy a jelen vizsgálatban a csökkent energiatartalmú étrenddel táplált patkányok mindegyike kezeléstől vagy Zn-szinttől függetlenül, az energiafogyasztás 30% -os csökkenése a testtömeg-növekedés 40% -os csökkenését eredményezte az összes kontrollállathoz képest.
Korábban kiderült, hogy a korlátozott táplálékkal (60% energia) táplált patkányoknak adott GHi fokozott kumulatív súlygyarapodást eredményezett az NSS kontrolljukhoz képest, míg az IGF-I és az IGFBP-3 szintje megemelkedett [20]. Eredményeink megerősítik, hogy a GHi> 18% -kal növelte a testtömeg-növekedést, ha a patkányokat nem optimálisan etették (az étrendi energia 30% -kal csökkent). A testtömeg-különbségek főleg az energia korlátozásához kapcsolódtak. A Zn-korlátozott patkányokban nem volt nyilvánvaló testtömeg-különbség, amennyiben az energiafogyasztás megfelelő volt.
Az IGF-I és az IGFBP-3 szérumkoncentrációk növekedése egyértelműen összefüggésben állt a GHi hatásával korlátozott energiájú patkányokban. Adataink azonban nem mutattak különbséget a szérum IGF-I és IGFBP-3 koncentrációkban enyhe izolált Zn-restrikcióval. Így a csökkent Zn bevitel csak akkor befolyásolta a GHi hatását az IGF-I és az IGFBP-3 szérumkoncentrációkban, ha az energiafogyasztás egyidejűleg korlátozott volt, ami arra utal, hogy nincs szerepe a Zn optimális alatti bevitelének. Lehetséges, hogy a Zn csökkentése a követelményeknek csak 70% -ára, megfelelő energiával nem elegendő ahhoz, hogy jelentős hatást gyakoroljon a vizsgált hormonális paraméterekre. Szükség lehet az étrendi Zn további csökkentésére, mielőtt az IGF-I-re vagy az IGFBP-3-ra gyakorolt hatás megfigyelhető lenne. Például a megfelelő energiával táplált patkányok Zn-hiánya gyengén nőtt, és csökkent szérum IGF-I, GH receptor számokat és GH kötő fehérjéket mutatott [26]. Továbbá mind az IGF-I, mind a GH receptorok génexpressziója csökkent volt, ha Zn-hiányos, megfelelő energiájú étrendet tápláltak [24].
Összességében a rekombináns humán növekedési hormon terápia csökkenti a szénhidrát felhasználást, az összes anyagcsere terhelést a lipid anyagcserére irányítva [30, 31]. Sőt, a testmozgásnak, a normális növekedésnek, az étrendi bevitelnek [31] és magának a GH-nak alapvető szerepe van a testösszetételben [32–35]. Például a GHi adagolása, elősegítve a lipidek hasznosulását, csökkenti az összes testzsírt. Vizsgálatunkban részben energiakorlátozott állatunk a testtömeg-gyarapodás enyhe növekedését mutatta a GHi-kezeléssel. Ezenkívül a légzési hányad enyhe csökkenését tapasztaltuk a GHi alkalmazásával azoknál a patkányoknál, akik energiatakarékos étrendben voltak. Ez arra utal, hogy a GHi-kezelés a metabolikus terhelést a lipogenezishez kapcsolja, amint azt egy korábbi tanulmány megállapította [31, 37]. Továbbá a GHi hatását nem befolyásolta a korlátozott Zn bevitel, mindaddig, amíg az energia bevitel nem volt korlátozva.
A beadott GH mennyiségének változó hatása lehet a patkányok testösszetételére. Például a kutatók két korábbi vizsgálatban minimális változásokat találtak a testzsírban és a zsírmentes tömegben azoknál a patkányoknál, akik ad libitummal tápláltak és 0,05 vagy 0,10 mg/100 g testtömeg GHi-t adtak be naponta [20, 21]. Ez arra utal, hogy ad-libitum vagy enyhe energiakorlátozás esetén a 0,10 mg/100 g testtömeg alatti vagy annál alacsonyabb GHi-kezelés nem változtatja meg a zsírmentes tömeg mennyiségét a testzsírhoz viszonyítva. Lehetséges, hogy a GHi nagyobb dózisa kiváltja ezeket a hatásokat. Például a testzsír jelentősen csökkent a hasonlóan táplált patkányokban, ha napi 0,35 mg/100 g testtömeg GHi-t adtak be nekik [37]. Ráadásul az egész test tetemet elemző módszertan nem biztos, hogy elég érzékeny ahhoz, hogy a patkányokban a testzsír finom változását kimutassa az ebben és a hasonló vizsgálatokban alkalmazott alacsonyabb GHi dózisoknál [20, 21]. Ezt bizonyítja az energiafogyasztás és a fizikai aktivitás indexének változásának hiánya azoknál a patkányoknál, amelyeket ad-libitum vagy energiatakarékos táplálékkal etettek és 0,1 mg/100 g testtömeg GHi-vel kezeltek.
Ebben a tanulmányban az energiakorlátozás a 24 órás energiafelhasználás és a fizikai aktivitás index csökkenését eredményezte patkányokban. Ezeket a változásokat a GHi-kezelés nem befolyásolta. Ez arra utal, hogy a metabolikus adaptációk a nem optimális energiafogyasztás miatt következtek be. Mások hasonló metabolikus és biokémiai változásokat találtak a szuboptimális energiafogyasztással kapcsolatban. Például csökkent az eritrocita NaK-ATPáz értéke azoknál a gyermekeknél, akiknél diagnosztizálták a táplálkozási eltörpülést, a szuboptimális táplálkozás egyik formáját, amely hosszabb ideig fennáll [8]. Az eritrocita NaK-ATPáz hasonló csökkenését találták az energiakorlátozott étrendet fogyasztó patkányoknál is [5]. Sőt, az anyagcsere sebessége és a fizikai aktivitás csökkent, ha a patkányokat energiatakarékos táplálékkal etették [43]. Mindezen tanulmányok eredményei [5, 8, 20, 21, 37] arra utalnak, hogy a metabolikus adaptációk enyhe energiakorlátozással kezdődnek.
A növekedés lassulása, az azt követő növekedési kudarc és az alacsony termet a tartósan szuboptimális táplálkozás legfigyelemreméltóbb következményei [1–5]. Bár a megfelelő energiafogyasztásnak döntő szerepe van a növekedésben, sok más mikroelem jelentős szerepet játszik a növekedés szabályozásában és a növekedési hormon működésében. Ezenkívül kiterjedt állat- és emberkutatások már megállapították az összefüggést az energiakorlátozás, a súlyos Zn-hiány és a növekedési kudarc között. Ezért az emelkedett növekedési hormon szintet, a csökkent IGF-I, IGFBP-3 és inzulinszint mellett súlyos energia- és Zn-korlátozásokkal írták le [10–18, 22–26].
Az alultáplált emberek száma nőtt, míg a patkányoknál csökkent a növekedési hormon szérumszintje [38]. Az éhező patkányokban a növekedési hormon szint csökkenését a szomatotropint felszabadító gátló hormon megnövekedése vagy a hipotalamusz szomatotróf sejtek növekedési hormont felszabadító hormon általi csökkent stimulációja okozhatja [39]. Továbbá megállapították, hogy a szérum leptin szerepet játszik a növekedési hormon csökkenésében patkányokban [40]. Az éhező patkányokban azonban a szérum inzulin növekedési faktor-1 (IGF-I) termelése továbbra is érzékeny a növekedési hormon szintjére [41]. Korábbi vizsgálatokban validáltuk a patkánymodellt különböző kezelések teszteléséhez szuboptimális táplálkozás során [5, 20, 21].
A növekedési retardáció a legtöbb domináns megállapítás a hagyományos Zn-hiányvizsgálatok közül sokban [24–29]. Korlátozott információ áll rendelkezésre azonban a szuboptimális Zn bevitel hatásairól [42], és senki sem vizsgálta a GHi beadásának hatásait kísérleti szuboptimális Zn korlátozás alatt. Így vizsgálatunk kimutatta a testtömeg-növekedést elősegítő GHi terápiát a szuboptimális Zn bevitel ellenére. Következésképpen, ellentétben ezeknek a súlyos Zn-hiányt magában foglaló vizsgálatoknak a legtöbbjével, adataink arra utalnak, hogy a Zn másodlagos szerepet játszik abban az esetben, amikor a Zn bevitele csak a napi szükséglet 70% -ára korlátozódott, a megfelelő energia bevitel fenntartása mellett. A súlygyarapodás mellett egyéb GHi metabolikus hatások is elérhetők voltak, például az IGF-I és az IGFBP-3 szintek növekedése a Zn-korlátozás során, ha megfelelő energiabevitelhez kapcsolódik.
Következtetés
Eredményeink azt mutatják, hogy a GHi jótékony hatásai enyhe energiakorlátozás során érhetők el. Ezenkívül az enyhe Zn-korlátozás nincs negatív hatással a testtömeg-növekedésre. A növekedési hormonterápia elősegíti a testtömeg-gyarapodást az enyhe energia- és Zn-korlátozások ellenére, anélkül, hogy az anyagcserére és a fizikai aktivitásra gyakorolt nyilvánvaló hatással lenne. Végül, az energia és a Zn bevitel enyhe kombinált korlátozása alatt nem tapasztalható additív hatás a Zn és az energia között.
Anyagok és metódusok
Negyven, pubertás előtti, két hetes hím Sprague-Dawley patkányt vizsgáltak négy héten keresztül a Miami Florida Florida Kórház Kutatóintézetében. Az állatokat külön-külön huzalfenékkel ellátott rozsdamentes acél ketrecekben helyezték el, elkerülve a koprofágia kialakulását. A kísérleti tervet az 1. ábra szemlélteti. A patkányokat 12 órás világos/sötét ciklusban tartottuk 7: 00-kor. 10 Sprague-Dawley hím patkányból álló négy csoportot négy különböző kiegyensúlyozott, tisztított 1: 1 szénhidráttal tápláltak zsírtartalmú étrendbe (Purina Mills Test Diets, Richmond, IN), az energiához és a Zn-hez igazítva az alábbiak szerint [50]:
- A növekedési hormon felszabadító hormon hatása a zsigeri zsír-, anyagcsere- és kardiovaszkuláris indexekre
- Az L-triptofán hatása a sovány férfiak rövid távú táplálékfogyasztására - ScienceDirect
- A cikória gyökérpor hatása a brojlerben a jejunum növekedési teljesítményére és hisztomorfometriájára
- A hasonló energiatartalmú szilárd és folyékony étkezést helyettesítő termékek hatása az éhségre,
- A cink - magnézium - aszpartát (ZMA) kiegészítésének hatása a képzési adaptációkra és a