Az elhízás és a metabolikus szindróma kezelése a széklet mikrobiota transzplantációjával
Clarisse A. Marotz
orvosbiológiai doktori program, Kalifornia Egyetem, San Diego, La Jolla, Kalifornia
Amir Zarrinpar
b Gasztroenterológiai osztály, Kaliforniai Egyetem, San Diego, La Jolla, Kalifornia
Absztrakt
A metabolikus szindróma, amely magában foglalja az elhízást és a kapcsolódó betegségeket, világszerte gyorsan növekszik. Az emberi bél mikrobiomját a gazdaszervezet anyagcseréjének egészsége és betegségei független környezeti modulátoraként ismerik el. Állatmodellekkel végzett kutatások bebizonyították, hogy a bél mikrobioma funkcionálisan képes metabolikus szindróma kiváltására vagy enyhítésére. Az emberi bél mikrobiomjának módosításának egyik módja az, ha az élő mikroorganizmusok rengetegét tartalmazó székletanyagot transzplantálják az egészséges egyéntől a betegig a betegség enyhítésének reményében. Itt áttekintjük a széklet mikrobiota transzplantáció (FMT) hatékonyságát állatmodellekben és emberekben az elhízás és a kapcsolódó anyagcserezavarok kezelésében.
Bevezetés
Az elmúlt fél évszázadban az elhízás és az ahhoz kapcsolódó anyagcserezavarok, például a 2-es típusú cukorbetegség (T2D), az alkoholmentes zsírmájbetegség és a hiperkoleszterinémia előfordulása drámaian megnőtt. Ezek a betegségek együttesen indokolatlan terhet jelentenek az egészségügyi ellátás költségeire, valamint jelentős morbiditásra és halálozásra. Míg ezek a betegségek összekapcsolódnak az emberi genetikával és az életmód megváltozásával, az emberi bél mikrobiomjának vagy a bélben élő mikroorganizmusoknak és kollektív genomjaiknak ma már felismert szerepet játszanak az anyagcsere-egészségügyben és a betegségekben [1,2]. Milliárd különféle szervezet, köztük baktériumok, gombák, archeák és vírusok fejlődtek együtt, hogy az emberi bélben éljenek [3]. Ezek a kommenzális organizmusok tartalmazzák a bél mikrobiomját, és kollagén genomjuk, amelyet metagenomának neveznek, több mint százszoros génszámot tartalmaz, mint gazdájuk [4]. Bizonyos metagenomikus minták összefüggenek az elhízással, valamint más fenotípusokkal [5]. Ezek a minták reagálnak az egyedek súlyváltozására [6], ami arra utal, hogy a bél mikrobiomjának modulálása dinamikusan korrelál az emberi gazda metabolikus fenotípusával.
A bél mikrobiota sokféleképpen megváltoztatható, beleértve a probiotikumokat (a gazdaszervezet számára előnyös nem patogén organizmusok), a prebiotikumokat (a kommenzális organizmusok növekedését és/vagy aktivitását kiváltó vegyi anyagok) és a széklet mikrobiota transzplantációját (FMT) [7]. . Noha számos vizsgálatban beszámoltak a probiotikumok jótékony hatásairól, egyik sem mutat változást a széklet mikrobiota összetételében [8]. Az FMT viszont jelentős változásokat okoz a széklet mikrobiota összetételében [9]. Az FMT mint potenciális terápia hosszú múltra tekint vissza. A bél mikrobiotájának FMT-vel történő megváltoztatásának sikeres gyakorlatát egészséges és beteg egyedről először a 4. században rögzítették súlyos hasmenés kezelésére [10]. A közelmúltban a randomizált, kontrollált klinikai vizsgálatok elképesztő sikereket mutatnak a visszatérő, refrakter Clostridium dificile fertőzés (CDI) esetében. Több tanulmány több mint 90 százalékos hatékonyságról számolt be, amely a hagyományos terápiánál drámaibbul sikeresebb a visszatérő CDI feloldásában [11]. Állati és emberi modellek legújabb bizonyítékai azt sugallják, hogy az FMT terápiás beavatkozásként is alkalmazható az elhízás ellen [12,13]. Ebben az áttekintésben állapotfrissítést közölünk az FMT szerepéről az elhízás és a kapcsolódó anyagcserezavarok kezelésében.
A bél mikrobiota és a gazdaszervezet anyagcseréje
Míg az egyének közötti mikrobiota összetétel drámaian változhat, addig a bakteriális funkcionális génprofilok konzervált halmaza minden egészséges egyénnél jelen van, ami a mikrobiomnak szerepet játszik a bél fiziológiai működésében [1,14,15]. Ennek a komplex fiziológiai baktériumpopulációnak a negatív funkcionális kimenetelekkel vagy betegséggel járó, diszbiózusként ismert változásai alacsony szintű gyulladást és megváltozott bélháztartást okozhatnak. A diszbiózis számos betegséghez kapcsolódik, beleértve az elhízást és az ezzel járó anyagcserezavarokat [16].
A székletanyagátültetés módszertana
Jelenleg az FDA csak a visszatérő CDI-t hagyta jóvá FMT-terápiában anélkül, hogy új vizsgálati (IND) jóváhagyásra lenne szükség. Ezért az FMT-betegek többségét súlyos CDI-vel kezelték. Ezeknek az egyéneknek nem sikerült az ismételt antibiotikum-kezelés, és kevés terápiás lehetőségük maradt. Ezenkívül az FMT-t tanulmányozták gyulladásos bélbetegségben (IBD), mivel ennek a betegségnek az etiológiája - legalábbis részben - a dysbiosis következménye. Azonban kevés ellenőrzött, randomizált vizsgálat történt IBD-s betegeknél, és nincs bizonyíték arra, hogy az FMT javítaná a klinikai eredményeket. Összességében az FMT-t elsősorban beteg embereknél végezték, akiknek nagy a kockázata a szövődményeknek. Ezért az elhízással vagy metabolikus szindrómával rendelkező, viszonylag egészséges betegek potenciális kockázata és szövődményei hipotetikusan alacsonyabbak maradnak a refrakter, visszatérő CDI vagy IBD betegeknél végzett korábbi vizsgálatokhoz képest.
Bár az FMT viszonylag könnyen elvégezhető, a módszertanban nagy az intézmények közötti változatosság. Például az FMT-re való felkészülés során egyes intézmények többszörös doxiciklint vagy vankomicint adnak pácienseiknek a natív, diszbiotikus populáció csökkentése érdekében [29]. Számos intézményben, közvetlenül az FMT előtt, a betegek tipikusan polietilénglikol-vastagbél-készítményt kapnak, hogy növeljék annak lehetőségét, hogy az átültetett mikrobiom sikeresen megtelepítse a bélet, függetlenül attól, hogy az FMT-t a felső emésztőrendszerbe vagy kolonoszkópiával vezetik be. Nincs azonban publikált bizonyíték arra vonatkozóan, hogy ez a készítmény javítaná az FMT klinikai eredményeit [22].
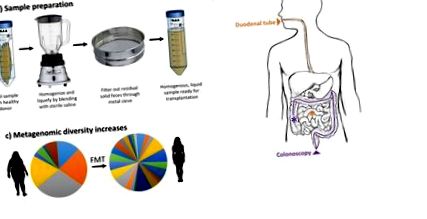
A széklet anyagának transzplantációra történő feldolgozása nem szabványosított, és az optimális hatékonyság érdekében kísérletileg validálni kell. Az általános igazgató azonban többé-kevésbé egyetemes. Amint az 1. ábrán vázoltuk, az adományozott székletet először sóoldattal összekeverjük, hogy folyékony mintává homogenizáljuk, majd szűrjük, hogy eltávolítsuk az átültetést zavaró szilárd ürüléket. A székletanyag feldolgozásának egységesítése érdekében a vizsgálatok összehasonlították a fagyasztott és a friss székletminták hatékonyságát a feldolgozás és az átültetés előtt. Ezek a vizsgálatok egyelőre nem mutattak szignifikáns különbséget az elsődleges eredmények között [30,31]. Míg a vizsgálatok 16s rRNS-szekvenálást végeztek a feldolgozás előtt és után a minta veszteségének értékelése céljából, a széklet anyag 99% anaerob fajt tartalmaz, amelyek nem biztos, hogy túlélik az erőteljes aerob keverést [32,33]. Továbbá a 16s rRNS szekvenálás nem különbözteti meg az életképeseket az elhalt sejtektől. Mindazonáltal az FMT-ből a CDI-betegek kezelésében elért rendkívül sok pozitív eredmény arra utal, hogy vagy a sejtek életképessége viszonylag jelentéktelen, vagy hogy a túlélő sejtek kis része elegendő ahhoz, hogy megváltoztassa a befogadó mikrobiómáját és terápiás hatását.
A széklet Microbiota transzplantáció vázlata. A) A donor ürüléket sóoldattal elegyítjük és fémszitán átszűrjük, hogy homogén folyékony oldatot kapjunk. B) A feldolgozott ürülék mikrobiotát vagy nyombélcsövön keresztül, vagy kolonoszkópiával szállítják. C) A metagenomikus sokféleséget mutató reprezentatív adatok az FMT-t követően nőnek a sovány donortól az elhízott recipiensig.
A feldolgozott székletanyagot tipikusan kolonoszkópiával vagy duodenális csővel/felső endoszkópiával juttatják a beteg gyomor-bél traktusába (1B. Ábra). Míg a bejuttatás útja tanulmányonként gyakran változik, a CDI kezelésére szolgáló szállítási módszerek között statisztikailag szignifikáns különbséget nem jelentettek [11,34]. Ezt a megállapítást továbbra is érvényesíteni kell más betegségek, például IBD vagy elhízás kezelésére. Ettől függetlenül fontos figyelembe venni az egyes lehetséges szállítási útvonalakhoz kapcsolódó potenciális kockázatokat.
Az FMT protokollja széles körben változó, amint azt az 1. táblázat összefoglalja, és ennek a technikának a szabványosítása elősegíti az FMT hatékonyságának tisztázását.
Asztal 1
| Variálhatósági pontok | Potenciális módszertan | Potenciális következmények |
| A beteg előkészítése | Az antibiotikum-kezelés típusa/hossza, a vastagbélkészítés időtartama | A beteg bél mikrobiomjának állapota befolyásolhatja a transzplantációra való hajlamot |
| Donor | Türelmes rokon, „szuper donor”, designer kultúrák? | A „szuperadományozók” azonosítása utal a biztonságosabb, szabványosíthatóbb szintetikus probiotikus közösségek létrehozásának lehetőségére. |
| A minta előkészítése | Aerob vagy anaerob; friss vs fagyasztott vs liofilizált | Egy nemrégiben végzett clincalis vizsgálat szerint a clincalis felbontásban nincs különbség a friss vagy fagyasztott székletminta transzplantációhoz történő felhasználása között |
| Adminisztráció | Nyombélcső, kolonoszkópia, beöntés, tabletta | A technika gyakorlatiasságának maximalizálása, miközben a hatékonyság fenntartása befolyásolhatja annak előírását és költségeit |
| Szállítási hely | Vastagbél, vékonybél | Az emberi mikrobiom térbeli dinamikáját továbbra sem kell jól jellemezni, de célzottabb terápiát eredményezhet |
Az inzulinérzékenység átkerül a donoroktól a befogadókhoz
A legújabb kutatások állatmodellekkel funkcionális összefüggést mutatnak a bél mikrobiómája és az elhízás között, valamint a kapcsolódó anyagcserezavarok között. Például az elhízást és az inzulinrezisztenciát magas fruktóz-tartalmú felnőtt patkányokban orális adagolású antibiotikumokkal vagy kontroll patkányok orális FMT-jével fordították meg [13]. Nemrégiben megvizsgálták az elhízás szempontjából diszkontráns ikrektől a széklet anyagának csíramentes egerekbe történő átültetését [35]. Az elhízott iker mikrobiómájával benépesített egerek zsírosabbak és csökkentek a baktériumok sokféleségénél, összehasonlítva a sovány iker mikrobiomjával benépesített egerekkel. Ezek az eredmények bemutatják a mikrobiom azon képességét, hogy megváltoztassa a gazda metabolikus fenotípusát.
A mai napig csak egy publikált tanulmány vizsgálta az FMT hatékonyságát, kifejezetten az emberek anyagcserezavarainak kezelésében. A metabolikus szindróma jellemző jellemzője az inzulinrezisztencia, ahol a sejtek hipo-reagálnak az inzulinra, ezért nem tudják fenntartani a glükóz homeosztázist. A nyombélcsövön keresztül a T2D-vel diagnosztizált elhízott egyének számára egészséges, sovány donorok székletmikrobiota befolyásolta a gazdaszervezet anyagcseréjét [12]. A vizsgálatban azokat a betegeket hasonlították össze, akik allogén transzplantációt (n = 9) kaptak (azaz egészséges donortól származó székletet) az autológ transzplantációval (n = 9) (azaz saját székletükkel). Bár a transzplantáció után hat héttel nem számoltak be különbségről a testtömeg-indexben, az inzulinérzékenység (a glükóz eltűnésének medián sebességével mérve) és a széklet mikrobiota változatossága szignifikánsan növekedett, és az allogén versus autológ csoportban a széklet SCFA-ja csökkent. . Ezeket az ígéretes eredményeket széles körben idézik és inspirálják több klinikai vizsgálatban (az alábbiakban tárgyaljuk). Bár az FMT mikrobiom változásokat indukálhat a donorpopulációban az FMT utáni 24 hétig [29], további vizsgálatokra van szükség annak megállapításához, hogy az FMT hosszú távú hatással lehet-e az inzulinérzékenységre vagy a súlyra.
További klinikai vizsgálatokra van szükség az FMT hatásainak érvényesítéséhez elhízásban vagy metabolikus szindrómában szenvedőknél. Fontos, hogy ezeket a vizsgálatokat randomizálni kell, tartalmazniuk kell az autológ kontrollokat, aprólékos metaadatokat kell tartalmazniuk, és nyomon kell követniük a hosszú távú mikrobiom és a beteg kimenetelének adatait. A ClinicalTrials.gov négy folyamatban lévő klinikai vizsgálatot sorol fel az FMT metabolikus szindróma kezelésére. A Massachusettsi Általános Kórházban végzett 2. fázisú klinikai vizsgálatban az FMT kapszulák hatását értékelik a testsúlycsökkenés elsődleges eredményére 18 hét alatt [ClinicalTrials.gov ID> NCT02530385]. Egy olaszországi 3. fázisú klinikai vizsgálat a glükóz homeosztázis követését követi az FMT-t diéta és testmozgás kombinációját követő 6 hónapos időszakban [ClinicalTrials.gov ID> NCT02050607]. A kínai Nanjing Orvostudományi Egyetem kutatói kétéves időtartam alatt értékelik a 3. fázisú klinikai vizsgálat eredményeit egyetlen, nazogasztrikus úton leadott FMT-n T2D-n, kétéves időszak alatt [ClinicalTrials.gov ID> NCT01790711]. Egy kanadai kettős-vak kísérleti vizsgálat során az FMT hatékonyságát tesztelik mind a metabolikus szindróma, mind az alkoholmentes zsírmáj betegségben, amely szorosan összefügg az elhízással [ClinicalTrials.gov ID> NCT02496390].
E klinikai vizsgálatok eredményeinek jobb képet kell adnunk a mikrobiom emberi metabolikus rendellenességekben betöltött funkcionális szerepéről. A jövőbeni vizsgálatokat meg kell tervezni annak meghatározására, hogy mely baktériumpopulációk vagy funkcionális mikroba-gazda kapcsolatok állnak ennek a jelenségnek a hátterében.
Szuperadományozók
A donor kiválasztása az FMT számára nem szabványosított, bár általános egyetértés van abban, hogy ezt meg kell tenni [36]. Kezdetben a donorok általában a beteg által azonosított családtagok voltak. A legújabb tanulmányok azonban rávilágítanak a szabványosított önkéntes donorok alkalmazásának és az átvilágított biobankok létrehozásának gyakorlati előnyeire [31,34]. Általánosságban a donorokat az egészséges bélmozgás szempontjából átvizsgálják a Bristol székletdiagramja, a fertőző betegségek, a közelmúlt utazási és antibiotikum története alapján.
A későbbi publikációkban és konferenciákon Vrieze et al. megjegyezte, hogy azok a betegek, akiknél az FMT után erőteljesebben javult az inzulinérzékenység, ugyanolyan korlátozott számú donortól kaptak transzplantációt [37]. Vagyis a donorminták kisebbsége robusztus választ váltott ki, míg más minták nem voltak hatással a betegek anyagcseréjére. A beavatkozás sikere tehát a „szuperadományozóknak” tulajdonítható. Az FMT hatása az IBD tüneteinek enyhítésére hasonlóan azt is megfigyelte, hogy bizonyos donorok székletmintáinak sokkal nagyobb terápiás hatása van több befogadóra [38]. Jelenleg a szuperadományozók azonosítására csak a kísérletek megkezdése után van lehetőség. Újabb FMT-tanulmányok próbálják korábban azonosítani a szuperadományozókat annak érdekében, hogy szigorúbb elemzést végezzenek mikrobiomjukról a terápiás mikrobiota azonosítása érdekében, ami lehetővé teheti az FMT jobb alternatívájának kialakítását.
Erős társadalmi megbélyegzés tapasztalható az FMT esetében [39]. Mivel a székletanyagot nehéz szabványosítani, az ürülék átültetésének etikai és társadalmi szövődményei, valamint a monetizálás nehézségei miatt aktívan keresik az FMT közvetlen alternatíváit [40]. A székletmikrobiota gélkapszulái ígéretes új technika, amely kizárja bármilyen gasztrointesztinális eljárás szükségességét [34,41], és a betegek előnyben részesítik [42,43]. Valójában a magáncégek már orális kapszulákon keresztül szállítják az FMT-t, elsősorban a CDI kezelésére. Nem világos azonban, hogy ezek a kapszulák ugyanolyan hatékonyak-e, mint maga az FMT.
Egy másik lehetséges kezelés a probiotikumok donortól független megtervezése és előállítása. Például a Vrieze és munkatársai tanulmánya megnövekedett butiráttermelő mikrobákat azonosított az FMT-t követően megnövekedett inzulinérzékenységű betegeknél [8]. Ha a butirát-termelő baktériumok növekedése fontos az anyagcsere-tünetek javulásához, akkor lehetőség van a metabolikus szindróma közvetlenebb kezelésére pro/pre-biotikumok révén, amelyet könnyebb ellenőrizni és beadni.
Lehetséges kockázatok
Az FMT egyik kihívása a nemkívánatos reakciók pontos mérésének megtalálásának nehézsége. Eddig a befogadók túlnyomó többsége beteg, és nehéz megkülönböztetni a betegség normális progresszióját és az FMT hatásait. Ennek ellenére, bár több száz ember szenvedett FMT-n, kevés negatív eredményről számoltak be, még immunhiányos betegeknél is [44]. A jelentett negatív tünetek többsége enyhe, beleértve a hasmenést vagy a lázat [45-47]. A halandóságot FMT-vizsgálatokban figyelték meg, azonban súlyos beteg vagy idős betegek összefüggés nélküli okainak tulajdonították. A mikrobiota hajlamosíthatja az érelmeszesedésre való hajlamot egerek okozati és emberben korrelatív bizonyítékok felhasználásával [48]. Ezenkívül a fertőző betegségek terjedése, bár erről nem számoltak be, még mindig életképes fenyegetést jelent, különösen az immunhiányos betegek számára (például immunmoduláló terápiában részesülő IBD-s beteg, CDI-s HIV-beteg). Ezek a jelentések hangsúlyozzák a donorok szigorú szűrésének fontosságát. Végül ezeket a kockázatokat mérsékelni kell az elhízáshoz és a kapcsolódó anyagcsere-betegségekhez kapcsolódó morbiditással és mortalitással, amelyeknek még kevés hatékony kezelésük van.
Meglepő módon a bél mikrobiomjának obesogén tulajdonságai az FMT-n keresztül is átvihetők. Egy esettanulmány dokumentálta az elhízott fenotípus átvitelét egy túlsúlyos donortól egy sovány beteg felé az FMT-t követően CDI-kezelésre [49]. A donor egy fiatal, elhízott rokon volt, aki az adományozás idején gyors súlygyarapodáson esett át. A befogadó olyan személy volt, aki soha nem volt elhízott. Miután megkapta az FMT-t, a befogadónak gyors, akaratlan súlygyarapodása volt, ami nem magyarázható egyedül a CDI-ből való felépüléssel. Érdekes módon a befogadó fokozott étvágyról számolt be. Ezek a megfigyelések továbbra is ellentmondásosak, mivel esettanulmányról van szó. Összhangban van azonban rágcsálókkal végzett vizsgálatokkal, ahol az elhízott egerekből a csíra mentes egerekbe történő székletanyag átvitelét a metabolikus fenotípus továbbítja [35]. Ettől függetlenül ennek a jelentésnek az eredményei sok intézményben érintették az FMT protokollt, amely ma már kizárja az elhízott donorokat az adományozásból.
Következtetés
Az FMT továbbra is izgalmas, bőséges potenciállal rendelkező terápia. Ennek ellenére hiányoztak az ellenőrzött, randomizált vizsgálatok a metabolikus betegségekre vonatkozóan. Kezdetben az FDA az FMT-t IND-nek tekintette, ami a gyakorlók számára megnehezítette az alkalmazást, amíg az összes többi terápiás lehetőség ki nem merült. Az FDA azonban 2014-ben kijelentette, hogy végrehajtási mérlegelési jogkört gyakorol, lehetővé téve az orvosok számára, hogy az FMT-t IND-alkalmazások nélkül használhassák a CDI kezelésében. Az FMT további vizsgálati indikációihoz továbbra is szükség van egy IND alkalmazásra az FDA-nál.
Tekintettel az FMT metabolikus szindrómára jelenleg tesztelt kontrollált klinikai tanulmányainak mennyiségére, a következő években egyértelműen jeleznünk kell, hogy a mikrobiota változásai ok-e vagy korrelatívak-e ebben az emelkedő járványban, és hogy a bél mikrobiómáját megváltoztatják-e FMT vagy hasonló eljárásokkal. új terápiás lehetőségeket kínál az elhízás és az ahhoz kapcsolódó anyagcserezavarok kezelésére.
- A juharszirup hatása a bél mikrobiota sokféleségére és a metabolikus szindrómára - teljes szöveges nézet
- Székletmikrobiota transzplantáció az elhízás kezelésében - klinikai tanácsadó
- Székletátültetés az elhízás és a cukorbetegség kezelésére MedPage Today
- A test vasraktárainak phlebotomia által kiváltott csökkentésének a metabolikus szindrómára gyakorolt hatása a
- Fővárosi Egészségügyi Anyagcsere és Fogyás Központ; Az elhízás lefedettsége