Foszfáttoxicitás CKD-ben: A gyilkos köztünk
Absztrakt
Bevezetés
A foszfátszabályozás diszfunkciójának súlyos klinikai következményei vannak. Valójában az emberen végzett vizsgálatok azt mutatják, hogy a szérum foszfátszint kismértékű növekedése is (a normális vagy a normális tartományon belül) korrelál a megnövekedett morbiditással és mortalitással (9). Ez azt jelzi, hogy az emelkedett szérum-foszfát-koncentráció kimutatása és kezelése fontos lehet egészséges egyéneknél, valamint olyan betegeknél, akik olyan állapotban vannak, mint például a CKD, amelyben a hiperfoszfatémia a kardiovaszkuláris események és a halál fokozott kockázatával jár (10, 11).
Foszfát és CKD
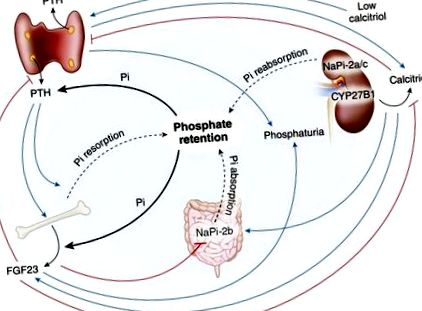
A foszfát-retenció fontosságát a CKD-ben a vesekutatások korai szakaszában felértékelték. A foszfát napi karbantartása megköveteli, hogy az extracelluláris folyadékba belépő foszfátmennyiség megegyezzen a vizelettel kiválasztott mennyiséggel (13). 1968-ban laboratóriumunk megállapította, hogy a foszfát tubuláris újrafelszívódása a CKD súlyosságával arányosan csökken (15). Normál 120 ml/perc GFR mellett a szűrt foszfát körülbelül 10% -a ürül, míg a 2. ábra nagyon alacsony GFR-értéke mellett. Ezenkívül a kalcimimetikus cinakalcet csökkentette a PTH-t, a nukleáris receptorokkal társult protein 1 és az FGF23 expressziót urémiás patkányokban. Ezek a vizsgálatok alátámasztják a dialízisben szenvedő betegek egyéb megállapításait, amelyek szerint a cinakalcet csökkentette a szérum PTH-értékét és csökkentette a szérum FGF23 szintjét (37). Sőt, laboratóriumunkban végzett vizsgálatok azt mutatták, hogy a cinakalcet csökkenti a PTH és az FGF23 értékeket, és hiperfoszfatémiát indukál veseelégtelenségben szenvedő patkányokban (38).
A mellékpajzsmirigy hormon (PTH) -fibroblaszt növekedési faktor 23 (FGF23) visszacsatolási hurok. A PTH az oszteocitákon és az oszteoblasztokon kötődik a mellékpajzsmirigy hormon receptorához (PTH1R), és aktiválja a protein-kináz A-t (PKA), amely növeli a nukleáris receptorokkal társított protein 1 (Nurr1) expresszióját. Ezután a Nurr1 az FGF23 promoterben meghatározott idegnövekedési faktor által kiváltott B klón válasz elemekhez kötődik, és FGF23 transzkripciót indukál. Az FGF23 pedig gátolja a PTH termelést. CKD-ben azonban a hyperparathyreosis növeli a Nurr1 és az FGF23 expressziót, de az FGF23 receptor komplex (Klotho-fibroblastic growth receptor 1 [FGFR1]) csökkentése csökkenti a mellékpajzsmirigy (PTG) és a vese ellenálló képességét az FGF23 működésével szemben. A kalcimimetikumok csökkentik a PTH, Nurr1 és FGF23 értékeket. Módosítva a 36. hivatkozástól, engedéllyel.
Meg kell jegyezni, hogy az FGF23 jól ismert stimulátorain (azaz a kalcitriolon, a PTH-n és a foszfáton) kívül egyéb tényezők, például gyulladás, kalcium, metabolikus acidózis, leptin és vashiány, valamint bizonyos intravénás vaskészítmények szintén ismert FGF23 induktorai (47–51). Az FGF23 növekedése a megnövekedett transzkripciónak vagy az FGF23 hasadásának csökkenésének eredménye lehet, amelyről ismert, hogy a CKD károsodott (52).
Az α-Klotho (Klotho) egy egyszeres áthaladású transzmembrán 130 kD fehérje, amelyet eredetileg antiaging faktorként azonosítottak, de mára a kalcium- és foszfát-homeosztázis kulcsszereplőjeként ismerik el. A Klotho oldható formája, amely endokrin és fiziológiai hatásokkal rendelkezik, és az FGF23-tól függetlenül működik, megtalálható a vérben, a vizeletben és a cerebrospinalis folyadékban (53). Az oldható Klotho transzkriptumának alternatív splicingjével vagy a transzmembrán forma extracelluláris doménjének proteolitikus hasításával (ektodomén leválasztása) keletkezik (54). A vese az oldható Klotho előállításának fő forrása (55).
Klotho lehet az AKI egyik legkorábbi biomarkere. Hu és mtsai. (66) kimutatta, hogy egy AKI patkány modellben a renális Klotho fehérje csökkenése megelőzi a kreatinin növekedését. Emberekben az AKI-ben szenvedő betegeknél az oldható Klotho-szint csökkent (67). Egy másik tanulmányban az AKI-ben szenvedő vesék Klotho expressziója csökkent a betegség súlyosságától függően, az etiológiától függetlenül, és az alacsony Klotho expresszió, amely rossz rövid távú eredménnyel jár (68). Ezért a csökkent Klotho kulcsfontosságú patológiás jellemző lehet az AKI fejlődésében és a CKD-be történő progresszióban.
A CKD-t általában súlyos Klotho-hiány állapotának tekintik, és a vese Klotho-expressziójának csökkenése az egyik legkorábbi változás, amelyet a CKD-ben észleltek (69,70). Előrehaladott CKD-ben az FGF23 rezisztencia a mellékpajzsmirigy Klotho-FGFR1 receptor komplex csökkent expressziójának tulajdonítható a vesében, a PTG-ben és az aortában (59,66,71). Csökkentett koncentrációjú vese- és oldható Klotho találhatók egerekben, kísérletileg indukált CKD-vel (72), és laboratóriumunk nemrégiben beszámolt arról, hogy az urémiás patkányokban a vese Klotho expressziója drasztikusan csökken (57). A CKD-ben szenvedő betegeknél csökkent vese- és oldható Klotho-szint is található (73,74). A Klotho alacsonyabb szérumszintje szignifikánsan korrelál az alacsonyabb eGFR-szinttel CKD-s betegeknél (75). Fontos, hogy Kim és mtsai. (76) megállapította, hogy a Klotho szérum alacsony szintje kapcsolódik a CKD progressziójához, függetlenül az FGF23-tól, a proteinuriatól vagy a PTH-tól, ami arra utal, hogy az α-Klotho hasznos klinikai biomarkerként szolgálhat a CKD progressziójához. Ezenkívül Barker és mtsai. (77) egy új szintetikus antitestet használva nemrégiben azt találta, hogy az oldható Klotho a CKD korai szakaszában csökkent, megelőzve a hiperfoszfatémiát és az FGF23 és a PTH növekedését. Ez tovább hangsúlyozza Klotho szerepét a vesekárosodás biomarkerként.
Foszfát- és szív- és érrendszeri betegségek
A szív- és érrendszeri betegségek a CKD-ben szenvedő betegek halálának fő oka a kockázati tényezőktől független módon, például a szív- és érrendszeri betegségek kórelőzményében vagy a dokumentált proteinuria jelenlétében (78,79). A szív- és érrendszeri betegségek következtében megnövekedett morbiditás és mortalitás ezeknél a betegeknél az érrendszer meszesedésével jár. A hiperfoszfatémia súlyos szövődmény a késői stádiumú CKD-ben, és dialízis alatt álló betegeknél jól ismert összefüggés van a hiperfoszfatémia és a szív- és érrendszeri betegségek között.
Az erek meszesedése egy aktív, sejtek által szabályozott folyamat, amelynek során a kalcium-foszfát sók méhen kívüli lerakódása az erekben, elsősorban az artériákban vagy a szívbillentyűkben történik. Az intim meszesedés (az érrendszer legbelső rétegének meszesedése) az érelmeszesedéshez, a mediális meszesedés (vagyis a Mönckeberg-szklerózis) pedig az erek merevedéséhez kapcsolódik. A vaszkuláris simaizomsejt (VSMC), amely a tápközegben lévő sejtek többségét alkotja, központi szerepet játszik a foszfát-indukált meszesedésben. A tenyészet magas foszfátszintje a VSMC-k átalakulását okozza osteoblast-szerű sejtekké a Pit-1, egy 3-as típusú nátrium-függő foszfát-transzporter (80) aktivitásának közvetítésével. Shroff és mtsai. (81) kimutatta, hogy a CKD-ben szenvedő betegek artériás gyűrűinek magas foszfátszintje elősegítette az erek meszesedését, ami apoptózist és a VSMC-k halálát okozta. A normál alanyokból származó érgyűrűk tenyészete nem mutatott meszesedést, ami arra utal, hogy a normál VSMC-k sajátos utakkal rendelkeznek a meszesedés megakadályozására, míg a CKD a VSMC-ket előkészíti és hajlamossá teszi őket a meszesedésre.
A CKD köztudottan aktiválja az endoteliális sejteket, és membránból származó mikrorészecskéket (MP) generál, amelyek a sejtek plazmamembránjaiból, például vérlemezkékből, endoteliális sejtekből és leukocitákból leválasztott vezikulák (82). Az endoteliális MP-k a CKD vaszkuláris diszfunkciójának, valamint a trombózis és a szív- és érrendszeri betegségek lehetséges okainak markerei (83,84). Az extracelluláris foszfát magas szintje MP termelést indukál a tenyésztett endoteliális sejtekben (85). Humán vaszkuláris endoteliális sejtekben Abbasian és mtsai. (85) megállapította, hogy az extracelluláris foszfát magas szintje a Pit-1/slc20a1 transzporterek által közvetített intracelluláris foszfátkoncentráció növekedését eredményezte. Az intracelluláris foszfát növekedése a fehérje foszforilációjának változásához vezet, ami viszont erősen prokoaguláns MP felszabadulását idézi elő. A parlamenti képviselők tehát egy olyan kóros jelátviteli útvonal részei lehetnek, amely összekapcsolja a hiperfoszfatémiát CKD-ben szenvedő betegeknél és kardiovaszkuláris eseményekkel.
Emberben még a szérum foszfát enyhe emelkedése is növelheti a kardiovaszkuláris meszesedés kockázatát. A normál tartományon belüli magasabb foszfátszint a PTH és a kalcitriol szintjétől függetlenül, mérsékelt CKD-s betegek vaszkuláris és szelepi meszesedésével jár (86). Valójában a normál tartományba eső magasabb szérum-foszfát-koncentráció normális és rendellenes vesefunkciójú betegek kardiovaszkuláris eseményeivel és halálozásával jár (9,87). Shang és mtsai nemrégiben készült tanulmánya. (88) kimutatta, hogy a hiperfoszfatémia független kockázati tényező a koszorúér meszesedésének előrehaladásában. A foszfátszint pozitívan kapcsolódott a fehérje bevitelhez és a peritonealis dialízis megfelelőségéhez, ami arra utal, hogy a foszfát bevitel korlátozása hasznos lehet az érrendszer meszesedésének előrehaladásának lassításában. Laboratóriumunk a közelmúltban az aorta meszesedésének jelentős csökkenéséről és a mortalitás csökkenéséről, valamint a vesefunkció megőrzéséről számolt be foszfátkötők és étrendi foszfátkorlátozás alkalmazásával urémiás patkányokban; a halálozás és a túlélési arány Kaplan – Meier elemzését ebben a vizsgálatban a 3. ábra mutatja (89).
A D-vitamin-aktivátor parikalcitol megakadályozza a vese Klotho szabályozását urémiás patkányokban. (A) Reprezentatív képek a normál, urémiás és urémiás parikalcitollal kezelt patkány veseszövet Klotho immunfestéséről. A klothót a proximális tubulusokban, a disztális tubulusokban és a veseszövet gyűjtőcsatornáiban detektálták. Eredeti nagyítás, × 200. Méretarány, 50 μm. (B) A Klotho immunfestés mennyiségi kimutatása azt mutatja, hogy a klotho fehérje szignifikánsan 65,5% -kal csökkent az urémiás patkányokban; ezt a csökkenést a paricalcitol-kezelés blokkolta. IOD, integrált optikai sűrűség. α P≤0,01 a normálissal szemben (n = 6 mindegyik; átlag ± SEM). (C) A vese Klotho mRNS mennyiségi meghatározása a klotho expressziójának szignifikáns, 78,3% -os csökkenését mutatta urémiás patkányokban, amelyet a paricalcitol kezelés blokkolt. β P≤0,05 versus uremic (n = 6 mindegyik; átlag ± SEM). Ct, PCR ciklusszám küszöbértéknél. Módosítva az 57. hivatkozástól, engedéllyel.
Következtetés
A CKD-ben talált diszregulált ásványi anyagcsere megértése az elmúlt 50 éves vesekutatás során nagymértékben kibővült. Különösen az FGF23 és Klotho közelmúltbeli felfedezése segített tisztázni az ásványi anyagcsere endokrin szabályozásának szempontjait mind az egészség, mind a betegségek szempontjából, és szükségessé tette a jól megalapozott hipotézisek frissítését. Ami azonban ezekben az években változatlan maradt, az a felismerés, hogy a foszfát-visszatartás a számos CKD-ben észlelt szövődmény, nevezetesen a 2 ° HPT, valamint a csont- és szív- és érrendszeri betegségek kialakulásának indító tényezője. A foszfát-visszatartás összefüggése a betegek morbiditásával és mortalitásával a szérum-foszfát szabályozását prioritássá teszi a CKD-ben szenvedő betegeknél. A hiperfoszfatémia hatékony kezelésének kulcsa azonban a betartás, és a jelenlegi kezelések nem mentesek mellékhatásoktól vagy kellemetlenségektől. Ezért az étrendi foszfátot, foszfátkötőket, a foszfáttranszporterek manipulátorait, a PTH szuppresszorait célzó terápiák és a Klotho szabályozására és/vagy az FGF23 szint csökkentésére szolgáló módszerek kombinációja optimális lehet a CKD foszfátretenciójának kezelésében.
Közzétételek
Washington Egyetem és E.S. a Wisconsini Egyetem (Madison, WI) kapcsolódó technológiai engedélye alapján kaphat jövedelmet. C.S.R. nincs bejelentendő nyilvánosságra hozatala.
Köszönetnyilvánítás
Ezt a munkát támogatta egy washingtoni egyetem kutatása a vesebetegségekben (3068-31030A), egy washingtoni egyetemi vesebetegség-kutató központ O'Brian Center támogatása (P30DK079333) és egy AbbVie IIS-program támogatása.
- Az albumin vizsgálat szerepe a kalciumszinteken és a foszfátkötők felírása krónikusan
- Egyalapú nátrium-foszfát; Nátrium-foszfát kétbázisú beöntés
- Foszfát vérvizsgálat célja, magas vs.
- Gomba toxicitás - StatPearls - NCBI könyvespolc
- Növényi toxicitás; Frances Harcourt-Brown