Gyomorfisztula
Kapcsolódó kifejezések:
- Gyomorgátló polipeptid
- Gyomor nyálkahártya
- Bonyodalom
- Pentagasztrin
- Fistula
- Kolecisztokinin
- Tályog
- Nátrium-klorid
- Szomatosztatin 28
- Fecske (madár)
Letöltés PDF formátumban
Erről az oldalról
A GYOMOR
Margaret E. Smith PhD DSc, Dion G. Morton MD DSc, Az emésztőrendszer (második kiadás), 2010
Kiválasztás
Az étkezési rendellenességek viselkedési és neuroendokrin komponenseinek állatmodelljei
Tisztítás: ál-etetési modell
Módszereket fejlesztettek ki a falatozás étkezés utáni következményeinek feltárására. A színlelt táplálás, amelyben a gyomor fistulát helyezik a folyékony táplálék eltávolítása céljából a gyomorból a bélbe jutás előtt, utánozza a tisztítás szempontjait BN-ben (Smith, 1989). A mértéktelen evés, amelyet megtisztítás követ, vagy színlelt táplálás a gyomortartalom eltávolításával, minimalizálja az ételfogyasztás postestesztív következményeit. A színlelt etetési készítmények bebizonyították, hogy amikor a patkányoknak hozzáférést nyújtanak egy ízletes oldathoz, és a fistula nyitva van, nagy mennyiségű oldatot fogyasztanak, ezáltal modellezve a falatot, postesztesztív visszacsatolás nélkül (Avena, Rada, Moise és Hoebel, 2006).
Esophagogastroduodenoscopy és kapcsolódó technikák
A fisztulák endoszkópos lezárása
A fistulák endoszkópos lezárásáról gyermekeknél két technikát, elsősorban az endoszkópos nyírást és a fibrinragasztó endoszkópos injektálását jelentették. Teitelbaum és mtsai. két gastrocutan fistula lezárását jelentették MPEC koaguláció és fém klip alkalmazásának kombinációjával. 108 A hiba megszüntetéséhez szükség lehet arra, hogy a gasztrostómia cső helyére szekvenált cipzárszerű módon több klipet kell elhelyezni, és a fisztula bezáródásának eléréséhez nem szükséges óvatosság. Tapasztalataink szerint a gasztrosztómia traktusának újbóli megnyílása alkalmanként előfordulhat, ha a klip „leesik”, ami egy vagy több éven belül előfordulhat a klip alkalmazását követően; ezt klip újbóli alkalmazásával lehet kezelni. Histoacryl vagy fibrin ragasztó injekcióval kezelt gyermekeknél beszámoltak egy visszatérő tracheoesophagealis fistula endoszkópos obliterációjáról és egy oesophagobronchialis fistula obliterációjáról. 109,110
Gyomormotilitás
Christine Feinle-Bisset, Michael Horowitz, a Gasztroenterológia enciklopédiájában, 2004
Bevezetés
Az 1820-as évek elején Alexis St. Martin, hasi lőtt sebben szenvedő beteg megadta az orvosának, William Beaumontnak a lehetőséget, hogy elsőként figyelje meg nyitott gyomorfistulán keresztül azt az ételt, akár lenyelték, akár közvetlenül a gyomorba helyezték. a sipolyon keresztül gyomorfal-összehúzódásokat váltott ki, amelyek megkönnyítették az étel kisebb részecskékre bomlását. Két különféle motoros aktivitású gyomor régiót később Walter Cannon azonosított, kutyákon és macskákon végzett vizsgálatok során roentgenográfiával a gyomor motoros funkcióinak vizsgálatára.
A gasztroduodenális régió különféle rekeszei különböző funkciókat töltenek be. A proximális gyomor képes ellazulni, így a bevitt táplálék a gasztronómiai nyomás minimális növekedésével befogadható; disztális gyomor fázisos összehúzódásai, majd összekeverik és megőrlik a szilárd ételt, és a „cseppfolyósított” szilárd anyagokat a pylorus felé hajtják. A tonikus és a fázisos pylorus összehúzódások szabályozzák a transzpylorus áramlást, a duodenum pedig modulálhatja a chyme átjutását, és ezáltal a vékonybél receptorainak a tápanyagoknak való kitettségét. Fontos azonban felismerni, hogy a tápanyagok intragasztrikus feldolgozása és az azt követő vékonybélbe juttatása olyan sebességgel, amely optimalizálja az emésztést és a felszívódást, függ a különböző régiók közötti mozgékonyság integrációjától.
A gyomor gyulladásos rendellenességei
REAKTÍV (VEGYI) GASZTRÓPIA
Bulimia Nervosa mint szenvedélybetegség
Az öblítő BN állatmodelljei
Nehézségek merülnek fel a BN tisztításának modellezésével laboratóriumi állatokban, mivel a patkányoknak hiányzik a nyelőcső izomanatómiája a hányáshoz. Így a „látszólagos táplálás/falás” paradigmának kitett patkányokat gyomor fistulával ültetik be a nyelőcsőjükbe vagy a gyomrukba. Nyitott állapotban a fistulák korlátozzák a kalóriabszorpciót, mivel minimális érintkezést eredményeznek az étel és az állat gyomor- és bélnyálkahártyája között. A patkányokat ezután 12 órás táplálékkorlátozási perióduson keresztül folytatják, majd 12 órás szabad hozzáférést kapnak az élelemhez, ami az édes ételek mértéktelen fogyasztását eredményezi, a gyomor fistuláján keresztüli öblítéssel párosulva (Avena, Rada, Moise és Hoebel, 2006). Nevezetesen a BN-ben szenvedő nők, akik a „kortyolgatás és köpés” eljárás révén módosított álfehér táplálékkal ellátott édes oldatok, lényegesen több megoldást jelentenek, mint azok a nők, akik anamnézisében étkezési rendellenességek nincsenek (Klein, Schebendach, Brown, Smith és Walsh, 2009), ezáltal támogatást nyújtva a BN „ál-etetés/falás” állatmodelljének validálásához.
Adrenomedullin
Gyomorsav-szekréció
Az adrenomedullin kering a plazmában, és a peptid intravénás infúziója gátolja a bazális, hisztamin-stimulált, pentagasztrin-stimulált és 2-dezoxi-d-glükóz-stimulált savszekréciót gyomorfistulával ellátott eszméleténél szenvedő patkányokban. A hatást részben, 50-60% -ban gátolja egy szelektív szomatosztatin receptor antagonista, ami arra utal, hogy a szisztémás adrenomedullin mind a szomatosztatin-függő, mind pedig a független utakon keresztül gátolja a savszekréciót. Az AM22-52 adrenomedullin receptor antagonista azonban nem tudta jelentősen antagonizálni az adrenomedullin hatását. A megállapítások megegyeznek a pylorus-ligált patkányokban tapasztaltakkal, amelyekben az adrenomedullin szubkután injekciójának savszekréciójára gyakorolt gátló hatást hatékonyabban blokkolta a CGRP receptor antagonista, a CGRP8-37, mint az AM22-52, ami arra utal, hogy az antiszekretoros hatás főleg CGRP receptorokon keresztül közvetített. A gyomorban a CGRP képes serkenteni a szomatosztatint, gátolni a gasztrin- és savszekréciót. 17,29 Figyelmeztetni kell azonban, hogy a rágcsálók AM2-receptorai előnyben részesítik a CGRP8-37-et. 16.
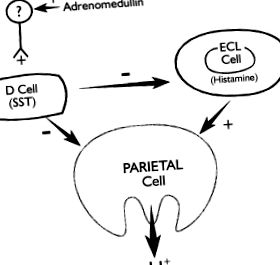
Az izolált egér gyomor és a szuperfúziós patkányi fundusszegmensek, az intakt intramurális idegi és parakrin utakat megtartó, de a hormonális hatásokat, például a gasztrint kiküszöbölő készítmények vizsgálata azt jelzi, hogy az adrenomedullin lokálisan, vagyis az oxyntikus nyálkahártyán belül hat a szomatosztatin stimulálására, valamint a hisztamin és sav gátlására. váladék (2. ábra). A hatást az axonális blokkoló, a tetrodotoxin megszünteti, jelezve, hogy az adrenomedullin hatása az intramuralis neuronok aktivációján keresztül valósul meg. Az adrenomedullin által kiváltott szomatosztatin-szekrécióért felelős neurotranszmitter azonosítása még nem ismert. A kutya mesenterialis artériáiban az adrenerg idegvégződéseken adrenomedullin receptorokat azonosítottak. 3
2. ÁBRA . Az adrenomedullin által a gyomor oxyntikus nyálkahártyájának savas szekréciójának szabályozását szemléltető modell. Az adrenomedullin egy még nem azonosított intramurális neuronon keresztül hatva serkenti a szomatosztatint (SST), és ezáltal gátolja az enterokromaffin-szerű (ECL) sejtek hisztamin-szekrécióját és a parietális sejtekből származó savszekréciót.
Reprodukálva a Ref. Engedélyével 9. .
Emésztőrendszeri hormonok
D plazmakinetika
Tudatos kutyáknál összehasonlítva az SS14 és SS28 plazmakinetikája felezési idejű értékeket javasolt 1,34 és 3,64 percre (43). Altatott kutyáknál a jelentett értékek 1,7 és 2,8 percek voltak (21). Thomas kanülök által elvezetett krónikus gyomorfistulákkal műtéti úton előállított kutyáknál a plazma felezési ideje t1 = 0,57 perc volt SS14 esetében és t½ = 2,84 perc SS28 esetében (36). Gyomor fistulákkal előkészített eszméletlen macskáknál az SS28 plazma felezési ideje (6,1 perc) kétszerese volt az SS14-hez képest (2,4 perc). Patel és Wheatley (18) két különböző antitest felhasználásával vizsgálták az SS14 és SS28 plazma felezési idejét patkányokban in vivo és in vitro. Az SS14 in vivo eltűnéséhez 0,15–0,4 perc t½ értékeket találtak, az alkalmazott testtől függően. Az SS14-et és az SS28-at is viszonylag lassan inaktiválták a plazmában in vitro, a t½ értékek az SS14 esetében 57 perc, az SS28 esetében pedig 210 perc volt. Bármi legyen is az alkalmazott kísérleti modell, az SS28 plazma felezési ideje 2–6-szor magasabb, mint az SS14-é. A kísérleti modellek között megfigyelt különbségek és a felezési idő mérésének eltérő körülményei legalább részben megmagyarázhatják az in vivo mért biológiai hatásokban jelentett eltéréseket.
Szivárgások és sipolyok a bariatrikus műtét után
Bevezetés
Az anasztomotikus szivárgás a bariatrikus műtétek ritka szövődménye, és a halálozás független kockázati tényezője [1]. Ez a szövődmény, ha nem azonosítják és gyorsan és agresszíven kezelik, hasi szepszishez vezethet, amely akár krónikus gyomorfisztulává, akár többszervi elégtelenséggé és a páciens pusztulásává válhat. A bariátriai műtét utáni szivárgás előfordulási gyakorisága 1,7% és 2,6% között van a nyitott Roux-en-Y gyomor bypass (RYGB) után és 2,1% és 5,2% között laparoszkópos RYGB után, és a hüvelyes gastrectomia (SG) után eléri az 5,1% -ot [2]. ]. A revíziós bariatrikus műtéteknél az anasztomotikus szivárgás kockázata megközelíti a 35% -ot [3]. A szivárgások 6–14,7% -os halálozási arányhoz kapcsolódnak [4,5]. A halálozás kockázatának megkétszerezése mellett a szivárgások a kórházi tartózkodás hatszorosát eredményezik [6]. Azoknál a betegeknél, akiknél szivárgás alakul ki, fokozott a sebfertőzés, a szepszis, a légzési elégtelenség, a veseelégtelenség, a tromboembólia, a belső sérv és a vékonybél elzáródásának kockázata [6] .
A gyomor-bélrendszeri (GI) szivárgást a posztoperatív periódusban a szöveti alkalmazás megszakadásának definiálják. A szivárgás akkor alakul ki, amikor az intraluminális nyomás meghaladja a szövet vagy a varratvonal ellenállását. Ez bekövetkezhet a közvetlen posztoperatív időszakban vagy akár hónapokkal később is. Klinikailag a szivárgások az enyhe mikroleakoktól, mint a peri hüvelyi tályogok és a krónikus fistula okozóitól, a hasi katasztrófáig terjedhetnek. A RYGB után több helyen is szivárgás fordulhat elő - a gastrojejunal anastomosisban, a gyomortáska kapcsain és a jejunojejunal anastomosisban. A szivárgás leggyakoribb helye a gastrojejunal anastomosis, amelyet a jejunojejunal anastomosis követ, az ezzel járó halálozás akár 18,4%, illetve 40% [7]. Ritkábban szivárgások fordulhatnak elő a jejunális csonkon, a kizárt gyomorban, a nyombélcsonkon (reszekciós bypassban) és a vak jejunális végtagon. Az SG-t követő betegeknél a szivárgások bárhol előfordulhatnak a hosszú gyomor vágott vonal mentén, bár messze a legtöbb szivárgás a gyomor proximális harmadában jelentkezik a gyomor-nyelőcső csomópont közelében, az.
A szivárgások kialakulásához hozzájáruló betegekkel kapcsolatos tényezők közé tartozik a helytelen táplálkozás, a jelenlegi vagy a közelmúltbeli dohányzási előzmények, a májcirrózis és a veseelégtelenség. Egy laparoszkópos és nyílt gyomor bypass utáni szivárgást előrejelző tényezőket elemző tanulmányban Masoomi és mtsai. talált nyílt gyomor bypass (aOR 4,85), pangásos szívelégtelenség (aOR 3,04), krónikus veseelégtelenség (aOR 2,38), életkor> 50 (aOR 1,82), Medicare fizető (aOR 1,54), férfi nem (aOR 1,50) és krónikus tüdő betegség (aOR 1.21) a szivárgások magas kockázatával járó tényezők [9]. 4888 laparoszkópos SG-n átesett beteg metaanalízisében 2,4% -os szivárgási arányt mutattak ki. A BMI> 50 kg/m 2, és a 40 francianál kisebb bougie-t alkalmazták a megnövekedett szivárgási sebességgel összefüggő tényezőknek [10]. Egy 4444 beteg retrospektív elemzésében, amelyet a bariatrikus sebészeti adatbázis longitudinális értékelésébe vetettek, a nyílt műtét, a revíziós műtét és a rutinszerű lefolyó elhelyezés fokozott szivárgási arányhoz kapcsolódott [11]. .
A demens betegek étkezési magatartása
A demens betegek táplálkozása
Az öntudat csökkenésével eljön az idő, amikor az aspirációs tüdőgyulladás megelőzésére, valamint a mesterséges táplálkozásra és a hidratáció kezelésére van szükség. A gasztroszómákat jelenleg a hosszú távú táplálkozáskezelés céljából végzik.
- Hasnyálmirigy hormon - áttekintés a ScienceDirect témákról
- Ápolási folyamat - áttekintés a ScienceDirect témákról
- Fehérje - áttekintés a ScienceDirect témákról
- Fogszabályozás - áttekintés a ScienceDirect témákról
- Fehérje étrend - áttekintés a ScienceDirect témákról