Herbicid vagy biológiai kezelés közvetlen összehasonlítása Myriophyllum spicatum kontrollon és biokémián
Michelle D. Marko
1 Biológiai Tanszék, Concordia Főiskola, Moorhead, MN, Egyesült Államok
Jason C. White
2 Analitikai Kémiai Tanszék, a Connecticuti Mezőgazdasági Kísérleti Állomás, New Haven, CT, Egyesült Államok
Társított adatok
Absztrakt
Bevezetés
Eurázsiai vízimadár [Myriophyllum spicatum L. (Haloragaceae); a továbbiakban a milfoil] Észak-Amerika legelterjedtebb és legagresszívebb invazív vízi növényei közé tartozik (Smith és Barko, 1990). A M. spicatum őshonos elterjedése Ázsiában, Európában és Afrika egyes részein található; bár jelenlegi eloszlása az Egyesült Államok 48 államát, valamint Kanada nagy részeit foglalja magában (EDDMapS, 2015). Ez a széles skála valójában meglehetősen figyelemre méltó; úgy tűnik, hogy a növény ugyanolyan jól növekszik a túl-átteleltetés után a jég alatt Új-Angliában, mint a déli évszakban. A milfoil alámerült, gyökeres évelő kétszikű, amely jellemzően 0,5–3,5 m átlagos vízmélységen található meg. Miután egy víztestbe vitték be, a M. spicatum gyakran növekszik, sűrű állományokká nőve, amelyek versenyképesebbé teszik az őshonos növényeket (Smith és Barko, 1990; Madsen et al., 1991). A M. spicatum ágyak szintén akadályozhatják a vízi utak hajózását, és veszélyessé tehetik a hajózást és az úszást. A madarak és a halak populációira gyakorolt közvetlen negatív hatásokat szintén dokumentálták (Aiken, 1979; Madsen et al., 1995; Schultz és Dibble, 2012; Simbanegavi és mtsai, 2018). A M. spicatum szaporodása elsősorban vegetatív, nagyrészt megmagyarázva annak robbanásszerű populációnövekedési potenciálját. A tavak között elterjedés számos eszközzel történhet, ideértve a hajókhoz/pótkocsikhoz rögzített laza növényzetet és a madárfajok által hordozott töredékeket, amelyek tovább veszélyeztetik az őshonos növényállományt (Madsen et al., 1988).
Nagy az érdeklődés az olyan invazív vízi növények biológiai védekezési lehetőségei iránt is, mint az M. spicatum (Reeves és mtsai, 2008; Havel és mtsai, 2017). Három rovar társult a M. spicatum populációk csökkenésével (lásd Newman, 2004 áttekintését). A Cricotopus myriophylli Oliver (Diptera: Chironomidae) kimutatták, hogy M. spicatum meristemákat fogyaszt és elnyomja a növekedést. Kimutatták, hogy az Acentria ephemerella (Denis és Schiffermüller) (Lepidoptera: Pyralidae) csökkenti az M. spicatum biomasszát a mezokozmosz kísérleteiben, és a M. spicatum biomassza drámai csökkenésével jár New York-i tavakban (Johnson és mtsai, 2000; Gross és mtsai. ., 2001). Az Euhrychiopsis lecontei (Dietz) (Coleoptera: Curculionidae) szabályozhatja a M. spicatum populációkat, és különösen érdekes, mivel a legújabb tanulmányok kimutatták, hogy a zsizsik valóban az invazív M. spicatumot részesíti előnyben natív gazda natív milfoil (M. sibiricum Komarov) (Haloragaceae) (Solarz és Newman, 1996, 2001; Sheldon és Jones, 2001). Azonban a M. spicatum populáció növekedésére adott zsibbadás késleltetési ideje miatt a natív sokféleség károsodhat, és a milfoil populációk problematikussá válhatnak.
Ennek a jelenlegi tanulmánynak az volt a célja, hogy közvetlenül összehasonlítsa három különböző kezelési lehetőség hatását az M. spicatumra kontrollált körülmények között. Két, a M. spicatum elleni védekezés céljából felsorolt, gyakran alkalmazott szisztémás herbicidet, a 2,4-diklór-fenoxi-ecetsavat és a fluridont összehasonlítottuk egy bevezetett biokontroll-szerrel, az E. leconteival. Meghatároztuk ezeknek a kezeléseknek a milfoil biomasszára gyakorolt hatását, valamint a polifenolok, szénhidrátok, keményítő, hamu és szén: nitrogén arányra jellemző szövetspecifikus tartalmat. Korábban nem végeztek közvetlen összehasonlítást a milfoil zsizsik és a herbicidek ellenõrzött körülmények között. Ez az összehasonlítás fontos tényező az optimális védekezési módszer meghatározásában a herbicidek használatának csökkentése, valamint a hosszú távú tervezés és helyreállítás ösztönzése érdekében.
Anyagok és metódusok
Mikrokozmosz tervezés
Kísérleti mikrokozmosztartályokat hoztak létre a Lockwood Farmban, Hamden, CT, Egyesült Államok. Tizenhat 387 L (132 cm × 69 cm × 71 cm, H × Sz × M) tartályt (Rubbermaid) rendeztek randomizált blokk-elrendezésben. Mindegyik tartályt 32 műanyag edénnyel (10,5 cm × 10,5 cm × 11 cm) módosítottuk, amely tó üledék/mezőgazdasági vályog (50:50) keveréket tartalmazott. A klórmentesített csapvizet lassan 30 cm mélységig adagoljuk. A Quilnipaug-tóból, Guilford, CT, Egyesült Államok (lat. 41.388923 °, Lon. −72.698632 °) gyűjtött M. spicatumot sérülések szempontjából megvizsgáltuk, gerinctelenektől megtisztítottuk, 20 cm hosszúságra vágtuk és négy szár sűrűségben ültettük. edényenként. A növényeket kb. 3 hétig hagyták gyökerezni és megtelepedni. Az úszó vagy nem rögzített szárakat naponta cserélték. Az alganövekedés a kísérlet során minimális volt, de szükség esetén kézzel távolították el a tartályokból. A tartályokban a vízszintet körülbelül 60 cm-nél vagy 350 l-nél tartják.
Kísérleti terv
A milfoil weevil E. lecontei kultúráit, amelyeket Dooley Pond-ból (Middletown, CT, Egyesült Államok) gyűjtöttünk (lat. 41.5116712 °, Lon. −72.6679638 °), laboratóriumunkban hoztunk létre körülbelül 1 hónappal a kezelés előtt. Annak érdekében, hogy elérjük a száronként a kívánt 1-2 zsizska sűrűségét, amelyről ismert, hogy a M. spicatum ellen védekezik (Newman, 2004), tíz felnőtt zsizsikét (legalább öt nőstényt) adtak mindegyik tartályhoz, és 10–14 napig hagyták peteérésüket. Az M. spicatum meristemákat naponta ellenőriztük, hogy száranként 1-2 tojás sűrűsége elérhető legyen. A zsizsik általában körülbelül 25 nap múlva jön ki a bábozásból (Mazzei et al., 1999); a populációkat a következő 40 napban követtük nyomon.
Annak ellenére, hogy a gerinceseket a kísérlet kezdetén gondosan megvizsgálták és eltávolították, néhány gerinctelen maradt a növényeken vagy az összegyűlt üledékben. Ezért a zsizsikek által okozott károk és más gerinctelenek, például a csigák, a caddisflies, az A. ephemerella és a Paraponyx sp. tudomásul vették. A gerinctelen állatok jelenlétét és károsodását kéthetente minden kezelés során összegyűjtött szár egyedi vizsgálatával határoztuk meg. A zsizsik jelenlétét az életszakasz felsorolta (tojás, lárva, báb, kifejlett). A zsibbadás teljes értékét bármely életszakasz vagy jellegzetes lárva károsodás jelenlétével értékeltük.
Növénynövekedés
Havi rendszerességgel minden ismétlődő tartályból véletlenszerűen kiválasztottak legalább két négy szárból álló cserepet a biológiai és kémiai paraméterek meghatározása céljából. Az elemzésekhez tankonként átlagértékeket használtunk. A megfigyelt biológiai paraméterek között szerepelt a zsizsik sűrűsége, a leghosszabb szárhossz (cm), a leghosszabb gyökérhossz (cm), a nedves és száraz tömeg (mg), valamint a növényenkénti merisztémák számának meghatározása. A növényeket növényi részekre osztották: a felső 15 cm-re („hegyek”), a fennmaradó talaj feletti részre („középső”) és a gyökerekre. A biomassza-elemzések során a föld feletti részeket (hegyeket és középső részeket) kombinálták, mint a föld feletti kezeléseket.
Növényi kémiai elemzés
A növényeket részekre (hegyek, középső és gyökerek) szétválasztottuk, liofilizáltuk, kávédarálóval (Braun) vagy mozsárral és mozsárral finom porrá őröltük, és lemértük a kémiai elemzésekhez. A kémiai elemzések magukban foglalták a szén, a nitrogén és az elemi szén: nitrogén arány, szénhidrátok, keményítő, szerves anyagok, polifenolok és hamu százalékos összetételének meghatározását. A milfoil szárak szén- és nitrogéntartalmát PerkinElmer II sorozatú, CHN/O Analyzer 2400 (Norwalk, CT, Egyesült Államok) segítségével elemeztük. Kiszámítottuk a C: N moláris arányát, és statisztikai elemzések során használtuk őket. Az összes fenolos vegyületet (TPC) a Folin-Ciocalteau assay-vel határoztuk meg, standardként csersavat használva (Bowyer és mtsai., 1983). Az eredményeket csersav-ekvivalensben fejeztük ki a száraz tömeg (TAE) alapján. A szénhidrát- és keményítőtartalmat szöveti emésztéssel, majd HPLC-analízissel határoztuk meg Gent (1984) módszerével; szénhidrátok esetében azonban az áramlási sebességet 0,6 ml/perc értékre módosítottuk. A glükóz-, fruktóz- és szacharózkoncentrációkat külön mértük, és összegeztük a szénhidrátkoncentrációkat. A hamutartalmat egy száraz növényi minta tömegének meghatározásával határoztuk meg 24 órán át 350 ° C-on történő melegítés előtt és után.
Herbicid elemzés
Gyomirtó szer mennyisége
Statisztikai analízis
Az adatokat SAS 9.1-vel (SAS Institute Inc., Cary, NC, Egyesült Államok) elemeztük. A Milfoil biomassza adatait a normális eloszlás (K – S teszt vagy Shapiro – Wilk teszt) és a variancia homogenitás (Levene teszt) szempontjából teszteltük. A szélsőséges értékeket eltávolítottuk. Logaritmus-transzformációt végeztünk olyan biomassza-adatokkal, amelyek nem feleltek meg a normalitás és a homogenitás tesztjeinek. A válaszváltozókat növényrészenként külön elemeztük. A statisztikai különbségeket kétirányú ANOVA-val (GLM eljárás) határoztuk meg a kezelés, a gyűjtés dátuma (DAT, a kezelés utáni napok) és a kezelés DAT kölcsönhatás alapján. Amikor a dátum szignifikánsan különbözött, a válaszváltozókat külön-külön elemeztük minden egyes DAT kezelésével. A 2,4-D-vel kezelt növények elhaltak a legutóbbi növénygyűjtés során, és kizárták őket a végső gyűjtés mintáinak elemzéséből. A csigák és a caddisflies jelenlétét log-lineáris modell (GENMOD eljárás, Poison eloszlás) alkalmazásával értékeltük, magyarázó változóként a kezelés és a gyűjtés dátumát.
Eredmények
A kezelés hatékonysága
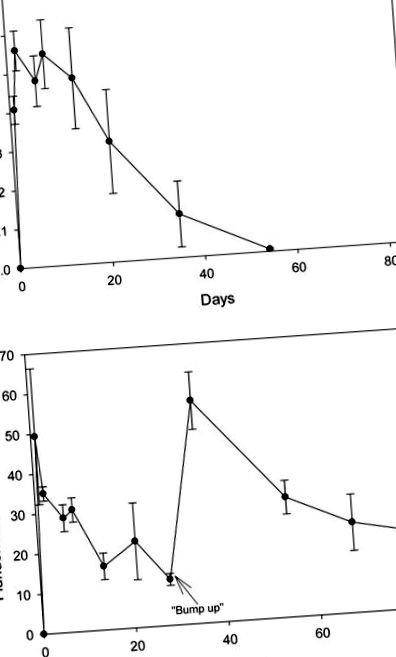
A tüskés 2,4-D és a fluridon SPE-n keresztüli visszanyerése a vízből 103 ± 5,16% és 135 ± 13,6% volt. A nem tüskés kontroll vízmintákban és az előkezelő tartályos vízmintákban sem volt kimutatható a herbicid szint. Egy nappal az alkalmazás után a 2,4-D szint 0,41 mg/l volt; a nyolcadik napon a koncentráció 0,55 mg/l volt, és ezután csökkenésnek indult (ábra (1A ábra). 1A). Az 53. napra a szintek csak kissé meghaladták a kimutatási határokat. Egy nappal az alkalmazás után a fluridon koncentrációja elérte a 49 μg/l-t, de a 28. napon folyamatosan csökkent 12 μg/l-re, amikor további fluridont adtak hozzá (ábra (1B ábra). 1B). A 38. napra a koncentráció 56 μg/l-re emelkedett, és a 84. napig folyamatosan 19 μg/l-re csökkent. Mindkét herbicid nem volt kimutatható szint a kontroll és a zsizsiktartályok vízében.
(A) 2,4-D (Navigate ®) koncentrációja a gyomirtó szerrel kezelt tartályok vízéből 2007.07.24. (B) Fluridon (Sonar TM) koncentrációja a gyomirtó szerrel kezelt tartályok vízéből 2007.07.24. A fluridon maradványokat a rendszeres kísérleten túl mértük, hogy biztosítsuk a dózis legalább 60 napig történő fenntartását.
Az expozíciós időszak alatt vett üledékmintákban egyik herbicid sem volt kimutatható. Ezenkívül a 2,4-D-t egyik betakarított növényzetben sem mutatták ki. A fluridont a kezelés után 14 és 48 nappal gyűjtött vegetációs mintákban detektáltuk. Az átlagos fluridon-koncentráció (száraz tömeg) a betakarított milfoil hajtásokban és gyökerekben 31,8 (± 20,3, ± 1 szórás) ng/g (száraz tömeg), illetve 14,3 (± 20,3, ± SD) ng/g (száraz tömeg) volt . A gyökér vagy hajtás fluridon tartalmában nem volt szignifikáns különbség a két mintavételi periódus között.
Az E. lecontei stabil populációi minden beoltott tartályban kialakultak, elérve a 2 zsizska/szár célsűrűségét (2,08 ± 0,376, átlag ± 1 SE). A csigákat az összes tartályban alacsony számban találtuk a kísérlet során (0,49 ± 0,12), és nem különböztek szignifikánsan kezeléstől vagy a kezelés utáni dátumtól (χ 2 = 121,5, df = 131, P> 0,1). A caddisflies-eket sok tartályban találták, és a napi ellenőrzések során eltávolították (0,12 ± 0,012), és nem különböztek szignifikánsan a kezelés vagy a kezelés utáni dátum szerint (χ 2 = 56,4, df = 131, P> 0,1).
Növénynövekedés
2. táblázat
A kezeléssel kapott kétirányú ANOVA-k F-értékei, DAT és kölcsönhatásuk, mint tényezők a M. spicatum kémiai paramétereihez.
| C | 10,89 ∗∗ | 1.72 | 3,78 ∗∗ | 1.28 | 0,85 | 1.45 | 1.87 | 1.65 | 0,47 |
| N | 2.65 | 2.09 | 1.04 | 1.41 | 10,27 ∗∗∗ | 0,72 | 1.07 | 2.00 | 2.00 |
| C: N | 5,85 ∗ | 7,34 ∗∗ | 2.10 | 1.57 | 14.55 ∗∗∗ | 1.05 | 0,97 | 0,72 | 1.03 |
| Ash és Organics | 1.07 | 5,47 ∗ | 0,43 | 1.10 | 8,61 ∗∗ | 3,20 ∗ | A minta mérete túl kicsi | ||
| Szénhidrát | 3,87 ∗ | 2.67 | 8,96 ∗∗∗ | 18.52 ∗∗∗ | 2.11 | 31,58 ∗∗∗ | 9,31 ∗∗ | 12,83 ∗∗∗ | 2,52 ∗ |
| Keményítő | 9,65 ∗∗ | 15,71 ∗∗∗ | 5,82 ∗∗∗ | 23,32 ∗∗∗ | 24,27 ∗∗∗ | 5,73 ∗∗∗ | 4,21 ∗ | 20,98 ∗∗∗ | 6,32 ∗∗∗ |
| Fenolok | 1.98 | 8,18 ∗∗∗ | 2,88 ∗ | 1.29 | 2.48 | 0,77 | 2.98 | 2.02 | 0,64 |
S1 TÁBLÁZAT
A kezeléssel kapott kétirányú ANOVA-k F-értékei, DAT és kölcsönhatásuk, mint tényezők a M. spicatum kémiai paramétereihez.
- A herbicid vagy biológiai kezelés közvetlen összehasonlítása a Myriophyllum spicatum Controlon
- A székrekedés Chang Run Tong és Forlaxin kezelésének összehasonlítása idős cukorbetegeknél
- Gyógynövényes akupunktúra az elhízás kezelésére - a biológiai tudományok témája
- Kényszeres túlfogyasztás (mértéktelen étkezési rendellenesség) tünetei, kezelése és okai
- Megemelkedett májenzimek Okai, tünetei, tesztjei és kezelése