Hypertrophiás kardiomiopátia a magas zsírtartalmú étrend okozta elhízásban
Cindy X. Fang
1 Szív- és érrendszeri Kutatóközpont és Alternatív Gyógyászat, valamint 2 Kineziológiai és Egészségügyi Osztály, Wyomingi Egyetem Egészségtudományi Főiskola, Laramie, Wyoming
Feng Dong
1 Szív- és érrendszeri Kutatóközpont és Alternatív Gyógyászat, valamint 2 Kineziológiai és Egészségügyi Osztály, Wyomingi Egyetem Egészségtudományi Főiskola, Laramie, Wyoming
D. Paul Thomas
1 Szív- és érrendszeri Kutatóközpont és Alternatív Gyógyászat, valamint 2 Kineziológiai és Egészségügyi Osztály, Wyomingi Egyetem Egészségtudományi Főiskola, Laramie, Wyoming
Heng Ma
1 Szív- és érrendszeri Kutatóközpont és Alternatív Gyógyászat, valamint 2 Kineziológiai és Egészségügyi Osztály, Wyomingi Egyetem Egészségtudományi Főiskola, Laramie, Wyoming
Leilei He
1 Szív- és érrendszeri Kutatóközpont és Alternatív Gyógyászat, valamint 2 Kineziológiai és Egészségügyi Osztály, Wyomingi Egyetem Egészségtudományi Főiskola, Laramie, Wyoming
Jun Ren
1 Szív- és érrendszeri Kutatóközpont és Alternatív Gyógyászat, valamint 2 Kineziológiai és Egészségügyi Osztály, Wyomingi Egyetem Egészségtudományi Főiskola, Laramie, Wyoming
Absztrakt
A villafej transzkripciós faktorok Foxo alcsaládja, beleértve a Foxo1 (FKHR), Foxo3a (FKHRL-1) és a Foxo4 (AFX) alcsoportot, az Akt (20) downstream célpontja. Az Akt foszforiláció a Foxo nukleáris kizárását (gátlását) eredményezi. A Foxo által kiváltott, jól megalapozott sejtes válaszok mellett, beleértve a differenciálódást, az anyagcserét, a proliferációt, a túlélést és a vázizom atrófiáját (20, 37), ezt a transzkripciós faktort kardiomiocita atrófiában is jelezték, amely magában foglalja az atrogének kaszkádjának szabályozását (36)., 37, 46). A vázizomzatban az atrogéneket a Foxo-faktorok növekedési faktor-Akt által közvetített transzkripciós szabályozása szabályozza (35, 37). Nemrégiben bebizonyosodott, hogy a Foxo transzkripciós faktorok kardiomiocitákban expresszálódnak a növekedési faktorok/Akt jelátvitel szabályozása alatt. A Foxo kontrollálhat egy atrogén transzkripciós programot a szívizom méretének szabályozására a szív hipertrófiájának többféle szabályozója után (40).
ANYAGOK ÉS METÓDUSOK
Nagy zsírtartalmú étrend etetés és szérumparaméterek.
Echokardiográfiai értékelés.
A szív geometriáját és működését érzéstelenített (Avertin 2,5%, 10 μl/g testtömeg ip) egerekben értékeltük kétdimenziós irányított M-módú echokardiográfiával (Phillips Sonos 5500), amely 15-6 MHz-es lineáris átalakítóval (Phillips Medical Systems, Andover, MD). Az elülső és hátsó falvastagságokat, valamint a diastolés és szisztolés bal kamrai dimenziókat M-módú képekről rögzítettük az American Echocardiography Society által elfogadott módszerrel. A frakcionált rövidülést kiszámítottuk a végdiasztolés átmérőből (EDD) és a vég-szisztolés átmérőből (ESD) az (EDD-ESD)/EDD egyenlet felhasználásával. A bal kamra becsült echokardiográfiai (LV) tömegét [(LVEDD + septum falvastagság + hátsó falvastagság) 3 - LVEDD 3] × 1,055 értékkel számoltuk, ahol 1,055 (mg/mm 3) a szívizom sűrűsége. A pulzusszámot átlagoltuk 10 szívciklus alatt (14).
A kardiomiociták izolálása.
A ketamin/xilazin szedáció után a szíveket eltávolítottuk és Krebs-Henseleit-hidrogén-karbonát-pufferrel perfundáltuk, amely (mM-ben) a következőket tartalmazta: 118 NaCl, 4,7 KCl, 1,2 MgSO4, 1,2 KH2PO4, 25 NaHCO3, 10 HEPES és 11,1 glükóz. A szíveket 20 percig emésztettük kollagenáz D-vel. A bal kamrákat leszűrjük, majd leszűrjük. A miocita-hozam ~ 75% volt, amelyet a magas zsírtartalmú étrendi táplálás nem befolyásolt. A mechanikus és intracelluláris Ca 2+ vizsgálatban csak tiszta alakú élű rúd alakú myocytákat választottak ki (12).
A sejtek rövidülése és megerősítése.
A kardiomiociták mechanikai tulajdonságait IonOptix soft-edge rendszer (IonOptix, Milton, MA) alkalmazásával értékeltük. A miocitákat az Olympus IX-70 mikroszkóp színpadára szerelt kamrába helyeztük, és 1 mM CaCl2-t tartalmazó Krebs-Henseleit-hidrogén-karbonát-pufferral szuperfúzióval (~ 2 ml/perc 25 ° C-on). A miocitákat 0,5 Hz-es frekvencián stimuláltuk, hacsak másképp nem említettük. A sejtek rövidülését és megerősödését értékeltük, beleértve a csúcs rövidülést (PS) - a csúcs kontraktilitását; idő a PS-hez (TPS) - összehúzódás időtartama; a 90% -ig tartó erősítés ideje (TR90) - relaxációs időtartam; és a rövidülés/megerõsödés maximális sebessége (± dL/dt) - és a maximális nyomásfejlõdés és csökkenés (12).
Intracelluláris Ca 2+ tranziensek.
A miociták egy csoportját 10 percig fura 2-AM-mel (0,5 μM) töltöttük, és a fluoreszcencia intenzitását kettős gerjesztésű fluoreszcencia fotomultiplikátor-rendszerrel (Ionoptix) rögzítettük. A miocitákat egy Olympus IX-70 invertált mikroszkópra helyeztük, és a képeket Fluor × 40 olaj objektíven keresztül készítettük. A sejteket 75 W-os lámpa által kibocsátott fénynek tettük ki, és egy 360 vagy 380 nm-es szűrőn áthaladtunk, miközben 0,5 Hz-en stimulálódtak. A fluoreszcencia-emissziókat 480–520 nm között detektáltuk, és a két hullámhosszon (360/380) a Fura 2 fluoreszcencia intenzitásának (FFI) kvalitatív változására következtettünk. A fluoreszcencia bomlási idejét (egyszeri vagy biexponenciális bomlás) az intracelluláris Ca 2+ tisztulás indikátoraként számoltuk (12).
Caspase-3 assay.
A kaszpáz-3 aktivitást a közzétett módszer szerint határoztuk meg (23). Röviden, 1 ml PBS-t adunk egy bal kamrai szövet homogenizátumokat tartalmazó lombikba, majd 10 000 g-vel 4 ° C-on 10 percig centrifugáljuk. A felülúszót eldobtuk, és a homogenátumokat 100 μl jéghideg sejtlízis pufferben (50 mM HEPES, pH 7,4, 0,1% CHAPS, 1 mM DTT, 0,1 mM EDTA és 0,1% NP-40) lizáltuk. A vizsgálatot 96 lyukú lemezen hajtottuk végre, minden egyes lyukban 30 μl sejtlizátumot, 70 μl vizsgálati puffert (50 mM HEPES, 0,1% CHAPS, 100 mM NaCl, 10 mM DTT és 1 mM EDTA) és 20 μl kaszpáz-3 kolorimetriás szubsztrát Ac-DEVD-pNS (Sigma). A 96 üreges lemezt 37 ° C-on inkubáltuk 1 órán át, és ezalatt a mintában lévő kaszpázt hagytuk hasítani a kromofor p-NA-t a szubsztrátmolekulából. Az abszorpciót 405 nm-en detektáltuk, a kaszpáz-3 aktivitás arányos volt a színreakcióval. A fehérjetartalmat Bradford módszerrel határoztuk meg. A kaszpáz-3 aktivitást mikrogramm fehérje percenként felszabaduló pNA pikomoljaiként fejeztük ki.
Caspase-3/7 assay.
A kaszpáz-3 és a kaszpáz-7 aktivitást Apo-ONE homogén kaszpáz-3/7 vizsgálati készlet alkalmazásával határoztuk meg (Promega, Madison, WI). A kaszpáz-3 és a kaszpáz-7 a cisztein-aszparaginsav-specifikus proteáz (kaszpáz) család tagjai, amelyek kulcsszerepet játszanak az emlős sejtek apoptózisában. Röviden: kaszpáz-3 és kaszpáz-7 aktivitásokat detektáltunk az apoptózisban lévő sejtekben egy rodamin 110, bisz-N-CBZ-l-aszpartil-l-glutamil-l-valil-l-aszparaginsav-amid (Z- DEVD-R110) szubsztrát, amely a vizsgálat előtt profluoreszcens szubsztrátként létezik. Az Apo-ONE kaszpáz-3/7 vizsgálat elvégzéséhez összekevertünk és hozzáadtunk egy kaszpáz-3/7 puffert és a Z-DEVD-R110 szubsztrátot a bal kamrai szövet homogenizátumához. A DEVD peptidek egymás utáni hasításával és kaszpáz-3 és kaszpáz-7 aktivitással történő eltávolításával az R110 kilépő csoport intenzíven fluoreszkálóvá válik 499 nm gerjesztési hullámhosszon és 521 nm emissziós hullámhosszon. A kaszpáz-3 és a kaszpáz-7 aktivitás egyenesen arányos volt az R110 fluoreszcenciával, és nettó fluoreszcenciaként volt kifejezve (2).
Ex vivo domináns-negatív Foxo3a transzfekció és Western blot elemzés.
Teljes RNS extrakció, cDNS szintézis, reverz transzkripció és valós idejű PCR.
Adatelemzés.
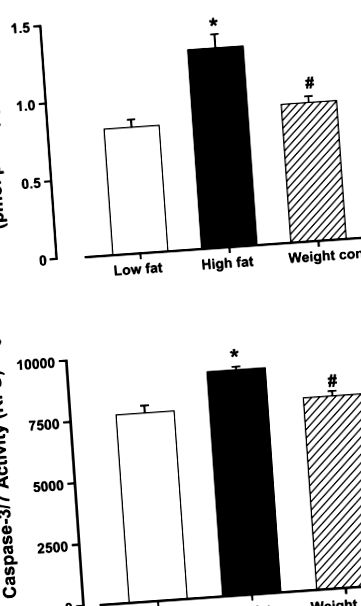
Az adatok átlag ± SE. A statisztikai összehasonlítást ANOVA-val, majd Newman-Keuls post hoc tesztekkel végeztük. A jelentőséget P táblázatként határoztuk meg (1. táblázat). A magas zsírtartalmú étrend ad libitum táplálása kiváltotta a szívizom apoptózisának emelkedését a kaszpáz-3 és a kaszpáz-3/7 aktivitásvizsgálatok alapján, amelyet enyhített a magas zsírtartalmú diétás étel korlátozása (1. ábra).
A súlyhoz igazított kontroll a zsírtartalmú diétás ételek korlátozása. EDD, végdiasztolés átmérő; ESD, vég-szisztolés átmérő; LV, bal kamra. Az adatok átlag ± SE; n = nem. állatok.
A magas zsírtartalmú étrend okozta elhízás jelentősen megnövekedett kardiomiocita keresztmetszeti területtel, csökkent ± dL/dt, valamint elhúzódó TPS és TR90 normál PS-vel járt (2. ábra), némileg emlékeztetve korábbi megállapításunkra (33). Ezenkívül a magas zsírtartalmú, elhízott egerekből származó kardiomiociták szignifikánsan megemelkedett kiindulási intracelluláris Ca 2+ -szintet, depressziós intracelluláris Ca 2+ emelkedést mutattak az elektromos ingerre adott válaszként (ΔFFI), és csökkentették az intracelluláris Ca 2+ bomlási sebességét (akár egyszeres, akár biexponenciális görbe illeszkedés; 3. ábra). Ezeket a kardiomiocita mechanikus és intracelluláris Ca 2+ defektusokat, amelyek a magas zsírtartalmú étrend okozta elhízáshoz kapcsolódnak, a súlykontroll manőver jelentősen csillapította. Ennek ellenére a magas zsírtartalmú étrend élelmiszer-korlátozása kissé, de jelentősen meghosszabbította a TR90 és a biexponenciális intracelluláris Ca 2+ bomlást anélkül, hogy bármilyen más indexet befolyásolt volna (2F. És 3D 3D ábra).
Tanulmányunk egyik meglehetősen érdekes megállapítása azt ábrázolta, hogy a DN Foxo3a vírus megnövekedett bazális Akt foszforilációt és hipertrófiás GATA4 fehérjét utánzott a magas zsírtartalmú étrenddel összefüggő elhízásban. A GATA4 magas zsírtartalmú étrend által kiváltott elhízásban történő szabályozása szinkronban van az atrófia-specifikus géntranszkripció downregulációjával, hogy elősegítse a szív hipertrófiáját és a valószínűleg hipertrófiás kardiomiopátiát. Ezt a felfogást erősítik azok a megállapítások, amelyek szerint a palmitinsav közvetlenül elősegítette a GATA4 expresszióját a H9C2 myoblastokban. A zsírszövetből felszabaduló túlnyomórészt telített szabad zsírsav, a palmitinsav szintje megemelkedik az elhízásban, és hozzájárul az elhízással kapcsolatos kardiovaszkuláris szövődményekhez (51). A magas zsírtartalmú étrend okozta elhízás esetén az elfojtott atrófia gén transzkripciójáért felelős sejtmechanizmus nem teljesen ismert, bár a transzkripciós koaktivátor PGC-1α (peroxiszóma proliferátor által aktivált receptor-γ koaktivátor) és a Foxo transzkripciós faktor közötti kölcsönhatás szerepet játszhat ( 36). További tanulmány indokolt az atrófia gén transzkripciójának szabályozásának megvizsgálására magas zsírtartalmú étrend bevitele után, elhízás kialakulásával vagy anélkül.
Ex vivo adataink egy lehetséges előremenő mechanizmust is javasoltak az Akt és a Foxo3a downstream jelátviteli molekulája között, mivel a mutáns Foxo3a transzfekciója stimulálta az Akt foszforilációt. Ezt az előremenő forgatókönyvet támasztja alá az a felfogás, hogy az atrofin gén, az atrogin-1 a villafehérjék ubiquitin-függő koaktiválásával gátolja az Akt-függő szívhipertrófiát (22). Mindazonáltal jelen tanulmányunk nem mutatott ki semmilyen változást az ubiquitin expressziójában a magas zsírtartalmú étrend okozta elhízás hatására, nem támogatva az ubiquitin-asszociált fehérje lebontásának szerepét a szív hipertrófiájában és a magas zsírtartalmú étrend okozta elhízásban. Az ubiquitin-proteázóma egy hordó alakú proteáz, amely képes legalább négy ubiquitin-maradékkal díszített fehérjék felismerésére és megsemmisítésére (31). Hasonlóképpen, adataink a kalcineurin valószínűtlen szerepét is jelezték a szív hipertrófiájában és a kontraktilis diszfunkcióban a magas zsírtartalmú étrend okozta elhízásban.
Az atrogin-1 egy F-box fehérje, amely gátolja a szív hipertrófiáját azáltal, hogy részt vesz egy Akt- és ubiquitin-ligáz-függő útvonalon. Ennek eredményeként a hipertrófiás promóter kalcineurin lebomlik. Feltételezték, hogy az atrogin-1 nem befolyásolja magát az Akt aktivitást, inkább koaktivátorként szolgál a villafej transzkripciós faktorainak tagjai számára az Akt-tól lefelé (22). Az atrogin-1 szívtúlzott expressziójú egerei a szabályozott villafej transzkripciós tényezőket mutatták ki, amelyek a szív hipertrófiájának elnyomásával párhuzamosan következtek be, míg az atrogin-1 hiányában szenvedő egerek ellentétes fiziológiai fenotípust mutattak, ami arra utal, hogy az atrogin-1 megzavarhatja a szív hipertrófiáját a villafej transzkripciós tényezőire gyakorolt hatása révén (22 ). Ezt az elképzelést támasztják alá az elnyomott atrogin-1 mRNS expresszió és az emelkedett bazális Foxo3a foszforiláció (az aktív transzkripciós faktor kevesebb expressziója) kísérleti adataink, bár ez a folyamat független lehet az ubiquitin-proteaszóma rendszertől és a kalcineurintól.
Kísérleti korlátozások
Összefoglalva, tanulmányunk bizonyítékokat kínált fel arra vonatkozóan, hogy a magas zsírtartalmú étrend okozta elhízásban a geometriai, a szívizom kontraktilis és az intracelluláris Ca 2+ rendellenességek összefüggésbe hozhatók az elnyomott villafej transzkripciós faktorral (emelkedett bazális Foxo3a foszforiláció) és atrófiaspecifikus gén transzkripcióval. Tekintettel a DN Foxo3a adenovírus által kiváltott, magas zsírtartalmú étrendre vagy palmitinsavra emlékeztető hipertrófiás fehérjék Akt foszforilációjára és upregulációjára gyakorolt hatására, adataink alátámasztják azt az új hipotézist, miszerint a magas zsírtartalmú étrend okozta elhízás (esetleg inzulinrezisztencia és 2-es típusú cukorbetegség) ) az Akt krónikus aktiválása révén elnyomja a villafej transzkripciós faktort. A krónikus Akt-aktiválás képes felülbírálni a Foxo által kiváltott növekedésgátló programot. Hasonlóképpen más hipertrófiás agonisták, például az angiotenzin II kiválthatják a Foxo fehérjék inaktiválását kardiomiocitákban foszfatidil-inozitol-3-kináz/Akt-függő mechanizmus révén. Feltétlenül meg kell vizsgálni az Akt-forkhead transzkripciós faktorok szerepét az elhízásban és a cukorbetegség okozta szívhipertrófiában és hipertrófiás kardiomiopátiában, hogy optimális terápiás stratégiák érhetők el ezen jelátviteli kaszkádon.
TÁMOGATÁSOK
Ezt a munkát részben az American Heart Association Pacific Mountain Affiliate (# 0355521Z) és a Wyomingi Egészségügyi Egyetem Északi-Sziklás-szigetek Regionális Intézményfejlesztési Díj Biomedikai Kutatási Kiválóság Hálózata (# 5P20RR016474) támogatta.
- A magas zsírtartalmú étrend által kiváltott elhízás különböző reakcióival összefüggő genetikai lókuszok azonosítása
- Megnövekedett szívizomérzékenység az ismétlődő ischaemiára magas zsírtartalmú étrend okozta elhízás esetén
- A hosszú távú dysbiosis elősegíti az inzulinrezisztenciát az elhízás során a gyors étrend okozta változások ellenére
- Hipertrófiás kardiomiopátia - tünetek, tesztek, kezelések
- A fogyás hiánya az angiotenzin AT1 receptor blokkolása után az étrend okozta elhízásban részben