Kalóriakorlátozás és szakaszos böjt: Két lehetséges étrend a sikeres agyöregedés érdekében
Bronwen Martin
Idegtudományi Laboratórium, Nemzeti Öregedési Intézeti Kutatási Program, 5600 Nathan Shock Drive, Baltimore, MD 21224, Egyesült Államok
Mark P. Mattson
Idegtudományi Laboratórium, Nemzeti Öregedési Intézeti Kutatási Program, 5600 Nathan Shock Drive, Baltimore, MD 21224, Egyesült Államok
b Idegtudományi Tanszék, Johns Hopkins Egyetem Orvostudományi Kar, 750 Wolfe Street, Baltimore, MD 21205, Egyesült Államok
Stuart Maudsley
Idegtudományi Laboratórium, Nemzeti Öregedési Intézeti Kutatási Program, 5600 Nathan Shock Drive, Baltimore, MD 21224, Egyesült Államok
c Medstar Research Institute, Harbour Hospital, 3001 S. Hanover Street, Baltimore, MD 21225, Egyesült Államok
Absztrakt
Az idegrendszer sebezhetősége az életkor előrehaladtával szemben túl gyakran olyan neurodegeneratív rendellenességekben nyilvánul meg, mint az Alzheimer- és a Parkinson-kór. Ebben az áttekintő cikkben olyan bizonyítékokat írunk le, amelyek arra utalnak, hogy két diétás beavatkozás, a kalória-korlátozás (CR) és az időszakos éhezés (IF), meghosszabbíthatja az idegrendszer egészségi idejét azáltal, hogy hátráltatja az alapvető metabolikus és sejtes jelátviteli utakat, amelyek szabályozzák az élettartamot. A CR és az IF befolyásolja az energia- és oxigéngyökök anyagcseréjét, valamint a sejtes stresszválasz rendszereket, olyan módon, amely megvédi az idegsejteket azon genetikai és környezeti tényezőktől, amelyeknek egyébként az öregedés során engednének. Számos interaktív út és molekuláris mechanizmus létezik, amelyek révén a CR és az IF előnyös lehet az idegsejtek számára, ideértve azokat, amelyek inzulinszerű jelátvitelt, FoxO transzkripciós faktorokat, sirtuinokat és peroxiszóma proliferátor által aktivált receptorokat tartalmaznak. Ezek az utak serkentik a fehérje chaperonok, a neurotróf faktorok és az antioxidáns enzimek termelését, amelyek mind segítik a sejteket a stressz kezelésében és a betegségekkel szembeni ellenállásban. A CR és IF öregedő idegrendszerre gyakorolt hatásának jobb megértése valószínűleg új megközelítéseket fog eredményezni a neurodegeneratív rendellenességek megelőzésében és kezelésében.
1. Bemutatkozás
2. Az öregedéssel és a degenerációval járó molekuláris hatások
3. Élettartam és egészségi idő meghosszabbítása kalóriakorlátozással és szakaszos böjtöléssel
A történelem során számos társadalom felismerte az élelmiszer-bevitel korlátozásának bizonyos időtartamokra gyakorolt jótékony hatásait az egészségre és az általános jóllétre, akár vallási okokból, akár akkor, amikor kevés volt az élelmiszer. Az első széles körben elismert tudományos tanulmányt a korlátozott étrendről és az életük meghosszabbításának képességéről McCay és mtsai. (1935). McCay kimutatta, hogy a patkányok emészthetetlen cellulózt tartalmazó étrenddel való táplálása drámai módon meghosszabbította mind az átlagos, mind a maximális élettartamot ezekben az állatokban (McCay et al., 1935). Számos tanulmány megerősítette ezt az eredményt, és kiterjesztette az egerekre (Weindruch és Walford, 1988; Sprott, 1997) és más fajokra, beleértve a gyümölcslegyeket (Chapman és Partridge, 1996), a fonálférgeket (Houthoofd et al., 2002), a vízibolhákat, a pókokat és hal (Weindruch és Walford, 1988).
4. CR és IF neuroprotektív molekuláris mechanizmusai
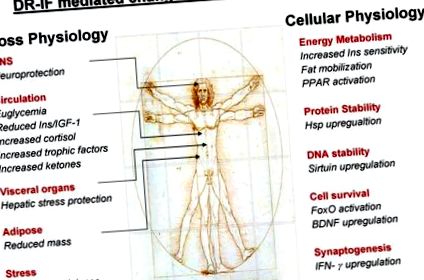
Az ebben az áttekintésben leírt állatkísérletek adatai azt mutatják, hogy a patkányok és egerek agyában a CR vagy IF kezelés mellett fenntartott neuronok fokozottan ellenállnak az oxidatív, metabolikus és excitotoxikus sértésekkel szemben. Az a kritikus kérdés, amelyet e vizsgálatok kapcsán fel kell tennünk, melyek azok a molekuláris mechanizmusok, amelyek védelmet nyújtanak a számtalan erős sejtsértés ellen? A kutatók számos fontos fehérje és lipid mérésével foglalkoztak ezzel a kérdéssel, amelyekről ismert, hogy szerepet játszanak az idegsejtek sokféle sértéstől való megvédésében. Megbeszéljük és bemutatjuk, hogy a CR/IF-re milyen komplex fiziológiai válasz jelentkezik a szervezetben, és ez hogyan eredményezheti az egészséges öregedést.
4.1. Stressz válaszok
A túlzott neurológiai stressz gyakran a megnövekedett glutamaterg neurotranszmisszió formájában jelentkezik, pl. iszkémiás események vagy epilepsziás rohamok esetén a sejtek túlzott kalciumterhelést okozhatnak, amelyet a nyilvánvaló glutamát-felszabadulás indukál, ami esetleges sejthalált eredményez. Az excitoxikus sejtpusztulás ezen formáját utánozhatjuk a kaininsav (KA) injekciójával a kísérleti állatok agykamráiba/agyi régióiba. Amikor az excitotoxikus KA-t az egerek hátsó hippokampuszába injektálják, az rohamokat és piramis idegsejtek károsodását idézi elő a CA3 és CA1 régiókban (Duan és mtsai, 2001). Jelentős növekedés a CA3 és CA1 idegsejtek túlélésében az IF egerekben az ad libitum táplált egerekhez képest, miután bebizonyosodott a kainikus sértés (Anson és mtsai, 2003).
4.2. Neurotróf tényezők
Mivel mind az IF, mind a CR enyhe stresszreakciót vált ki az agysejtekben, ez a kompenzációs mechanizmusok, pl. a neurotróf faktorok, így a BDNF és a gliasejtből származó neurotróf faktor (GDNF), valamint a fent említett hősokk-fehérjék (Bruce-Keller és mtsai, 1999a, b; Duan és Mattson, 1999; Duan és mtsai, 2003; Maswood et al., 2004). Ha bebizonyosodott, hogy az IF kezelési rendje enyhíti és csillapítja az idegsejt károsodását, és javítja a funkcionális eredményt a neurológiai traumák állatmodelljeiben, például agyvérzésben (Yu és Mattson, 1999), valamint olyan neurodegeneratív rendellenességekben, mint a Parkinson-kór (Duan és Mattson, 1999), valamint Huntington-kórban betegség (Duan és mtsai, 2003). Az IF neuroprotektív mechanizmusa nem ismert, de arról számoltak be, hogy az IF agyi eredetű neurotróf faktor (BDNF) termelését indukálja, amely patkányokban és egerekben fokozott hippokampusos neurogenezissel járt (Lee és mtsai., 2002). Úgy tűnik, hogy a BDNF-nek tulajdonított egyik elsődleges neuroprotektív mechanizmus a rokon TrkB-receptor BDNF-közvetített aktivációjának képessége, amely ezután több jelátviteli út stimulálását vonja maga után. E TrkB jelátviteli útvonalak közül kiemelkedő a foszfatidil-inozitol-3-kináz (PI3K)/protein-kináz B (Akt) útvonal, amely számos CR/IF-védőmechanizmusban szerepet játszik, amelyekről ebben a felülvizsgálatban hosszabb ideig foglalkozunk.
4.3. Keton testek
Az étrendi koplalásról ismert, hogy fokozott ketontest-termelést eredményez, pl. β-hidroxi-butirát, amelyet a szervezet energiaforrásként használhat a korlátozott glükóz hozzáférhetőség mellett (Mitchell et al., 1995; Vazquez et al., 1985). A ketogenezissel kapcsolatban úgy tűnik, hogy az IF kezelési módok jobban megfelelnek ennek az energiatermelési útnak, mint a szigorúbb CR protokollok. Kimutatták, hogy az IF-kezelési módú egerek súlya átlagosan nagyobb, mint a CR-s kezelési módban szereplő egereknél. Nagyobb zsírtartalékaik és nagyobb ketogén válaszuk is van, mint a CR egereknek. Ha a táplálkozási rendszerek kétszeresére növelhetik a béta-hidroxi-butirát éhomi éhomi koncentrációját az ad libitummal táplált egerekhez képest (Anson et al., 2003). Ez a ketogenezisre való áttérés közvetlen szerepet játszhat az IF citoprotektív hatásaiban, mert beszámoltak arról, hogy a ketogén étrendet tápláló patkányok fokozottan ellenállnak a rohamokkal szemben (Bough et al., 1999), és hogy a β-hidroxi-butirát maga képes megvédeni az idegsejteket az Alzheimer- és a Parkinson-kór rágcsálómodelljeiben (Kashiwaya et al., 2000). A ketogén diétákat, amelyek elősegítik az anyagcserét a glükóz felhasználásától a ketogenezishez, néhány epilepsziában szenvedő beteg számára is előírják (Gilbert és mtsai., 2000), mivel ez megelőzően szolgál a progresszív excitotoxikus idegsejtkárosodás és degradáció ellen, amely bekövetkezhet, ha az állapotot nem kezelik.
4.4. Glükóz/inzulin jelátvitel
Böjt vagy étrendi korlátozás során a szervezet elsődleges változása a glükóz rendelkezésre állása az oxidatív légzéshez. Azok a mechanizmusok, amelyek révén az alternatív forrásokból nyerik az energiát, vagy a maradék glükóz kezelésének módja, fontos a CR/IF kezelések egészségügyi előnyeinek extrapolálásához. A glükózkezelési hatékonyság fontossága az egészséges öregedés szempontjából bizonyítható azzal, hogy a vérben az idő múlásával integrált glükózszintről feltételezik, hogy magas szintű nem enzimatikus glikációhoz vezet, amely a fehérje károsodásának egyik formája. Kimutatták, hogy a CR specifikusan csillapítja az oxiradikális termelést és károsodást (Weindruch és Sohal, 1997) és a nem enzimatikus glikációt (Cefalu et al., 1995).
4.5. Citokinek
4.6. A jóllakottság és a zsír által generált hormonok
4.7. Sirtuins
Alsó organizmusként pl. az élesztő- és fonálférgek lényegesen rövidebb élettartammal rendelkeznek, mint az emlősök, amelyek hasznosnak bizonyultak az egészséges élettartam molekuláris meghatározóinak felfedezésében. Nyilvánvalóvá vált, hogy az alacsonyabb élőlények élettartamát ellenőrző számos tényező közül ezek közül sok a kalóriabevitel változását is összekapcsolja az egészségi idő növekedésével, amelyet a betegség folyamatainak étrendi beavatkozásai kívánnak.
4.8. A peroxiszóma proliferátor-aktivált receptor (PPAR) és társfaktorok
A PPAR-k, mint láttuk, a transzkripciós faktorok nukleáris hormon receptorainak alcsaládjának tagjai. A PPAR-k funkcionális heterodimereket képeznek retinoid X receptorokkal (RXR), és ezek a heterodimerek szabályozzák a különféle gének transzkripcióját. A PPAR-knak három ismert altípusa van: α, δ és γ. Ezek a nukleáris receptor transzkripciós faktorok szabályozzák a tápanyagok transzportjában és anyagcseréjében részt vevő géneket, valamint a stresszel szembeni ellenállást. Maguk a PPAR-k az RXR mellett más fehérjéket is toboroznak, hogy közvetítsék teljes működésüket. Az egyik ilyen fehérje a peroxiszóma-proliferátor-aktivált receptor γ (PPARy) koaktivátor 1 (PGC-1). Kimutatták, hogy ezt a koaktivátort az alacsonyabb organizmusok és a magasabb emlősök étrendjének megváltoztatása szorosan szabályozza. A PGC-1 két izoformában, az α és a β-ban létezik, és ezek az izoformák a kalóriadefektivitásra adott adaptív válaszok kiemelkedő szabályozóiként jelentek meg. A PGC-1 számos nukleáris receptor, köztük a PPAR-k ligandfüggő és független aktivációját szabályozza. Beszámoltak a PGC-1α életkorfüggő csökkenéséről (Ling et al., 2004), amely súlyosbíthatja az öregedési folyamatot. Egerekben és főemlősökben azonban kimutatták, hogy a CR megfordítja a PGC-1α, a PPAR és a szabályozott gének ezt az életkorfüggő csökkenését (Weindruch et al., 2002; Kayo et al., 2001).
Az emlősökben a PGC-1 izoformákat transzkripciós vagy poszttranszlációs úton szabályozzák, számos jelátviteli út kapcsolódik a CR/IF és az élettartam-meghosszabbítás kapcsolatához. Ide tartoznak a villás doboz „egyéb” (FoxO) transzkripciós faktorai (inzulin/inzulinszerű növekedési faktor-I-függő útvonalon keresztül), glükagon-stimulált sejtes AMP (cAMP) válaszelem-kötő fehérje (CREB), stressz-aktivált protein-kinázok (p38 és c-jun N-terminális kináz) és nem meglepő módon a SIRT1. A következőkben megvitatjuk, hogy ezek a tényezők hogyan hatnak egymással a CR/IF molekuláris mechanizmusainak szabályozására, amelyek hatással vannak az egészséges öregedésre való transzlációra.
4.9. FoxO transzkripciós tényezők
A kalória-korlátozás vizsgálatának egyik legutóbbi legfontosabb területe annak demonstrálása, hogy a CR képes megakadályozni maga a rák többféle formájának kialakulását. Például a genetikailag gyengített p53-szinttel rendelkező egerekben a CR körülbelül 75% -kal növelte a spontán tumor kialakulásának latenciáját (főleg limfómák) (Hursting et al., 2001). Ezért nyilvánvaló, hogy finom és bonyolult kapcsolat van ezek között a kapcsolódó tényezők között, amelyeket az étrendi energia bevitel változásai kapcsolnak össze.
Az inzulin/IGF-1 jelátvitel és a p53 negatív szabályozása mellett a FoxO faktorokat a CREB kötő fehérje (CBP) és egy rokon fehérje, a p300 szabályozza. Érdekes módon a CBP (Daitoku és mtsai, 2004) vagy a p300 (Fukuoka és mtsai, 2003) sejtes túlzott expressziója fokozza a FoxO faktorok képességét a funkcionális génexpresszió aktiválására. Úgy tűnik, hogy a SIRT1 ismét központi szerepet játszik az energiaszabályozás adaptív változásaiban, mivel megfordíthatja a FoxO családtagjainak CBP általi negatív szabályozását. A PGC-1-hez hasonlóan a SIRT1-szint is emelkedik a CR során a patkány májban, és az inzulin és az IGF-I negatívan szabályozza őket (Cohen és mtsai, 2004). Ezenkívül a rokon családtag, a SIRT3, egy mitokondriális fehérje, megnövekedett expressziót mutat a fehér és a barna zsírban CR-vel szemben (Shi et al., 2005).
Úgy tűnik, hogy a FoxO-k a sejtek stresszreakcióit és az esetleges túlélési mechanizmusokat összekötő mechanizmusok közötti összefüggésben vannak. Például a stresszhez kapcsolódó cJun N-terminális kináz 1 (JNK-1), amely molekuláris érzékelőként szolgál a különféle stresszorok számára, aktívan képesek szabályozni a FoxO transzkripciós hatását. C. elegans-ban a JNK-1 közvetlenül kölcsönhatásba lép és foszforilálja a FoxO homológot, a Daf-16-at, és a hőstresszre reagálva a JNK-1 elősegíti a Daf-16 transzlokációját a sejtmagba. A JNK-1 túlzott expressziója C. elegans-ban az élettartam növekedéséhez és a túlélés növekedéséhez vezet a hőstressz után (Oh et al., 2005). A D. melanogasterben is a JNK enyhe aktiválása fokozott stressztoleranciához és hosszú élettartamhoz vezet (Wang et al., 2003), amely egy intakt FoxO-tól függ (Wang et al., 2005).
Összegzésképpen úgy tűnik, hogy a FoxO transzkripciós faktorok ígéretes jelöltek, amelyek molekuláris kapcsolatokként szolgálnak az étrend módosításai és a hosszú élettartam között. Olyan körülmények között, mint a CR/IF, ahol az inzulin/IGF-1 keringő szintjét csökkentik az euglikémia javítása érdekében, a FoxO nukleáris transzlokáció egy sor olyan célgén sorozat felfelé történő szabályozását eredményezi, amelyek elősegítik a sejtciklus leállását, a stressz-ellenállást és az apoptózist. A külső stresszes ingerek kiváltják a FoxO-faktorok áttelepülését a sejtmagba, ezáltal adaptív választ adva a stressz-ingerekre. Összhangban azzal a felfogással, hogy a stressz-ellenállás nagymértékben párosul az élettartam meghosszabbításával, a FoxO transzkripciós faktorok aktiválása a férgekben és a legyekben növeli a hosszú élettartamot. A FoxO fehérjék a környezeti ingereket, köztük a kalóriakorlátozás által kiváltott stresszt, gén expressziós programok változásaiba fordítják, amelyek összehangolhatják a szervezet egészséges öregedését és végül a hosszú élettartamot.
5. Kalória-korlátozás emberben?
Megközelítjük a különféle molekuláris mechanizmusok átfogó megértését, amelyek révén a kalóriabevitel változásai átvihetők a sejtek fokozott túlélésére az öregedési folyamat során. Azonban továbbra is kérdés, hogy a CR és az IF jótékony hatással lesz-e az emberre. A mai napig nem voltak jól kontrollált tudományos vizsgálatok a hosszú távú CR emberekre gyakorolt hatásainak meghatározására. Jelenleg folyamatban vannak olyan vizsgálatok, amelyek 30% CR-t tartalmaznak nem főemlősökön (rhesus majmok), és ezekből a vizsgálatokból származó adatok ígéretesnek tűnnek, mivel támogatták ennek a táplálkozási rendszernek az életet és az egészséget meghosszabbító tulajdonságait (Lane et al., 1995, 1996).
A testzsír túlzott csökkenése és a nemi szteroidok ezzel egyidejű csökkenése azonban menstruációs rendellenességekhez, amenorrhea-hoz, csontvesztéshez és csontritkulás kialakulásához vezethet a nőknél. Talán a CR/IF protokollok olyan variációja, amelyben enyhébb kalóriakorlátozás van, és az etetési gyakoriság megváltozása kombinálva, nagyobb valószínűséggel képes megfelelni az emberi alanyok körében. Remélhetőleg az étrendi táplálékbevitelnek ez a szelídebb megváltoztatása továbbra is megőrzi az eddig alkalmazott kísérleti rendszerek előnyeit. Érdemes megjegyezni, hogy a mai napig a CR-t használó legtöbb tanulmány összehasonlította a CR jótékony hatásait a túlsúlyos (vagy akár elhízott), életkornak megfelelő kontrollállatokkal. Nem világos, hogy az egészséges testtömegű állatok, akik képesek részt venni a rendszeres testmozgásban és rendelkeznek valamilyen mentális ingerléssel (mint a vadonban), részesülnek-e a CR rendszer előnyeiből. A legutóbbi, 25% CR-vel rendelkező, humán alanyokkal végzett vizsgálatok azonban megpróbálják ezt megoldani, mivel normál testtömeg-indexű kontroll alanyokat alkalmaznak.
A kémiai CR-utánzó kifejlesztése ígéretes terápiás lehetőség lehet a neurodegeneratív betegségek kezelésében és az öregedési folyamat késleltetésében, mivel hasonló egészségügyi előnyökkel járna, mint a CR (például az egészségi és az életciklus meghosszabbítása), miközben megkerüli a hosszú távon csökkenteni kell a táplálékfelvételt. Azt azonban továbbra is meg kell vizsgálni, hogy a CR utánzó szer megvalósítható-e a gyógyszer előállítására, különösen azért, mert a CR védőhatásait kifejtő folyamatok felértékelődése még mindig kissé hiányos, és a mögöttes mechanizmusok nagyon összetettnek bizonyulnak. Nem szabad figyelmen kívül hagyni a táplálékbevitel pszichológiai hatásait sem magasabb, introspektívebb organizmusokban, például az emberekben. Szinte egyedülálló érzelmi kapcsolat van bennünk az élelmiszerek hatalmas változatosságával. Ezért ennek a pszichológiai segítségnek az eltávolítása CR/IF-szerű rendszer alatt részben ellensúlyozhatja e paradigmák fiziológiai előnyeit.
A fő tényező, amely tagadhatja a CR/IF hatékony gerontoterápiás módszerek széles körű alkalmazását, potenciálisan a modern nyugati életmód, amely szinte állandó munkát és tartósan magas stresszszintet mutat. Ezért a megszokott társadalom és technológiai fejlődés felépítése érdekében az ősi őseink táplálkozási szokásait magunk mögött hagytuk az állandó szellemi tevékenység és a korlátozott testmozgás mellett. A mindennapi aktivitásunk növekedése miatt megnövekedett energiaigényünk van (főleg glükóz), miközben élettanunk továbbra is nagyrészt a vadászó-gyűjtögető homo sapiens őseinkre jellemző ünnepi és éhínséges energiafelvételhez igazodik. Ez a dilemma modern társadalmunk/viselkedésünk és ősi fiziológiánk között az elkövetkező évek során visszatérő problémát jelent majd a gerontológia számára. Remélhetőleg öregedési folyamatunk gyors fejlődésével nem kell megvárnunk, amíg fiziológiai evolúciónk felzárkózik életmódunkhoz.
Elismerés
Ezt a munkát az Országos Öregedési Intézeti Kutatási Intézet támogatta.
- A kalóriakorlátozás lassítja az öregedés jeleit az embereknél A Scientist Magazine®
- 4 szakaszos böjt diéta magyarázata
- 4 oka annak, hogy ne próbálja ki az időszakos böjtöt
- 4 ok, amiért időszakos böjtöt kell tennie
- 9 Az időszakos koplalás gyakori mellékhatásai és azokkal való bánásmód