Parietális sejt antitest
A parietális sejt antitestek specifikusan reagálnak a gyomor H +/K + ATPáz β alegységeivel [2, 3].
Kapcsolódó kifejezések:
- Szérum (vér)
- Gyomorhurut
- Atrófiás gyomorhurut
- Autoantitestek
- Monospecifikus antitest
- Autoimmun betegség
- Béta lánc
- Gyomor nyálkahártya
- Pylorus
- Gyomor parietális sejt
Letöltés PDF formátumban
Erről az oldalról
PARIETÁLIS SEJT ÉS INTRINSZIKUS TÉNYEZŐ SZERVEZETEK
BAN-HOCK TOH, FRANK ALDERUCCIO, in Autoantitestek (második kiadás), 2007
Meghatározás
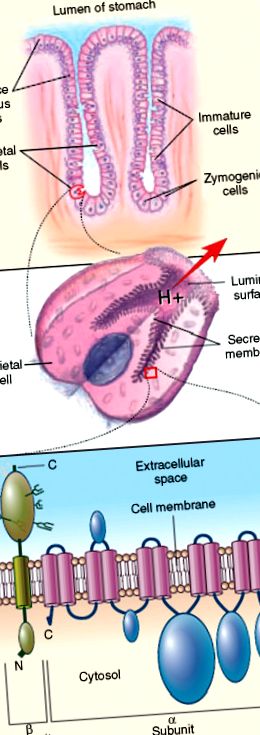
A parietális sejt antitestek specifikusan reagálnak a gyomor H +/K + ATPáz β alegységeivel [2, 3] (lásd a könyv végén a Color Plates részben a 60.1 ábrát). Az α alegységgel szembeni antitestreaktivitás tartalmaz egy epitópot a szekréciós membrán citoszolos oldalán. Az antitest reaktivitása a β alegységgel megköveteli az antigén diszulfidhoz kötését és glikozilezését, ami arra utal, hogy az autoepitópok a glikoprotein luminalis doménjében helyezkednek el. A β alegység N-glikánjai polilaktozamin szekvenciákat hordoznak, amelyek lehetővé teszik a gyomor H +/K + ATPázának tisztítását paradicsom lektin affinitáskromatográfiával.
60.1. ÁBRA . A gyomor parietális sejt H/K ATPáz mint molekuláris célpont a károsító vérszegénységgel társult autoimmun gastritisben. A felső panel egy gyomor mirigyet ábrázol, bemutatva a parietális sejtek elhelyezkedését a zymogén sejtekhez, az éretlen sejtekhez és a felszíni nyálkahártya sejtekhez viszonyítva. A középső panel stimulált gyomor parietális sejteket képvisel, bemutatva a szekréciós csatorna nyálkahártyáját, amelyen a gyomor H/K ATPázja található. Az alsó panel a gyomor H/K ATPáz katalitikus a és glikoprotein β alegységeit ábrázolja, bemutatva azok orientációját a parietális sejt szekréciós csatornájának burkolatában. N jelentése N-terminális rész, C pedig C-terminális rész.
Helicobacter pylori fertőzés és gyomor autoimmunitás
Fabiola Atzeni,. Piercarlo Sarzi-Puttini, Fertőzés és autoimmunitás (második kiadás), 2015
8.1 Parietális sejt antitestek
A PCA-k célantigénje a H +/K + ATPáz gyomorenzim, amely egy katalitikus 100 kDa α alegységből és egy 60–90 kDa β alegységből áll. Ez a gyomor parietális sejtjeinek szekréciós csatornáinak fő fehérje, és savat termel a H + ionok szekretálásával a K + ionokért cserébe. 15–18 PCA gyakori az autoimmun gastritisben, különösen a betegség korai szakaszában, és a gyomor H +/K + ATPáz α és β alegységeihez is kötődnek. Az α alegységgel szembeni antitestreaktivitás magában foglalja a szekréciós membrán citozolos oldalán lévő epitópokat, míg a β alegységgel szembeni antitestreaktivitás megköveteli, hogy az antigén diszulfidkötésben legyen és glikozilezett legyen, ami arra utal, hogy az autoepitópok a glikoprotein luminalis doménjében helyezkednek el. . A 17., 18. keringő PCA-k IgG, IgA és IgM izotípusok, bár a gyomornedvekben található antitest izotípusok főleg IgA és IgG. A betegség későbbi szakaszaiban a PCA-k előfordulása csökken az autoimmun gastritis progressziója és a gyomor parietális sejtek tömegének csökkenése miatt. A PCA-k azonban nem specifikusak, és ritkán fordulhatnak elő más autoimmun betegségekben, például Hashimoto thyreoiditisében vagy 1-es típusú cukorbetegségben szenvedő betegeknél. 1
Gasztritisz és hasi vérszegénység
Immunológiai diagnosztikai markerek
Két keringő autoantitest, a gyomor H +/K + ATP-ázára irányított parietális sejt-antitestek és az intrinsic faktorral szembeni autoantitestek jellemzően megtalálhatók autoimmun gastritisben vagy autoimmun gastritisben és károsító vérszegénységben szenvedő betegeknél.
39.4. ÁBRA A gyomor parietális sejtjeinek közvetett immunfluoreszcens festése egy egér gyomorban, amely reaktív az autoimmun gastritisben szenvedő beteg szérumával. × 400.
39.2. TÁBLÁZAT A gyomor autoantitestek gyakorisága az autoimmun klaszter betegségeiben a kontroll populációkhoz képest
| Betegségcsoport (tesztelt szám) | |||
| Tirotoxikózis (302) | 24. | 3.0 | Irvine (1965) |
| Hashimoto pajzsmirigy-gyulladása (120) | NT * | 5.0 | Irvine (1975) |
| Elsődleges hypothyreosis (297) | NT | 6.7 | Irvine (1975) |
| Inzulinfüggő diabetes mellitus | |||
| Idős Ungar et al. (1968) | |||
| Elsődleges Addison-kór (261) | 31.0 | 8.4 | Irvine és Barnes (1975) |
| Elsődleges petefészek-elégtelenség (5) | 40,0 | 40,0 | Irvine és mtsai. (1968) |
| Elsődleges hypoparathyreosis (68) | 22.0 | NT | Blizzard és mtsai. (1966) |
| Vitiligo (80) | 21.0 | NT | Brostoff és mtsai. (1969) |
| Lambert – Eaton szindróma (46) | 26.0 | 11.4 | Lennon és mtsai. (1982) |
| Kontroll (tesztelt szám) | |||
| B típusú krónikus atrófiás gyomorhurut (nem káros vérszegénység) (13) | |||
| 0 | 0 | Whittingham és mtsai. (1969) | |
| Nyombélfekély (200) | 5.0 | 0 | Ungar et al. (1976) |
| Ausztrál népesség (34 922) | 4.8 | 0 | Hooper és mtsai. (1972) |
| 21-30 éves (551) | 2.2 | NT | |
| 61-65 éves (317) | 6.3 | NT | |
| Ausztrál véradók (500) | NT | 0 | Ungar et al. (1968) |
| Skót véradók, 40-60 éves nők (141) | 9.0 | 0 | Irvine (1965) |
Autoantitestek, tesztek
Gyomor parietális sejtek
B12-vitaminhiány időseknél
Pernicious vérszegénység
Az emésztőrendszer bevonása a szisztémás autoimmun betegségekbe
3.1 Krónikus gyomorhurut
Noha a korábbi jelentések az SS-ben szenvedő betegek közel 80% -ában krónikus gyomorgyulladást és nyálkahártya atrófiát írtak le [27–29], a krónikus gyomorhurut prevalenciáját a legújabb vizsgálatok nem értékelték. A klinikai gyakorlatban a betegek gyakran panaszkodnak gyomorfájdalomra, bár a gasztroszkópos vizsgálatok gyakran csak enyhe gyomor-rendellenességeket mutatnak.
Néhány tanulmány elemezte az anti-parietális sejtes gyomor-antitestek (anti-PCA) prevalenciáját és klinikai jelentőségét primer SS-ben. Nardi és mtsai. [30] 335 betegből 90-ben (27%) talált pozitív anti-PCA antitesteket. Ezeknél a betegeknél a pajzsmirigy-gyulladás és az autoimmun májbetegség nagyobb volt, de a gyomor-bélrendszer nem érintett. El Miedany és mtsai. [31] anti-PCA antitesteket talált az SS betegek és a kontrollok egyharmadában. Mindazonáltal minden anti-PCA antitesttel rendelkező SS-beteg Helicobacter pylori fertőzésben szenvedett, összehasonlítva az autoantitest-pozitív kontrollok kevesebb mint felével. Hasonlóképpen, az autoantitest-pozitív kontrolloknak csak 22% -ában volt atrófiás változás a gyomor nyálkahártyájában, szemben az SS-vel rendelkezők 86% -ával. Ez a tanulmány szoros összefüggést talált az anti-PCA antitestek és a H. pylori fertőzés között, ami arra utal, hogy ez a baktérium helyi hiperreaktív/autoimmun választ indukálhat, amely megkönnyítheti az SS-betegek gyomornyálkahártyájával szembeni autoantitestek indukcióját.
Noha az anti-PCA antitestek krónikus atrófiás gyomorhuruthoz és károsító vérszegénységhez társultak, a két folyamatot csak ritkán írják le primer SS-ben szenvedő betegeknél. Két esetet írtak le a hematológiai megnyilvánulások legutóbbi áttekintésében 380 SS-betegből álló kohorszban [32], csak további négy esetről számoltak be [33–35], ami arra utal, hogy a krónikus atrófiás gyomorhurut és a károsító vérszegénység az elsődleges SS-ben nagyon ritkán fordul elő.
Tiabendazol
Máj
A tiabendazolt szedő betegeknél parenchymás májkárosodás léphet fel, és kóros májfunkciós teszteket dokumentáltak [10]. Az epevezeték károsodása mikronoduláris cirrhosishoz vezethet [11], és a máj rendellenességének különböző formáihoz, beleértve a ductopeniát is, amelyekhez májtranszplantációra lehet szükség [12, 13].
A tiabendazolt szedő betegeknél tartós kolesztázis léphet fel [14].
Egy 27 éves surinami béta-thalassémiában szenvedő beteg 2 napig 1250 mg tiabendazolt szedett strongyloidiasisban [15]. Egy héttel később icterikus lett, emelkedett teljes és konjugált bilirubin, lúgos foszfatáz, gamma-glutamiltranszferáz és aminotranszferázok emelkedett. Antinukleáris antitestek, parietális sejtek antitestek, simaizom antitestek, mitokondriális antitestek, hepatitis A, B, C, citomegalovírus, Epstein – Barr vírus, mumpsz és kanyaró tesztek negatívak voltak. Az ultrahangvizsgálat normál intrahepatikus és extrahepatikus epevezetékeket mutatott. A májbiopszián intrahepatikus kolesztázis és kissé megnövekedett infiltrátum mutatkozott a portál területein. Egy héttel később generalizált csalánkiütés alakult ki nála. A következő 7 évben enyhén rendellenes májtesztjei voltak, ekkor a májbiopszia enyhe nyirokinfiltrátumot mutatott a portál mezőkben, cirrhosis, krónikus hepatitis vagy primer biliaris cirrhosis jelei nélkül.
Egy 42 éves, szintén surinami nő, béta-thalassémiában és nem inzulinfüggő diabetes mellitusban szedte 2 napon át 1250 mg tiabendazolt strongyloidiasisban [13]. Öt héttel később általános rossz közérzet, étvágytalanság, fogyás, icterus és gyengéd máj alakult ki. Teljes és közvetlen bilirubint, gamma-glutamil-transzferázt és lúgos foszfatázt emelt, de csak minimálisan emelte a transzaminázokat. A hepatitis A, B és C, a citomegalovírus és a schistosomiasis tesztje negatív volt. Az antinukleáris antitestek és a májsejtek membránjaival, a simaizomokkal és a mitokondriumokkal szembeni antitestek tesztje negatív volt, de voltak parietális sejt antitestek. Az ultrahangvizsgálat és az ERCP normális intrahepatikus és extrahepatikus epevezetékeket mutatott. A májbiopszia súlyos központilag lokalizált kolesztázist mutatott. Egy évvel később minden klinikai és laboratóriumi eltérés eltűnt.
Tekintettel ezekre és a tiabendazol utáni súlyos kolesztázis korábbi eseteire és a kevésbé toxikus, ugyanolyan hatékony gyógyszerek (albendazol vagy előnyösen ivermektin) elérhetőségére, a tiabendazolt elavultnak kell tekinteni a strongyloidiasis kezelésében.
Vérszegénység, Pernicious
Az autoimmun gastritis állatmodelljei
Spontán előforduló autoimmun gastritis
Nincs olyan állatmodell, amelyben az elsődleges betegség az autoimmun gastritis, bár az autoimmun gastritis atípusos formái azoknak az állatoknak a részében vannak jelen, akiknek elsődleges autoimmun betegsége az autoimmun gastritishez társuló betegségek egyike. Például azoknak a BB/W patkányoknak, amelyek elsődleges betegsége az inzulinfüggő diabetes mellitus, gyomor parietális sejt antitestek és enyhe vagy közepesen súlyos gyomorhurut szövettani bizonyítékai lehetnek. A savszekréció azonban nem csökken vagy a B12-vitamin szintje nem csökken. Egy másik példa: Hashimoto pajzsmirigy-gyulladásának elhízott törzsű csirkemodellje is tartalmazhat gyomor parietális sejt antitesteket, de a csirke gyenge modellt nyújt az emberi gyomorhurut számára.
Kísérletileg kiváltott autoimmun gastritis
Azok a kísérletek, hogy autoimmun gastritis modelleket fejlesszenek ki rhesus majmokban, kutyákban és patkányokban úgy, hogy a gyomornyálkahártyát immunológiai adjuvánsokkal injektálják, csak részleges sikerrel jártak, és amikor gyulladásos gastritis indukálódik, az nem tart és halad, mint az emberi betegség. Az a modell, amely a legjobban tükrözi az emberi betegséget, az a modell, amely BALB/c egerekben alakul ki Freund teljes adjuvánsában emulgeált egér H +, K + -ATPáz négy injekcióját követően. Bár az elváltozás az immunizálás abbahagyása után visszafordítható, az immunizálásra adott válasz egy floridos gyomorhurut, a parietális és a fő sejtek elpusztításával és a GPCA kialakulásával. Alternatív modell a BALB/c egérben a gastritis, amely a BALB/c egér születésétől számított 2–4 napon belül végzett thymectomiát vagy thymectomiát követi, és a felnőtt egerekben egyetlen adag ciklofoszfamid. Két kritérium fontos e thymektomizált modellek kidolgozásában. Az egyik a timectomia időzítése az újszülöttnél, amelyet a születéstől számított 2–4 napon belül el kell végezni, a másik pedig a kombinált kezelés szükségessége a felnőttnél, mert sem a thymectomia önmagában, sem a ciklofoszfamid önmagában nem vezet gyomorhuruthoz.
A BALB/c modellekben a korai gyomor elváltozású sejtek elemzése azt mutatja, hogy a B sejtek, a CD4 T sejtek és a makrofágok vannak túlsúlyban. A lép-limfociták átvitele az érintett állatokból az immunhiányos egérgazdákba autoimmun gastritis-t eredményez a gazdaszervezetekben, az átvitelért felelős sejt a CD4 T-sejt, és a gyomor H +, K + -ATPáz.
Egy nő perifériás neuropátiában és gyakori esésekben
Tulio E. Bertorini, MD, Neuromuscular Esettanulmányok, 2008
Mit tennél a továbbiakban?
Noha a beteg normális B12-értéke a károsító vérszegénység (PA) diagnózisa ellen szólt, a magas MCV miatt a homocisztein és a metilmalonsav szintjét kellett mérni. A homocisztein 29,5 μM/L volt (normál, a parietális sejt antitest-titer 54 (normális),
Schilling tesztet hajtottunk végre, és az 1. stádiumú kobalamin kiválasztódása 0 volt (normális,> 10%). A 2. szakasz csak a beadott dózis 1% -ának kiválasztódását mutatta, ami azt is jelzi, hogy a B12 rendellenes bélfelszívódása hosszan tartó kobalaminhiányból származik, amelyet krónikus PA okoz. Ez több körülmények között is előfordulhat (46-1. Táblázat), míg mások félrevezető szinteket okozhatnak (46-2. Táblázat). Valószínűleg PA-ja volt, és azon betegek csoportjába tartozik, akiknek normál B12-szintje van a standard tesztekben. Beszámoltak arról, hogy a PA-betegek kb. 5-10% -ának szintje 200 és 300 között van, és kevesebb, mint 1% -uk szintje meghaladhatja a 300-at. 3
Merev személy szindróma és változatok
Vizsgálat
3. rovat tartalmazza az SPS és variánsainak lehetséges differenciáldiagnózisainak felsorolását, amelyek többségét alapos kórelőzmény és vizsgálat, vagy rutin laboratóriumi vagy radiológiai vizsgálatokkal lehet kizárni. Ha SPS gyanúja merül fel, a szérumot át kell szűrni anti-GAD antitestek (konkrétan anti-GAD65 antitestek), anti-GABARAP antitestek (ha vannak) és paraneoplasztikus antitestek (anti-Ri, anti-amfifizin, anti-gephyrin) és egyéb szövetspecifikus autoantitestek (pl. antigasztrikus parietális sejt antitestek, antithyroid mikroszómális antitestek). A szérum anti-GAD65 antitest-titerje jellemzően magas (> 20 nmol l -1). Az elektromiográfiának bizonyítania kell a CMUA bizonyítékát legalább egy axiális izomban (lásd 1.ábra ), normál motoregységi morfológiával (lásd 4. ábra ), amely intravénás benzodiazepinekkel és rendellenes exteroceptív reflexekkel oldódik meg (lásd 2. rovat ). A CSF a klasszikus SPS legfeljebb 60% -ában kóros (akár fehérje> 0,6 g l-1 és/vagy WBC> 5 és/vagy oligoklonális sávok (OCB-k) és/vagy CSF anti-GAD antitestek). A neuraxis mágneses rezonancia képalkotása normális az SPS-ben.
1.ábra . (a) Az ágyéki paraspinalis izom tűelektródájával rögzített nem javított EMG egy olyan SPS-ben szenvedő betegben, akinek nyugalmi állapotában folyamatos a motoros egység aktivitása (CMUA). A felvételeket akkor készítették, amikor a beteg hajlamos és mozdulatlanul feküdt egy vizsgálati kanapén. A nyíl azt az időpontot jelöli, amikor a hallási inger adott ki. Ne feledje, hogy a többegységes felvétel háttérégési gyakorisága növekszik a hallási inger nyomán, és továbbra is magas marad (az időalap 20 s per osztás, az amplitúdó pedig 2 mV osztásonként). b) Az a) pontban bemutatott felvétel, de kibővített időalapon jelenik meg (osztásonként 10 s).
4. ábra Ábra szerinti felvételből a Multimap ™ program segítségével generált átlagos motoros működési potenciál 1.ábra . Vegye figyelembe az átlagolt motoregységi potenciál normál időtartamát, amplitúdóját és alakját (Timebase 50 ms és amplitúdó 2 mV, vízszintes és függőleges sávokkal jelezve).
| Diagnosztikai jellemzők | Megjegyzések |
| CMUA | Legalább egy axiális izomban (lásd 1.ábra ) |
| Cutaneomuscularis (exteroceptív) reflexek | Széles körű, nem szoktató, alacsony küszöbű válaszok a sípcsont idegének stimulálására, az antagonisták egyidejű összehúzódásával |
| További jellemzők | |
| Nem megszokott akusztikus megdöbbentő reflex | Az axiális és a lábizmokból felvett EMG |
| Fokozott kérgi ingerelhetőség | A néma periódus 20% -kal csökkent a kontrollokhoz képest, megnövekedett ICF, valamint csökkent SICI és LICI |
| Görcsös reflex (propriospinalis) myoclonus | 1–3 szinkron myoclonicus EMG szekvencia törzsizmokban 60–70 ms medián idegstimuláció után |
| Pislog reflex | A villogási reflex R2 EMG komponense nem elnyomja az inger kondicionálását, míg a kontrollokban az R2 komponens legfeljebb 1 másodpercig elnyom. |
| Fejvisszahúzási reflex | A trigeminalis ideg stimulálása 12,5–20 ms és 44–70 ms választ eredményez a trapézben, ami nem szoktat |
Ha a paraneoplasztikus antitestek vagy a tumor markerek pozitívak (vagy fordítva, ha az autoantitestek, az anti-GAD65 és a paraneoplasztikus antitestek mind negatívak), a további vizsgálatoknak ki kell terjedniük a CT mellkasra, hasra és medencére, a mammográfiára és a PET-re, mivel a kapcsolódó rosszindulatú daganatok kezelése vagy stabilizálja, vagy megfordítja az SPS jellemzőit. PERM-ben a mögöttes rosszindulatú daganat kockázata ~ 20%, ezért minden beteget át kell szűrni, a szerológiától függetlenül.
- Skin Turgor - áttekintés a ScienceDirect témákról
- RNS Binding Protein FUS - áttekintés a ScienceDirect témákról
- Protein Sparing - áttekintés a ScienceDirect témákról
- Fehérje intolerancia - áttekintés a ScienceDirect témákról
- Formák (gombák) - áttekintés a ScienceDirect témákról