RNS-kötő fehérje FUS
Kapcsolódó kifejezések:
- Elmebaj
- Amiotróf laterális szklerózis
- Motor Neuron
- Ubiquitin
- DNS-kötő fehérje
- Autofágia
- Tau fehérje
- Frontotemporális demencia
- Fehérje
- Frontális variáció Frontotemporalis demencia
Letöltés PDF formátumban
Erről az oldalról
Neurogenetika, II. Rész
Jessica Deleon, Bruce L. Miller, a Klinikai Neurológia Kézikönyvében, 2018
A FUS gén a 16p11.2-n található, és a szarkómában fuzionált fehérjét kódolja, amely szerepet játszik a különféle sejtes folyamatokban, beleértve a sejtproliferációt (Bertrand és mtsai., 1999), a DNS helyreállítását (Baechtold és mtsai., 1999), a transzkripciót. szabályozás, RNS splicing (Yang et al., 1998) és RNS transzport (Zinszner et al., 1997). Szerepet játszhat az idegsejtek plaszticitásában és a dendritikus integritás fenntartásában is (Fujii és Takumi, 2005; Fujii és mtsai, 2005). A FUS mutációi a FUS fehérje újraeloszlását idézik elő a sejtmagból a citoplazmába, ahol neurotoxikus aggregátumokat képeznek (Neumann et al., 2009).
Jelenleg 23 kóros mutációt azonosítottak (Molgen: Cruts et al., 2012). Autoszomális-domináns módon öröklődik, hiányos behatolással. Megjegyzendő, hogy míg a FUS patológiával rendelkező ALS általában FUS mutációnak köszönhető, az alapul szolgáló FUS patológiával járó FTD esetek többsége szórványos (Neumann és mtsai, 2009; Rohrer és mtsai, 2010a; Urwin és mtsai, 2010; Snowden és mtsai. ., 2011). Az egyik központban a FUS mutációk a szórványos FTD esetek 3% -át tették ki (Seelaar et al., 2010).
A FUS-mutációkat kezdetben az ALS-ben azonosították (Kwiatkowski et al., 2009; Vance et al., 2009). 2009-ben Neumann és munkatársai egy meghatározott fenotípusú és patológiájú FTD-betegek csoportját írták le. A betegek korai életkoruk, gyakran 40 évnél fiatalabbak voltak, súlyos viselkedésbeli és személyiségbeli változásokkal, beleértve a személyes higiénia, a gátolt és antiszociális viselkedés, a nem megfelelő szexuális viselkedés, a hiperoralitás és a pszichózis változását. Ezekkel a viselkedési változásokkal nem jártak a nyelv vagy a motoros funkció észrevehető változásai (Neumann et al., 2009). A későbbi tanulmányok azt sugallják, hogy a sztereotip viselkedés (Snowden et al., 2011), a hallucinációk és a téveszmék szintén gyakoribbak lehetnek a FUS mutációkban (Urwin et al., 2010).
A képalkotás során a FUS patológiában szenvedő betegeknél megnövekedhet a caudatus atrófia a mögöttes TDP vagy tau patológiában szenvedőkhöz képest (Seelaar et al., 2010; Josephs et al., 2010). Megnövekedett hippocampalis szklerózisuk is lehet (Josephs et al., 2010; Seelaar et al., 2010).
A patológiáról egyedülálló, csavart vagy ívelt morfológiájú idegsejt- és gliazárványok vannak, amelyek ubiquitin-pozitívak, de TDP-43-negatívak voltak, és amelyeket azután FUS fehérjévé azonosítottak (Neumann et al., 2009; Urwin et al., 2010 ).
A frontotemporális demencia neurokémiai vonatkozásai
Oxidatív stressz a frontotemporális demenciában
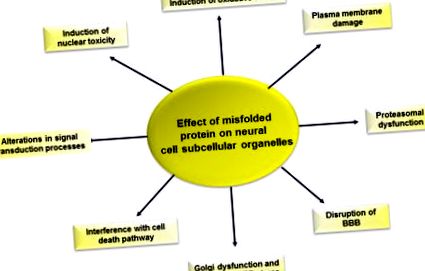
6.5. Ábra A fehérje rossz elterjedésének hatása az idegsejtek működésére.
6.6. Ábra A normális és rosszul összehajtott fehérjék metabolizmusa az idegsejtekben. A rosszul összehajtott fehérjéket chaperonok (Hsps) segítségével, vagy proteazomális lebontás útján, ubiquitin (Ub) hozzáadásával lehet újra összehajtani. A rosszul összehajtott fehérjék vagy fehérje-aggregátumok felhalmozódása ismeretlen mechanizmus révén idegsejt-pusztuláshoz vezet.
6.7. Ábra Hipotetikus diagram, amely bemutatja a frontotemporális dementia (FTD) patogenezisében szerepet játszó neurokémiai folyamatokat.
ARA, arachidonsav; cPLA2, citoszolos foszfolipáz A2; COX-2, ciklooxigenáz-2; Glu, glutamát; I-KB, az NF-KB gátló alegysége; IL-1β, interleukin-1β; IL-6, interleukin-6; 5-LOX, 5-lipoxigenáz; MCP-1, monocita kemoattraktáns protein-1; NF-KB, nukleáris faktor-KB; NF-κB-RE, nukleáris faktor-κB-válasz elem; NMDA-R, NMDA receptor; NO, nitrogén-oxid; ONOO -, peroxinitrit; PtdCho, foszfatidilkolin; ROS, reaktív oxigénfajok; TNF-α, tumor nekrózis faktor-α.
Állati modellek az emberi neurodegeneratív betegségek tanulmányozásához
5.1.3 FUS modellek
A FUS-t onkogén tulajdonságai miatt azonosították kromoszóma transzlokáció után, amely a csonka FUS fehérje fúzióját eredményezte a CHOP transzkripciós faktorral (Crozat et al., 1993; Rabbitts et al., 1993). A FUS gén a 16p11.2 ponton található, és 15 exont tartalmaz, amelyek egy multifunkcionális 526 aminosav fehérjét kódolnak (Prasad és mtsai., 1994), komplex doménszerkezettel. A FUS mindenhol expresszálódik minden sejtben. Egyes rágcsáló adatok arra utalnak, hogy a központi idegrendszeren kívüli expresszió az életkor előrehaladtával csökken, és 80 napos kortól hiányzik az egér vázizomzatából, májából és veséjéből (Huang et al., 2010). A FUS megköti a DNS-t és az RNS-t, és elsősorban nukleáris lokalizációt mutat be (Bosco és Landers, 2010; Gal és mtsai, 2011).
A FUS-ban bekövetkezett mutációkról leírták, hogy a FALS-esetek (FUS-ALS) hasonló arányában járulnak hozzá a TDP-43 mutációkhoz. A FUS működhet a TDP-43 downstream irányában és párhuzamosan más RNS-kötő fehérjékkel (Kabashi és mtsai, 2011). A FUS-ALS modellek kidolgozása elengedhetetlen annak tisztázásához, hogy a fehérje mutációi hogyan okozhatják az ALS-t, és hogy az aberrált RNS metabolizmus hogyan vezethet neurodegenerációhoz.
Négy transzgénikus rágcsáló vonal létezik, amelyek túl expresszálják a FUS-t: transzgénikus egerek, amelyek az egér prion promóterének irányítása alatt túlexpresszálják a HA-jelzésű humán vad típusú FUS-t (Mitchell et al., 2013); szomatikus agyi transzgénikus egerek, amelyek V5-jelölt humán vad típusú FUS-t, R521C mutánst és FUS-t expresszálnak, hiányzik a mag lokalizációs jele (D14) (Verbeeck et al., 2012); transzgén patkányok, amelyek feltételesen expresszálják az emberi vad típusú vagy mutáns FUS-t a TRE tetraciklin-válasz elem rendszer alatt (Huang et al., 2011); és transzgén patkányok, amelyek mutáns FUS-t expresszálnak a CaMKIIa promoter alatt TRE-vel (Huang et al., 2012). Ezek a modellek különböző fenotípusos megnyilvánulásokat mutatnak be, az izom denervációval, axonopátiával és a gerinc degenerációjával járó motoros érintettség különböző szintjeitől kezdve a memóriazavarral és a hippocampus neuronális halálával járó kognitív deficitekig.
Frontotemporális demencia
FUS-pozitív FTLD (FTLD-FUS)
A tau-negatív/TDP-43-negatív, ubiquitin-pozitív FTLD esetek többségében pozitív immunhisztokémiai festés mutatkozik a FUS fehérjével szemben, megkülönböztetve ezzel az FTLD neuropatológia harmadik kategóriáját. A FUS fehérje 526 aminosavat tartalmaz. Mint egy nukleáris fehérje, amely részt vesz a DNS helyreállításában és az RNS splicing szabályozásában. A FUS gén mutációi a 16. kromoszómán hangsúlyozzák annak patogenetikai szerepét az FTD és az ALS klinikopatológiai spektrumában. 55, 56 Klinikailag az FTLD-FUS esetek többségét a korai FTD (57 éves kor) jellemzi
Állatmodellek neurodegeneratív rendellenességek esetén
Hitomi Tsuiji, Koji Yamanaka, az állati biotechnológiában, 2014
FUS/TLS
Az öröklött ALS-esetek további öt százalékát a fúziós szarkómát (FUS, más néven liposzarkóma-fehérjében (TLS) transzlokált) kódoló gén domináns mutációi okozzák. A FUS szintén egy RNS- és DNS-kötő fehérje, amely két arginin/glicinben gazdag (RGG) doménből, egy Zn-ujj doménből, RRM-ből, glicinben gazdag régióból és Q/G/S/Y-ban gazdag régióból áll. A legtöbb betegséget okozó mutáció a C-terminális régióban helyezkedik el, nukleáris lokalizációs szignállal, de néhány mutáció a glicinben gazdag régióban található. A citoplazmában vagy a magban található FUS fehérje abnormális aggregátumai a gerincvelők érintett motoros neuronjaiban találhatók. A FUS szintén ingázik a sejtmag és a citoplazma között, és szabályozza a transzkripciót és az RNS splicingjét. Figyelembe véve a TDP-43 és FUS funkció és a fehérje doménszerkezete közötti hasonlóságot, az RNS metabolizmusának hibái lehetnek az egyik fő út, amely az ALS motoros neuronok neurodegenerációjához vezet (Da Cruz és Cleveland, 2011).
Amiotróf laterális szklerózis 1 és sok betegség
Amiotróf laterális szklerózis patológia
Az ALS legfontosabb kóros aláírása az agy, a hipoglosszális mag és a gerincvelő motoros neuronjainak elvesztése. Mikroszkóposan az ALS-t a fehérje aggregáció és a motoros idegsejtekben való lerakódás jellemzi (Al-Chalabi et al., 2012; Blokhuis, Groen, Koppers, van den Berg és Pasterkamp, 2013). A motoros idegsejtekben ubiquitin-pozitív és negatív zárványok láthatók. Az ubiquitin-pozitív aggregátumokat Lewy-féle testszerű hialin- vagy gombolyag-zárványok közé sorolták, és gyakran közel vannak az axon dombvidékén belüli neurofilamentális felhalmozódásokhoz (Al-Chalabi et al., 2012; Blokhuis et al., 2013; Mackenzie et al., 2007). Az SOD1 és a Fused in Sarcoma/Translated in Liposarcoma Protein (FUS) esetek kivételével ezek a zárványok TDP-43-pozitívak, egy lehetséges közös downstream folyamat. Érdekesség, hogy az SOD1 és FUS által közvetített ALS SOD1 vagy FUS fehérje felhalmozódást mutat, nem pedig a motoros neuronok TDP-43 zárványait. Az ALS-hez kapcsolódó egyéb kóros aggregátumok, beleértve a szórványos eseteket is, tartalmazhatnak fehérjéket vagy termékeket, amelyek olyan génekből származnak, amelyekről mutációkat találtak az ALS-ben, például FUS, OPTN, UBQLN2 és C9orf72. Hogyan és miért származnak ezek az aggregátumok, aktív vizsgálat tárgyát képezi.
Általánosságban elmondható, hogy az ALS intracelluláris fehérje-aggregációja úgy tűnik, hogy a megbetegedett motoros neuronban a három állapot közül legalább az egyik jelenlétéből fakad, és valószínűleg mindhárom kölcsönhatása: (1) fokozott hajlandóság a fehérjék aggregálódására, (2) a fehérje lebontási útvonalainak csökkenése és (3) megnövekedett sejtstressz. A fehérjeszint strukturális változásai, például a fehérje hibás hajtogatása, különösen az alacsony komplexitású doménekben (amelyeket néhol „prionszerű doméneknek” neveznek), úgy tűnik, megkönnyítik az aggregációt (Udan-Johns et al., 2014). A normális fehérje lebontási útvonalak károsodása aggregált fehérjék felhalmozódásához vezethet (Alami és mtsai, 2014; Bosco, Lemay és mtsai, 2010). A fehérjék aggregációja sejtstresszhez és gyulladásos utak aktiválódásához vezethet az idegsejtben és a környező sejtekben, ami meggyorsíthatja a fehérje aggregációt (Robberecht & Philips, 2013).
Az ubiquitin-negatív zárványok, az LMN-k citoplazmájában található Bunina-testek szintén jellemzőek az ALS-re. Kicsi és kerek cisztatin C – pozitív eozinofil zárványok, amelyek amorf elektron-sűrű anyagot tartalmaznak, és az elektronmikroszkóppal vizualizált tubuláris és vezikuláris szerkezetekhez kapcsolódnak (Okamoto, Mizuno és Fujita, 2008). Míg pontos természetük és jelentőségük továbbra sem tisztázott, feltételezzük, hogy származhatnak sejtes organellumokból, például az endoplazmatikus retikulumból, vagy kóros fehérje-anyagcseréből származhatnak.
Intracelluláris aggregátumokat figyeltek meg extramotoros régiókban is, mint például a frontális és temporális kéreg, a hippocampus és a cerebellum. Mind a fALS-ban, mind az sALS-ban, mind más neurodegeneratív betegségekben, például a frontotemporális lebeny degenerációban (FTLD) vannak jelen. Ez arra utal, hogy a fehérje aggregáció összekapcsolhatja a fALS-t és az sALS-t, valamint általában a neurodegeneratív betegségeket. Hogy a fehérje-aggregátumok jelenléte önmagában a kulcsfontosságú káros esemény-e, továbbra is vita tárgyát képezi (Brotherton, Li és Glass, 2013), bár a felhalmozódások egyértelműen a normális sejtes folyamatok rendellenességeit tükrözik. Bizonyos bizonyítékok arra utalnak, hogy ezek a fehérjeaggregációk szükségesek, de nem elegendők a neurodegeneratív betegségek kiváltásához, és hogy az elkülönített fehérjék következtében bekövetkező fehérje funkcióvesztés vagy az idegsejtben és a környező gliaban kiváltott gyulladás a hibás a degeneratív folyamatban (Robberecht & Philips 2013).
Demencia és szisztémás betegség
Frontotemporális demencia
A frontotemporális demencia klinikailag, kórosan és genetikailag sokféle rendellenesség. A neuropatológiai vizsgálat során sok esetben a tau-t, egy mikrotubulus stabilizáló fehérjét tartalmazó zárványok társulnak. A neuropatológia más, hasonló klinikai fenotípusú esetekben olyan zárványokat mutat be, amelyek 43 kDa (TDP-43) TAR DNS-kötő fehérjét tartalmaznak, és nincs tau festés; mások tau negatív és TDP-43 negatívak, de pozitívak a szarkómában fuzionált fehérjére; és mások mások tau negatív, TDP-43 negatívak, szarkóma negatív fuzionáltak és ubiquitin pozitívak. 31 A klinikai és a kóros altípusok átfedése miatt a jelenlegi diagnosztikai technikák alkalmazásával nehéz biztosan megjósolni az egyes betegek patológiáját, de általában a tau zárványokkal járó klinikai szindrómák a viselkedési variáns frontotemporális demencia, a progresszív nonfluent afázia, a progresszív supranukleáris bénulás, és corticobasalis szindróma. A szemantikus demencia, a frontotemporális demencia változata, progresszív károsodással a névadásban és az egyszavas megértésben, általában társul a TDP-43 patológiájához. Sok TDP-43 pozitív esetben komorbid motoros idegsejt betegség van. Nincsenek specifikus kezelések.
A megjelenés átlagos életkora 50 és 60 év között van; az előfordulás nem növekszik az életkor előrehaladtával. 31 A frontotemporális demencia a demencia esetek jelentős hányadát teszi ki a 45-65 éves embereknél. A tünetek megjelenése és a halál közötti idő valamivel rövidebb, mint az Alzheimer-kóré. 32 A viselkedési változat személyiségváltozással, apátiával vagy impulzivitással, érzelmi tompulással, empátia és társadalmi tudatosság elvesztésével, az átlátás hiányával, a mentális merevséggel, az étkezési szokások megváltoztatásával és a nem megfelelő személyes higiéniával rendelkezik, amelyek mindenekelőtt a nem domináns frontális degenerációt tükrözik. és időbeli lebeny (61-1. ábra). 33 Amikor a kóros folyamat a domináns féltekét érinti, a progresszív, nem folyékony afázia a tipikus fenotípus, és kevesebb viselkedési változással és szembetűnőbb nyelvi nehézségekkel jár. 31
61-1. Ábra. Frontotemporális demencia. Az agy T1-súlyozott mágneses rezonancia képe (MRI) a nem domináns (jobb) frontális lebeny atrófiáját mutatja más területekhez viszonyítva.
Amiotróf laterális szklerózis és a demencia
Paul H. Gordon, PhD. Philippe Corcia, Ph.D., étrend és táplálkozás a demenciában és a kognitív hanyatlásban, 2015
Alkalmazások más demenciákra
Különböző típusú demenciák fordulhatnak elő ALS-ben, de a kapcsolat a legerősebb a frontotemporális lebeny degenerációval (FTLD); a betegségek klinikailag, kórosan és genetikailag átfedik egymást (FTD-ALS) [36]. Az FTLD-t klinikailag a végrehajtó funkció, a nyelv és a viselkedés progresszív változásai jellemzik; az idegképalkotás a frontális és az elülső temporális lebeny hipometabolizmusát és atrófiáját mutatja. A többi neurodegeneratív rendellenességhez hasonlóan az FTLD-nek is van fehérje zárványa (tau, TAR DNS-kötő fehérje-43 és szarkómafehérjében fuzionált) az érintett idegsejtekben. ALS-ben az inklúziók a motoros idegsejtekben fordulnak elő, míg az ALS-FTD-ben a zárványok a frontális és temporális lebeny egészében terjednek a sejtekbe. Úgy tűnik, hogy az FTLD és az FTD-ALS viselkedési alcsoportjai fiatalabbak, mint más demenciák.
Az FTLD-betegek legfeljebb 15% -a és az ALS-betegek 30% -a tapasztalja az átfedés szindrómát [57]. A mindkét rendellenességben szenvedő betegek túlélési ideje rövidebb. Az fALS-FTD egy GGGGCC hexanukleotid ismétléshez kapcsolódik a 9p21 kromoszómán található C90RF72 gén nem kódoló régiójában [37]. Ez a mutáció a sporadikus ALS-FTD ritka eseteit is magyarázza.
A légzési elégtelenség, a hipoxémia és a hiperkapnia szintén okozhat változásokat a memóriában; a nem invazív szellőzés a tünetek javulásához vezethet. Hasonlóképpen a depresszió, a fáradtság és a gyógyszerek mellékhatásai is befolyásolhatják a megismerést.
Az ALS és más neurodegeneratív betegségek, köztük Alzheimer, Huntington és Parkinson, fehérje aggregációt mutatnak az agyban. Klinikailag és kórosan úgy tűnik, hogy a neurodegeneratív rendellenességek fokálisan kezdődnek [58]. A tünetek előrehaladnak, amikor a patológia összefüggő idegsejtekre terjed. Úgy tűnik, hogy egyes fehérjék prionszerű doménekkel rendelkeznek, hajlamosak az önaggregációra [59]. A rosszul összehajtott fehérje átvihető sejtről sejtre, mivel a kóros fehérjék a szomszédos vad típusú fehérjéket indukálják kóros konformáció felvállalására. Ez vonatkozik a FUS-ra és a TDP-43-ra, amelyek kóros széthajtásra hajlamos priontartományt hordoznak. Kísérleti bizonyítékok vannak a prionszerű szaporításra az SOD1 esetében is. A fehérje aggregátumok más patofiziológiai folyamatokat is elősegíthetnek, mint például a mitokondriális diszfunkció és az energia kimerülése, a glutamát excitoxicitása és a gyulladásos mediátorok indukciója. A rosszul összehajtott fehérje-aggregátumok molekuláris célpontot szolgáltathatnak az összes neurodegeneratív betegségre kiható beavatkozásokhoz; a terápiás áttörés az ember számára valószínűleg gyorsan más rendellenességekké alakul át.
A neurodegeneratív rendellenességek biopsziás patológiája felnőtteknél
Hisztopatológia
Az elmúlt évtized számos új felfedezése a genetikában és a proteinopátiában megerősítette az FTLD heterogenitását és körvonalazta patológiás változatait a sejtekben felhalmozódott fehérjék típusa alapján, amint azt az IHC kimutatta. 50,51 Jelenleg az FTLD az ubiquitin (lásd a 27.11E és F ábrát) vagy a p62, a foszforilezett tau, a TDP-43 és a fúziós szarkóma (FUS) fehérjék és a p62, az IHC alapján két fő és három kisebb csoportba sorolható. az alábbiakban foglaljuk össze. Ezek közül az (1) és (2) csoport együttesen az FTLD esetek akár 90% -át is kiteszi, mindegyikük hasonló gyakorisággal fordul elő. A legtöbb esetben (FTLD-U) a különböző agyterületek idegsejtjeiben különböző alakú ubiquitinált citoplazmatikus és nukleáris zárványok találhatók, amelyek nem különböztethetők meg a sporadikus ALS-ben található gombolyagszerű zárványoktól. Meg kell jegyezni, hogy az LFB/H & E és ezüstfoltok képesek azonosítani és osztályozni a legtöbb FTLD-tau esetet az IHC segítsége nélkül, és hogy az IHC pontos értelmezése tapasztalatot igényel.
FTLD-tau tau (+), TDP-43 (-) és FUS (-) zárványokkal: PSP, CBD, Pick-kór, FTDP-17 (MAPT), AGD, PART és ritka entitások
FTLD-TDP TDP-43 (+), tau (-) és FUS (-) zárványokkal: néhány C9 + FTLD-ALS, FTDP-17 (GRN), ritka esetekben TARDBP (TDP-43 kódoló gén) vagy VCP mutációk
FTLD-FUS FUS (+), tau (-) és TDP-43 (-) zárványokkal: atípusos FTLD-U (aFTLD-U), neuronális köztes filamentumos betegség (NIFID) és bazofil zárványtest betegség (BIBD); A FUS mutációkat nem mindig azonosítják
FTLD-UPS (ubiquitin-proteasome rendszer) ubiquitin (+), p62 (+), tau (-), TDP-43 (-) és FUS (-) zárványokkal: mutációk a CHMP2B-ben és néhány C9 + FTD-ALS-ban
FTLD-ni (nincs kimutatható immunreaktivitás ubiquitin, p62, tau, TDP-43 vagy FUS esetében)
- Skin Turgor - áttekintés a ScienceDirect témákról
- Parietális sejt antitest - áttekintés a ScienceDirect témákról
- Protein Sparing - áttekintés a ScienceDirect témákról
- Fehérje intolerancia - áttekintés a ScienceDirect témákról
- Formák (gombák) - áttekintés a ScienceDirect témákról