Szérum és vizelet elektroforézis a monoklonális fehérjék kimutatására és azonosítására
Absztrakt
Az elektroforézist úgy definiálhatjuk, mint a töltött részecskék elválasztását egy egységes elektromos mezőben. Egy adott elektroforézis rendszer esetében a feszültséget állandó értéken tartják, valamint a szuszpendáló közeg pH-ját és ionerősségét.
Tiselius egy mozgó határfolyadék-rendszert használva 1937-ben elektroforézissel szétválasztotta a szérumfehérjéket négy komponensre. 1 Az 1950-es években népszerű papírelektroforézis biztosította az első szilárd elektroforézist. A papír, mint hordozó közeg törékenysége egy évtizeddel később a robusztusabb cellulóz-acetát bevezetését jelentette. Ezt követően javult a felbontás agaróz gél alkalmazásával, amely a szérum mintákban 5 sávot választott el. 2, 3 Az 1980-as évek végén nagy felbontású agarózgéleket vezettek be, amelyek legalább 6 sávot produkáltak, és a rendszertől függően akár 17 sávot a szérumban. 4, 5
A teljesen automatizált szérum elektroforézis az 1990-es években kezdődött a kapilláris elektroforézis (CE) bevezetésével, amely egy folyékony közeg újbóli bevezetése, de a Tiselius eljárásához képest kiváló felbontással. A CE készülékek segítségével programozható a minták sorozata, és egy éjszakán át hagyjuk őket feldolgozásra.
A gélelektroforézis félautomatizálásának oka valószínűleg a laboratóriumok összevonása növekvő számú betegmintával. A Helena SPIFE és Sebia Hydrasys gélrendszerek bevezetése naponta több mint száz szérumminta elektroforálásának lehetőségét biztosította. Az ilyen műszereknek minden bizonnyal szerepe van az elektroforézis laboratóriumokban.
Miért végezzük az elektroforézist
A szérumfehérje-elektroforézis végrehajtásának elsődleges oka a paraprotein vagy a B-sejt diszkrázia felfedezése. A gamma régió szabálytalansága oka lehet egy kis monoklonális sáv, szabad könnyű láncok vagy oligoklonális IgG. További klinikai jelentőségű megállapítások közé tartozik az akut fázisválaszra utaló megnövekedett alfa-1 és alfa-2 globulin, az alfa-1 antitripszin (A1AT) hiányára utaló alfa-1 globulin csökkenése (amelyet fenotipizálással lehet követni a klinikailag szignifikáns A1AT-variáns), a béta-1 régió növekedése, amely a megnövekedett transzferrin- és vashiányra, a gamma-globulinok poliklonális növekedésére utal, ami ammentációra vagy fertőzésre vagy májbetegségre utal.
A vizeletfehérje-elektroforézis elvégzésének fő oka az, hogy megtalálja a könnyűlánc-myeloma feleslegét termelő szabad könnyű láncokat (Bence Jones fehérje), amely a myeloma-képernyő fontos része. A vizeletfehérje-elektroferogram sávja ép monoklonális immunglobulinból is származhat, különösen akkor, ha a betegnek rossz a veseműködése. Az immunfixálás fontos a sáv természetének meghatározásában, valamint a Bence Jones fehérje és a szérumból származó intakt monoklonális fehérje megkülönböztetésében. A vizelet elektroferogramjából azt is megtudhatjuk, hogy a proteinuria glomeruláris eredetű-e és túlsúlyban van-e az albuminnal, vagy van-e tubuláris összetevője kisebb molekulatömegű fehérjék, például retinol-kötő fehérje és alfa-1 mikroglobulin kiválasztásával. A vizeletben töredezett albumin néha látható, de ismeretlen jelentőségű. 6.
Történelmileg a vizeletet vagy a víz eltávolításával a mintából a fehérjék nagyobb koncentrációban történő elhagyásával, vagy centrifugálással végzik, amelynek során a fehérjék elpörögnek a víz nagy részétől. A vizelet fehérjekomponenseinek koncentrált mintákból történő bemutatását eredetileg cellulóz-acetáton, később agarózon és nagy felbontású agaróz gélen végezték. A CE vizeletanalízishez való alkalmazását mind a mai napig nem érték el olyan műszergyártók, mint Beckman vagy Sebia, bár Sebia olyan módszert hirdetett, amely magában foglalja a dialízist, majd centrifugálási lépést. Közzétettek egy alternatív vizeletfehérje-módszert CE alkalmazásával. 7
Elektroforetikus technikák nagyobb részletességgel
Nagyfelbontású agaróz gélelektroforézist, akár kereskedelmi, akár házon belül, több mint 20 éve használnak rutinszerűen, szérummal 6 és 17 sáv közötti elválasztást biztosítanak. Kimutatták, hogy a technika a monoklonális sávok reprodukálható mennyiségi meghatározását teszi lehetővé, feltéve, hogy a puffer pH-értékét, feszültségét és a folt típusát gondosan reprodukálják. A nagy felbontású gélek immunfixálását sikeresen alkalmazták alacsony szintű monoklonális IgA és IgM paraproteinek bemutatására. Nagy felbontású agaróz gélelektroforézis és immunblotolás is alkalmazható a transzferrin különféle izoformáinak, például az asialotranszferrin vagy a béta-2-transzferrin elválasztására. Ez fontos az ilyen fehérjék kimutatásában a CSF-ben és más szivárgó folyadékmintákban.
A szérumfehérjék CE általi elválasztását először az 1990-es évek elején mutatták be. A CE olyan technika, amely kiváló szétválasztást biztosít a szérumfehérjék között, miközben csökkenti az automatizálás által igényelt gyakorlati időt.
CE esetén az alkalmazott puffer pH-jának állandónak kell lennie egy adott rendszer számára, függetlenül attól, hogy kulcsrakész kereskedelmi vagy kutatási eszközt használnak. Az alkalmazott 8 és 17 kV közötti CE feszültség sokkal nagyobb, mint az agaróz gélekkel alkalmazott 250–400 V feszültség (1. táblázat). A hullámhosszak használata a távoli UV-ben a peptidkötésekkel történő fényelnyelés detektálására elkerüli a fehérjék variálását a hagyományos detektálási technikákkal (1. táblázat). Ebben a tekintetben bebizonyosodott, hogy a detektálás érzékenysége 200 nm-en háromszorosa a 215 nm-en mért érzékenységnek.
Asztal 1
Az elektroforézis módszer körülményeinek összehasonlítása.
| Feszültség | 250 V | 240 V | 8-18 kV |
| Puffer | Barbital | Tris Barbital | Bórsav |
| pH puffer | 8.6 | 8.5 | 9.9–10.3 |
| Érzékelés | Látható folt | Látható folt | UV abszorbancia |
Az elektro-ozmotikus áramlás nagyon fontos jelenség a CE-ben. Ha a puffer pH értéke meghaladja a 2 értéket, az egyesített szilícium-dioxid-kapilláris belső felülete negatív töltésű a kitett szilanol-ionok miatt. Elektromos térben a szilícium-dioxid-fal mellett elhelyezkedő diffúz kétrétegű hidratált kationok a katód felé vándorolnak, magukkal vonszolva az oldószert. Ezt elektro-ozmotikus áramlásnak nevezik. A fehérjék vándorlási sorrendje a detektor mellett tükrözi a kapillárison belüli elektroforetikus és elektro-ozmotikus erők egyensúlyát. A puffer pH-jának beállításával az elektro-ozmotikus áramlás elvileg vagy fokozhatja, vagy ellenezheti az elektroforetikus migrációt. A szérumfehérjék elemzésében az alkalmazott pH-érték markánsan lúgos (1. táblázat), az anódos elektroforetikus migrációt a katódos elektro-endoszmózis uralja.
Az immunszubsztrakciót, amelyet eredetileg Aguzzi és Poggi, 8 javasolt, a CE-ben az agaróz géleken végzett immunfixáláshoz hasonló módon alkalmazzák - ez lehetővé teszi a szérumban található paraprotein azonosítását immunglobulin-specifikus antitestek alkalmazásával. Ha az antitesteket szilárd hordozókhoz, például gyöngyökhöz kötjük, az antitesthez kötődő bármely komponens a hordozóhoz kapcsolódik és eltávolításra kerül az oldatból. Ha a CE-ben látható paraprotein például IgG (kappa), akkor a paraprotein kötése (és eltávolítása) IgG és kappa antitestekkel a sáv csökkenését okozza, míg az IgA, IgM és lambda komponensekkel szembeni antitestek nem mutatnak ilyen hatást.
Az elektroforézishez használt egyéb technikák
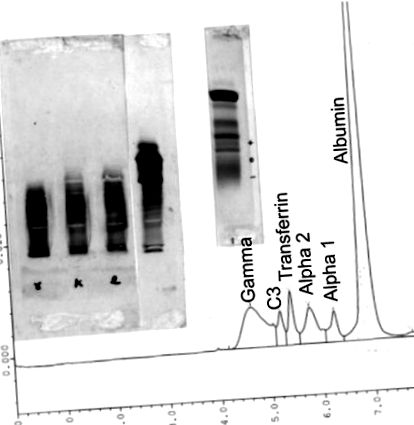
Számos technika létezik, amelyek a szérum és a vizelet elektroforézissel együtt alkalmazhatók a páciensben előforduló plazma sejt diszkrázia méretének és azonosságának meghatározásához. Ezek a technikák magukban foglalják a páciens szérumának és vizeletének izoelektromos fókuszálását, 9 immunfixálást, vagy szérumfehérje-elektroforézist a különösen alacsony szintű IgA és IgM sávok azonosítására, vagy izoelektromos fókuszálást, hogy megkülönböztessenek egy monoklonális fehérjét, egy kiemelkedő IgG-t (kappa) vagy IgG-t. (lambda) klón, oligoklonális IgG vagy szabad könnyű láncok. Az izoelektromos fókuszálás immunfixálásának felbontása körülbelül ötször jobb, mint az elektroforézis immunfixálásának felbontása. Az FN Cornell ebben a lapszámban egy tanulmány is olvasható ezekről a kiegészítő technikákról. A kapilláris elektroforézis, a nagy felbontású elektroforézis és az izoelektromos fókuszálás technikáinak összehasonlítását az 1-4. .
(Jobbról balra) kapilláris elektroforézis technikái, amido feketével festett nagy felbontású agaróz gél elektroforézis és coomassie kékkel festett normál szérum izoelektromos fókuszálása anti-humán IgG-vel, anti-humán kappa könnyű lánccal és anti-humán lambda-val történő immunfixálás után könnyű lánc antiszérum és savrögzítés.
A kapilláris elektroforézis technikái, az amido feketével festett nagy felbontású agaróz gél elektroforézis és a szérum izoelektromos fókuszálása szabad kappa könnyű láncokkal, amelyeket coomassie kékkel festettek anti-humán IgG, anti-humán kappa könnyű lánc és anti-humán lambda fény után. lánc antiszérum és savrögzítés.
A paraprotein mennyiségét a beteg szérumában kvantifikálni kell az elektroferogramról, ha CE-módszert alkalmaznak, vagy densitometriás analízissel, ha gélelektroforézist alkalmaznak. Kissé önkényesen a mielómát úgy diagnosztizálják, hogy 20 g/l-nél nagyobb monoklonális IgG-t vagy 10 g/l-t meghaladó monoklonális IgA-t találnak. Az alacsonyabb koncentrációjú monoklonális sávokkal rendelkező betegek MGUS-nak (meghatározatlan jelentőségű monoklonális gammopathia) sorolhatók. A monoklonális IgM általában Waldenström macroglobulinaemiáját jelzi, és csak ritka esetekben jelzi a mielómát.
Az immunglobulinok IgG, IgA vagy IgM mennyiségi meghatározása akár immunonephelometriai, akár immunoturbidometriai módszerekkel megmutatja, hogy a beteg maradék gamma-globulinjai csökkentek-e, vagy a referencia intervallumon belül vannak-e. 10 Ha monoklonális fehérje szaporodik, akkor a maradék gamma-globulinok csökkenése jelentős.
Az elmúlt három évben a szabad kappa és a szabad lambda könnyű láncok mennyiségi meghatározása a The Binding Site (Birmingham, Egyesült Királyság) Free Lite ™ kit segítségével a szérum könnyű láncainak kimutatását az mg/L tartományba vezette. Ennek eredményeként a szabad kappa és a szabad lambda arányának meghatározott referencia intervalluma van. Az ezen időintervallumon kívüli eredmények szerint a páciens keringésében megnövekedett mennyiségű szabad könnyű lánc található, és további hematológiai vizsgálatokra lehet szükség. A könnyű láncok mennyiségi meghatározása a mielómával gyanús páciens fehérje-feldolgozásának része, és ideális esetben a beteg szérum- és vizeletfehérje-elektroforézisének eredményeivel együtt jelentik.
A szalagok megnövekedett bonyolultsága mielómás betegeknél
Miután évekig laboratóriumban dolgoztam, megfigyeltem, hogy a betegek szérumában egyre bonyolultabbak a monoklonális sávok. Tíz évvel ezelőtt általában csak egy monoklonális sávot találtunk, míg a közelmúltban egyre több olyan beteget találtunk, akiknek két, különféle nehéz láncú, vagy három vagy négy monoklonális sávú, gyakran eltérő nehéz és könnyű lánc típusú monoklonális sávja volt. Azt, hogy ez a megállapítás környezeti tényezőkből, genetikai tényezőkből vagy jobb detektálásból ered-e, még meg kell határozni. Laboratóriumi szempontból ezt szem előtt kell tartani, amikor a beteg mielóma szempontjából szérumát vizsgálják.
Következtetés
A szérum- és vizeletfehérje-elektroforézis során alkalmazott technikák mind az észlelés, mind a felbontás terén jelentősen javultak az elmúlt 70 évben. Az izoelektromos fókuszálás, az immunfixálás és az immunglobulinok mennyiségi meghatározásának bonyolultabb technikái fontosak a myelomával gyanús betegek kezelésében. A szérummentes könnyű láncok vizsgálata további eszközt nyújt, amely segítheti a laboratóriumot ebben a folyamatban.
A kapilláris elektroforézis technikái, az amido feketével festett nagy felbontású agaróz gél elektroforézis és a szérum izoelektromos fókuszálása coomassie kékkel festett IgG (lambda) paraproteinnel antiimmun fixálás után anti-humán IgG-vel, anti-humán kappa könnyű lánccal és anti-humán lambda-val. könnyű lánc antiszérum és savrögzítés.
A kapilláris elektroforézis technikái, amido feketével festett nagy felbontású agaróz gél elektroforézis és a szérum izoelektromos fókuszálása oligoklonális IgG-vel, amelyet coomassie kékkel festettek anti-humán IgG, anti-humán kappa könnyű lánc és anti-humán lambda könnyű lánc antiszérumok után. és savrögzítés.
Lábjegyzetek
Versenyző érdekek: Egyik sem nyilatkozott.
- A szérum adiponektin és a leptin koncentrációk kapcsolata a testzsír-eloszlással emberben -
- Tekintse át a Vichy LiftActiv Peptide-C ampulla szérum BTY ALY terméket
- A barátnőm azt akarja, hogy vizeljek
- Edzés utáni étkezés fogyáshoz A legjobb fehérjék, szénhidrátok, amelyeket edzés után fogyaszthatunk az optimális testsúly érdekében
- SLIM EXTREME 4D DIAMOND Vékonyító szérum anticellulit