Táplálkozás rákos betegeknél
Paula Ravasco
1 Santa Maria Egyetemi Kórház, 1649-035 Lisszabon, Portugália; [email protected]
2 Lisszaboni Egyetem, 1649-028 Lisszabon, Portugália
3 A Portugál Katolikus Egyetem Interdiszciplináris Egészségügyi Kutatási Központja (CIIS), 1649-023 Lisszabon, Portugália
Absztrakt
1. Bemutatkozás
Ezen keretrendszer alapján a PubMed és a Cochrane Könyvtárban a kezdetektől március 26-ig irodalomkutatást végeztek. A keresés a következőkből állt: rák, táplálkozás, táplálkozási terápia, alultápláltság, cachexia, szarkopénia, túlélés, tápanyagok, irányelvek. A kulcsszavakat az „OR” mint logikai függvény segítségével kapcsoltuk össze, és a négy komponens eredményeit az „AND” logikai függvény felhasználásával kombináltuk. Kiválasztották az angol nyelven írt irányelveket, klinikai vizsgálatokat és megfigyelési tanulmányokat. A cikk alapvető hivatkozásaira, még akkor is, ha a keresési idővonalon kívül kerültek keltezésre, ebben a cikkben szükség szerint hivatkoztak.
2. Eredmények
2.1. Táplálkozási szűrés és értékelés
A táplálkozási kockázat mielőbbi szűrése lehetővé teszi az alultápláltság veszélyének kitett betegek azonosítását [25]. A szűrést a lehető leghamarabb el kell végezni, és a legújabb szakirodalom azt sugallja, hogy a diagnózis felállításakor vagy a kórházi felvételkor kell elvégezni; a szűrést meg kell ismételni a kezelés során, hogy szükség esetén értékelést kapjunk [19,21,23,25,26,27]. A bizonyítékok alátámasztják az alultápláltsági szűrés integrálását a rákos betegek ellátásában. Az alultápláltság szűrésének megfelelő eszköznek rövidnek és könnyen kitölthetőnek, olcsónak, rendkívül érzékenynek és jó specifikumúnak kell lennie [25]. A MUST (alultápláltsági általános szűrővizsgálati eszköz) és az NRS-2002 (táplálkozási kockázat-szűrés-2002) megfelelőnek tekinthetők [28,29,30]; az MNA (Mini Nutritional Assessment) alkalmas eszköz a táplálkozás értékelésére az idősebb lakosság körében [19,23].
Táplálkozási kockázat fennállása esetén a szűrést átfogó táplálkozási értékelésnek kell követnie a táplálkozási beavatkozás menetének jobb meghatározása érdekében. Úgy tűnik, nincs egyetértés a legjobb módszer elvégzésére az értékelés elvégzéséhez, de az SGA (Subjective Global Assessment) és a PG-SGA (Patient Generated-Subjective Global Assessment) validálva lett a felnőtt onkológiai betegek táplálkozási értékeléséhez [25,26,31 ].
Elszigetelten alkalmazva a fogyás hatástalan az alultápláltság kimutatására, mivel alacsony az érzékenysége a rákos betegeknél előforduló anyagcsere-változásokra. Ennek korai és rendszeres értékelése, a táplálékbevitel, a BMI és a gyulladásos állapot értékelésével együtt azonban szokásos klinikai ajánlás [19,26]. Ami a BMI-t illeti, alacsony érzékenységgel rendelkezik a táplálkozási állapot változásainak észlelésére, különösen elhízott betegeknél, ezért csak más értékelési eszközökkel együtt alkalmazható [26,32].
A testösszetétel értékes információkat nyújt a rákos betegek kezelésében, mivel a képalkotó módszerek kimutatják az izomtömeg csökkenését, valamint a zsírizmok beszivárgását [2]. Az alultápláltság, a szarkopénia és a cachexia kockázatának kitett rákos betegeknél fel kell mérni az izomtömeget [19,21]. A rendelkezésre álló módszerek a kettős röntgensugarabszorpció (DEXA), a számítógépes tomográfia a 3. csigolya szintjén vagy a bioimpedancia-elemzés (BIA). Emellett azt javasolták, hogy a táplálkozási értékelést a rákos kachexia szakaszaiban kell elvégezni, mivel a táplálkozási beavatkozás a leghatékonyabb a precachexia és a cachexia szakaszában [13].
2.2. Táplálkozási beavatkozás
A táplálékromlás kezelése érdekében elsődleges szempont a táplálkozási állapotra és annak alakulására vonatkozó objektív adatok gyűjtése a betegség egész ideje alatt. A különböző ráktípusok vagy helyek különböző táplálkozási mintákat mutatnak be, amelyek testre szabott táplálkozási terápiát igényelnek. A táplálék romlása egy többtényezős végeredmény, amelyet a rákkal és a táplálkozással és/vagy az anyagcserével kapcsolatos tényezők határoznak meg. A megfelelő táplálkozás enyhítheti a tünetek terheit, javíthatja az egész rák állapotát, támogathatja a rák túlélését [33,34,35,36], és a sikeres rákkezelés jellemzője.
A táplálkozási beavatkozások a betegek kórtörténetétől, a rák típusától és stádiumától, valamint a kezelésre adott választól függően változhatnak. Ha a beteg enni tud és funkcionális gyomor-bél traktus van, táplálkozási tanácsadás, ONS-sel vagy anélkül, a választott beavatkozásnak kell lennie a kezelés vagy betegség miatti megváltozott táplálkozási igények kielégítésére [19,21,26]. Szükség lehet az ONS-re, amely kompenzálja az alacsonyabb táplálékfogyasztást, és megpróbálja megakadályozni a táplálékromlást a kezelések során. A kiválasztott táplálkozási beavatkozás betartásának ellenőrzése elengedhetetlen.
2.2.1. Egyéni táplálkozási tanácsadás
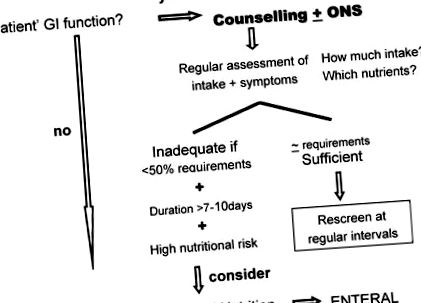
A klinikai gyakorlatban mindig az orális táplálkozás a prioritás. A szájon át történő táplálkozás az etetés előnyös módja, mivel ez a beteg napi rutinjának jelentős része, és jelentősen hozzájárul a betegek autonómiájához [19]. Kiváltságos időt jelent a családdal és a barátokkal tölteni, elkerülve az elszigetelődés hajlamát. Annak tudomásul vétele, hogy az előírt étrend egyénre szabott, alkalmazkodik és megfelel az egyéni szükségleteknek, kontroll érzéssel ruházza fel a beteget, így a pszichológiai moduláció szempontjából is rendkívül hatékony megközelítés. Mindezek a tényezők potenciálisan hozzájárulhatnak a betegek életminőségének javításához, és módosíthatják a kezelés akut és késői morbiditását. Az egyénre szabott táplálkozási tanácsadásért felelős táplálkozási szakember beutalásának mindig döntési terveken kell alapulnia (1. ábra).
Bizonyítékokon alapuló döntési terv.
Klinikusként fel kell ismernünk azokat a dimenziókat, amelyek meghatározóak a betegek számára. Valójában a diéta az egyetlen tényező, amelyet a beteg úgy érez, hogy a kezelések és beavatkozások teljes folyamata alatt kontrollálható. Emellett a beteg, a család és a gondozók is elismerik a megfelelő táplálékfogyasztást, ami elengedhetetlen a napi aktivitás, energia, funkcionális kapacitás fenntartásához és a kezelések sikeresebb legyőzéséhez. Különösen a táplálék pazarlása a rák stádiumától függetlenül gyakori (gyógyító, adjuváns, palliatív), és független előrejelzője a rossz fizikai működésnek, az alacsonyabb életminőségnek, a műtéti szövődményeknek és a csökkent túlélésnek [3,10,13,37]. A rákvesztést az izomtömeg romlása jellemzi, amely az újonnan diagnosztizált rákos betegek több mint 50% -ánál fordul elő, összehasonlítva a hasonló korú egészséges egyének 15% -os prevalenciájával [38]. Mivel mind az izomtömeg, mind a zsírszövet szerepet játszik az onkológiai kimenetelben, a testösszetétel optimalizálására irányuló stratégiák fontos részét képezik a sikeres rákterápiának. Ezért a táplálkozási beavatkozás egyik fő célja a testösszetétel kedvező befolyásolása, javítva a rákterápiás eredményeket, a betegségeket és végső soron a prognózist.
A hatékonyság érdekében az egyénre szabott tanácsadásnak a különféle táplálkozási és klinikai paraméterek alapos értékelésén kell alapulnia: táplálkozási állapot és étrendi bevitel, szokásos étrendi szokások, intolerancia vagy ételháborítás, a betegek pszichológiai állapota, autonómiája, együttműködés, segítségre vagy támogatásra való igény. mások az evés során. A tünetek alapos értékelése szintén kötelező (1. táblázat).
Asztal 1
A rossz tápanyag-bevitel gyakori okai rákos betegeknél.
Az íz, illat és étvágy romlása a daganat és/vagy a terápia következményeként
Megváltozott étkezési preferenciák/ételkerülés/idegenkedés
Étkezési problémák (fogak, rágás)
Dysphagia, odynophagia vagy részleges/teljes gasztrointesztinális obstrukció
Korai jóllakottság, hányinger és hányás
Sérülés, xerostomia, ragadós nyál, torokfájás, trismus
Szájüregi elváltozások és oesophagitis
A sugárterápia/kemoterápia által kiváltott mucositis
Akut vagy krónikus sugárbélgyulladás a sugárkezelés alatt és után
Ha/ha az orális táplálás nem megfelelő/elégtelen, akkor figyelembe kell venni a mesterséges táplálkozást [19,20,21,23,26,27]. A táplálkozási intézkedések fokozódásának kritériumai a következők: (1) nem megfelelő táplálékfelvétel (1,0 g/kg/nap fehérje. Ezért a fehérje egyensúly támogatása érdekében a konszenzus ajánlása legfeljebb 1,5 g/kg/nap vagy több fehérje lehet.) a tápanyag-tartalmú PN-adalékok, az esszenciális AA-nak az AA körülbelül 50% -ában kell lennie, és az elágazó láncú AA-nak az összes AA maradék 50% -át kell kitennie [50]. Ami a zsírt, mint energiaszubsztrátot illeti, a legtöbb egyetértésben alkalmazott rendszert alkalmazzák a nem fehérje kalóriák ~ 50% -ához [51,52].
A közelmúltban a PN mint tápanyag-adagolás kiegészítő útja (SHPN) jelent meg a tápanyag-leadás optimalizálásának lehetséges erőforrásaként. Az SHPN-ről szóló leendő tanulmányok [53,54,55,56,57] az energiaegyensúly, a testzsír megnövekedése, a maximális testmozgás nagyobb kapacitása és a QoL lehetséges előnyére utalnak. Egy nemrégiben végzett randomizált vizsgálat kimutatta, hogy az SHPN megakadályozhatja az MM csökkenését gyógyíthatatlan gyomor-bélrendszeri rákban szenvedő betegeknél [57]. Ezért még nincs elegendő bizonyíték arra, hogy az SHPN-t daganatos betegeknél javasolják a QoL és a táplálkozási paraméterek javítására. Ezenkívül a HPN gyakorlata országonként eltérő; a legtöbb nem fontolja meg a PN alkalmazását, ha van funkcionális gyomor-bél traktus, míg mások fontolóra vehetik annak alkalmazását, ha a beteg akaratának megfelel [58,59,60].
A refeeding szindróma akkor fordulhat elő, ha a folyadékok és az elektrolitok súlyos elmozdulása történik EN-t vagy PN-t kapó, súlyosan alultáplált betegeknél, és ez hipofoszfatémiát, hypokalaemiát, hypomagnesaemiát, tiaminhiányt, változásokat okozhat a nátrium-, glükóz- és folyadékegyensúlyban, valamint a fehérje- és lipidanyagcserében 19,21]. Megelőzése akkor ajánlott, ha a BMI 2 vagy 15% feletti akaratlan testsúlycsökkenés esetén az elmúlt három-hat hónapban, vagy amikor 10 napnál hosszabb ideig kevés vagy egyáltalán nincs táplálékfogyasztás, vagy ha alacsony a kálium-, foszfát- vagy magnézium etetés előtt. Ha a táplálékfelvétel legalább öt napig súlyos csökkenést mutat, akkor ajánlott a táplálkozás fokozatos növelése több nap alatt, és a számított energiaigény legfeljebb 50% -át kell biztosítani az etetés első két napján [19, 25]. Javítani kell az azonosított folyadék- és elektrolit-egyensúlyhiányokat, és szorosan ellenőrizni kell a keringési térfogatot, a folyadék egyensúlyát, a pulzusszámot és a ritmust, valamint a klinikai állapotot. Az újratáplálási szindróma kockázatának figyelembevételét jelenleg a rák kezelésére vonatkozó iránymutatások vizsgálják [19,20,21,22,23,26,27].
2.2.3. Sebészet
Alultáplált betegeknél a műtéthez kapcsolódó metabolikus stresszreakció és katabolizmus minimalizálása érdekében a műtét utáni fokozott gyógyulás ajánlott minden gyógyító vagy palliatív műtéten áteső rákos beteg számára [18,22,61]. Az ERAS protokollon belül a következő elveket kell betartani: Az alultápláltság szűrése és szükség esetén további táplálkozási támogatás biztosítása [18,22]; kerülje a műtét előtti koplalást; Meg kell fontolni a műtét előtti szénhidrátkezelést, valamint az orális táplálás helyreállítását az első posztoperatív napon; és a korai mozgósítás [18,22]. A műtét előtti böjt elkerülése érdekében az aspiráció veszélye nélküli betegek hat órán át szilárd ételeket fogyaszthatnak, az érzéstelenítés előtt pedig két óráig tiszta folyadékot fogyaszthatnak [18].
Onkológiai sebészeti betegeknél, közepes vagy súlyos táplálkozási kockázattal, táplálkozási támogatás javasolt a műtét előtt és után [18,25]. Ha súlyos alultápláltság van jelen, késleltetett műtétre lehet szükség [18,25]. Nagy műtét esetén rutinszerűen kell táplálkozási támogatást nyújtani, különös tekintettel az idős szarkopéniás betegekre.
Az ERAS protokoll mellett a táplálékkiegészítők korai megkezdése jelentősen csökkentheti a súlycsökkenés mértékét és a szövődmények előfordulását [22,25]. Ha arra számítanak, hogy a műtét után a páciens hét napnál tovább nem tud enni, akkor ajánlott a táplálkozási terápia megkezdése még jól táplált betegek esetében is [18,22,25]. A műtét után az orális táplálkozást is előnyben kell részesíteni az EN-vel szemben, és az utóbbit a PN-vel szemben. Ha lehetséges az orális bevitel, akkor azt műtét után megszakítás nélkül, az egyéni tolerancia felmérése után kell elkezdeni. Ha az orális táplálkozás nem lehetséges, az EN-t 24 órán belül el kell kezdeni, előnyben részesítve a szokásos polimer enterális formulákat, ha megfelelő [25].
2.2.4. Sugárterápia és kemoterápia
Az orális mucositis, a dysphagia és a hasmenés az RT- és/vagy CT-kezelések gyakori szövődményei [12,13,14,15,16,17,18,19,20,21,22]. Az RT során táplálkozási tanácsadás is ajánlott, különösen a HNC, a mellkas és a gyomor-bél traktus rákos megbetegedéseiben [12,13,14,15,16,17,18,19,20,21,22,23]. Ha szükségesnek tartják, ONS-t kell biztosítani [62], és ha súlyos mucositis van, akkor mesterséges táplálkozásra kell gondolni [23]. Ha az étrendi tanácsadás és az ONS nem elegendő a fogyás csökkentésére, vagy ha súlyos nyálkahártya-gyulladás vagy a fej, a nyak vagy a mellkas obstruktív daganatai vannak, akkor a mesterséges táplálkozásra kell gondolni [19,20,23]. RT-vel vagy kemoradioterápiával kezelt betegeknél a PN nem ajánlott [19], és csak akkor szabad figyelembe venni, ha a megfelelő táplálkozás nem biztosítható szájon át vagy EN-vel [19].
2.3. Specifikus tápanyagok
A táplálkozási stratégiákat, amelyek potenciálisan lehetővé teszik a rák jobb kezelését, széles körben vizsgálták, de kevesen értek el meggyőző eredményeket.
2.3.1. Fehérje
Sok rákos beteg nem éri el az ajánlott bevitelt (1,2–1,5 g/kg/nap), és még az egészséges egyéneknél sem (0,8 g/kg/nap) [63]. A korlátozott fehérjebevitel főként a táplálék bevitelét befolyásoló táplálkozási hatás tüneteiből adódik [64]. A legújabb irányelvek magasabb szintű fehérjebevitelt javasolnak (1,2–1,5 g/kg/nap), mivel a fehérje egyensúlyban tartásában és az izomtömeg fenntartásában a magasabb fehérjebevitel pozitív eredményei vannak. További érdekesség egy nemrégiben végzett tanulmány, amely inverz összefüggést mutat a vörös húsfogyasztás és a hétéves mortalitás között 992 stádiumú vastagbélrákban szenvedő egyén között [65], ami arra utal, hogy a magasabb fehérjebevitel valóban előnyös lehet a rákban.
Az aminosavakkal végzett beavatkozásokat tesztelték rákos megbetegedésekben, amelyek célja a táplálkozási állapot optimalizálása és az izomtömeg pazarlásának ellensúlyozása. Ide tartoznak az elágazó láncú aminosavak (leucin, izoleucin és valin) [63], β-hidroxi-β-metil-butirát, karnitin és kreatin kiegészítései. Mégis további kutatásokra van szükség a lehetséges előnyök tisztázása érdekében.
Ami a glutamint illeti, szájnyálkahártya-gyulladás esetén, illetve a medence RT alatti hasmenés megelőzésére/kezelésére történő kiegészítése nem ajánlott [19,22,26]. Ami az alkalmazását illeti, amikor a vérképző őssejt-átültetésen átesett betegeknél PN szükséges, az irányelvek nem azonosak: van egy méltányos ajánlás a 0,2–0,5 g/kg/nap esetleges alkalmazására [26], és az a jelzés, hogy nincs elegendő bizonyíték a glutamin mellett vagy ellene történő ajánlásra a rákellenes terápiás mellékhatások csökkentése érdekében, különösen nagy dózisú protokollokban [19]. Ami az izomtömeg javításának lehetőségét illeti, nincs elegendő adat annak alátámasztására.
2.3.2. Eikozapentaénsav és halolaj
A klinikai előnyök tisztázása érdekében homogén betegpopulációkkal rendelkező vizsgálatokra van szükség a rák típusára, stádiumára, daganatellenes kezelésére, a kiegészítő dózisra és az adagolás módjára vonatkozóan. Valójában figyelemre méltó, hogy tekintettel a CT/RT mérsékelt túlélési előnyeire egyes rákos megbetegedésekben, az orvosok számára fontos kérdés a jólét, az életminőség optimalizálása a táplálkozási állapot és a megfelelő testösszetétel révén [70].
2.3.3. Mikroelemek
A terápia és a korlátozott étrend káros hatásai miatt az American Institute for Cancer Research [71], az American Cancer Society [72] és az European Society for Clinical Nutrition and Metabolism - ESPEN [19] támogatja a multivitamin alkalmazását. -multimineralis kiegészítés az ajánlott étrendhez közeli adagokban. Specifikus hiány hiányában a vitaminok és ásványi anyagok nagy adagjainak alkalmazása nem ajánlott [19,20]. A D-vitamin hiánya releváns lehet rákban [19]; az alacsony D-vitamin és az izomsorvadás közötti összefüggésről is beszámoltak. Ennek következtében szükség lehet D-vitaminra a fehérje-kiegészítők hatékonyságának optimalizálásához. A legújabb irodalom fényében a rákos betegeknél a D-vitamin-kiegészítés 600–800 nemzetközi egységgel (RDA) előnyös lehet az izomsorvadás megelőzésében, de további kutatásokra van szükség.
3. Megbeszélés
A rák fő táplálkozási problémája az izomtömeg pazarlása, amelyet elismernek az alacsonyabb életminőség, a funkcionalitás romlása, a műtéti szövődmények és a rövidített túlélés előrejelzőjeként [10,63,73,74]. Megjegyzendő, hogy a szarkopénia a súly vagy a zsírtömeg csökkenésétől függetlenül jelentkezik. Így egy klinikailag releváns fenotípust, amely a rákban is megjelent, a túlzott zsírtömegű szarkopénia jellemzi. Ezenkívül az izomtömeg-kimerülés fő hatását a túlélésre és a kezelési toxicitásra [73,74], a fej-nyak rákos betegek egy kohorszjában végzett nemrégiben végzett tanulmány kimutatta, hogy a cachexiás betegek rosszabb betegségmentes túlélést mutattak. a nem cachectiás betegekkel összehasonlítva [12,39].
Ezt szem előtt tartva a klinikai erőfeszítéseknek és a kezelési eredmények javításának elsőbbségnek logikusan tartalmaznia kell a táplálkozási beavatkozást és a testösszetétel megfelelőségét. A klinikai orvosok és a betegek számára kiemelt fontosságú a hatékony táplálkozási beavatkozás keresése, amely javítja a testösszetételt (az izomtömeg és az izomminőség megőrzése), tekintettel a prognózisra. Az alultápláltság és a cachexia korai felismerésének a multimodális megközelítés részét kell képeznie a betegközpontú és az onkológiai eredmények javítása érdekében [47].
4. Következtetések
Összeférhetetlenség
A szerzők nem jelentenek összeférhetetlenséget.
- Az új szakácskönyv célja a rákos betegek segítése a kezelés és a gyógyulás során
- Az új sugárkezelés lehetőséget nyújt a prosztatarákos betegek számára az UPMC Pinnacle
- Egy új mikroRNS biomarker segíthet kimutatni a nyirokcsomó áttéteket hasnyálmirigyrákos betegeknél;
- A műtét előtti táplálkozási támogatás rákos betegeknél, akiknek nincsenek klinikai tünetei
- A rosszindulatú bélelzáródás kezelésének optimalizálása előrehaladott nőgyógyászati rákos JCO-ban