A Brd2 génzavar „metabolikusan egészséges” elhízást okoz: epigenetikus és kromatin alapú mechanizmusok, amelyek elválasztják az elhízást a 2-es típusú cukorbetegségtől
Jude T. Deeney
§ Orvostudományi adjunktus, Bostoni Egyetem Orvostudományi Kar, 650 Albany Street, 617-638-7088
Gerald V. Denis
† egyetemi docens, igazgató, Flow Cytometry Core Facility, Táplálkozási Elhízás Kutatóközpont és Rákkutató Központ, Bostoni Egyetem Orvostudományi Karának Farmakológiai és Kísérleti Terápiás Tanszéke, 72 East Concord Street, K520, Boston, MA 02118, 617-414-1371 iroda, 617-414-1372 laboratórium, 617-638-5673 fax
Absztrakt
A test energiaegyensúlyának megzavarása elhízáshoz és elhízás által vezérelt betegségekhez, például 2-es típusú cukorbetegséghez vezethet, amelyek járványszintet értek el. A bizonyítékok azt mutatják, hogy az elhízás okozta gyulladás az inzulinrezisztencia és a 2-es típusú cukorbetegség fő oka. A környezeti tényezők, például a tápanyagok, epigenetikus vagy kromatin alapú mechanizmusok révén befolyásolják a test energiaegyensúlyát. Bromodoménként és külső doméncsalád transzkripció szabályozóként a Brd2 számos gén expresszióját szabályozza a kromatin kódok értelmezésén keresztül, és részt vesz a test energiaegyensúlyának és immunfunkciójának szabályozásában. Súlyosan elhízott állapotban az egerekben a Brd2 leütése megakadályozta az elhízás által kiváltott gyulladásos reakciókat, megvédte az állatokat a 2-es típusú cukorbetegségtől, és ezáltal a nem elhízott cukorbetegségtől. A Brd2 fontos modellt kínál a transzkripció szabályozók működésének, valamint az elhízás és a cukorbetegség kialakulásának vizsgálatához; emellett egy lehetséges célpontot kínál az elhízás és a cukorbetegség kezelésére a kromatatin kódolvasó funkciójának modulálásával.
I. BEVEZETÉS: A TÖKÉLETESSÉG PROBLÉMA ÉS KOMPLIKÁCIÓI
Fontos azonban, hogy bizonyos elhízott egyének „anyagcserében egészségesek” legyenek, és csökkent a szív- és érrendszeri betegségek és a 2-es típusú cukorbetegség kockázata (Sims, 2001; Succurro és mtsai, 2008; Wildman és mtsai, 2008; Klöting és mtsai, 2010) ). A ’metabolikusan egészséges’ elhízott felnőtteket hasi elhízásként határozták meg (BMI ≥ 30), de hiányoznak belőlük a metabolikus szindróma (Meigs et al., 2006). Az ilyen személyek az USA-ban a felnőtt elhízott népesség körülbelül 25% -át teszik ki, azonban ez a prevalencia az inklúzió kritériumaitól függ, egy olasz tanulmányban az elhízott alanyok legalább 11% -ától, a prevalenciában eltérésekről számoltak be (Calori et al., 2011) az elhízott alanyok 47,9% -ára egy koreai tanulmányban (Lee, 2009). Az „anyagcserében egészséges” elhízott fenotípust leginkább a megőrzött inzulinérzékenység folyamatos eloszlásaként lehet elképzelni a növekvő BMI függvényében (Blüher, 2010). Ezen egyének egy része védő, megemelkedett adiponektinszintet mutat (Aguilar-Salinas et al., 2008), és megdöbbentően magas BMI ellenére is normális glükóztoleranciát mutat.
Azok a tényezők, amelyek párosítják az elhízást az inzulinrezisztencia és a metabolikus szindróma miatt, nagy orvosi érdeklődésre tartanak számot, mivel ezek alapozzák meg az elhízás által vezérelt 2-es típusú cukorbetegség etiológiáját. Így az „anyagcserében egészséges” elhízott egyén valószínűleg aranybányát ad az információkról. Ennek a populációnak az inzulinrezisztenciával szembeni elhízást párosító gének és utak vizsgálata újszerű, „gyógyszeres” célpontok azonosítására szolgálhat, amelyek segítenek az egészségtelen, elhízott betegekben elkerülni állapotuk legsúlyosabb társbetegségeit. Lényeges, hogy az „anyagcserében egészséges” elhízott fenotípus csökkent gyulladásos profillal társul (Romano et al., 2003; Karelis et al., 2005). Így valószínű, hogy a veleszületett és adaptív immunrendszer gyulladásos funkciói elengedhetetlenek ahhoz, hogy az elhízást összekapcsolják az inzulinrezisztenciával, a kardiometabolikus kockázattal és a 2-es típusú cukorbetegséggel. Sürgősen meg kell részletezni az immunsejt-altípusokat, azok citokin-termelési profilját és az inzulinrezisztens elhízott alanyok mobilizációs kinetikáját, valamint azt, hogy ezek kritikusan különböznek-e az „anyagcserében egészséges” elhízott alanyoktól.
V. A „METABOLIKUSAN EGÉSZSÉGES” TORZSÁG EGYÉB ÁLLATMINTÁI
További mechanikus megértés arról, hogy az emberek ezen populációja miként védhető meg az elhízás által vezérelt együttes morbiditástól, hipotézisek felállításával és állatmodellekkel történő teszteléssel érhető el. A brd2 lo egerek példáján túl léteznek más, alapvetően különböző típusú állatmodellek is, amelyek közül elsősorban immunológiai, mások zsírszövet-irányítottak. Ezek a különböző molekuláris és sejtes zavarok vagy hiányosságok lehetővé teszik az inzulinrezisztencia elhízását összekötő releváns utak pontosabb mechanisztikus feltárását.
1. Az alacsony gyulladású modellek közé tartozik
Interleukin-1 1. receptor kiütés. A csökkent gyulladásos profil, különösen a TNF és az interleukin-6 alacsonyabb szintje, úgy tűnik, megvédi ezeket az állatokat a magas zsírtartalmú étrend okozta inzulinrezisztenciától és a glükóz intoleranciától (McGillicuddy et al., 2011).
Indukálható nitrogén-oxid-szintáz (iNOS) kiütés: A makrofágok hiányos polarizációja a Nos2 kiütése következtében megvédi az elhízás okozta vázizom inzulinrezisztenciáját, és ez a fokozott foszfoinozidid-3-kináz/Akt aktivitással jár (Perreault és Marette, 2001)
A TNF ablációja: A TNF elleni antitest javítja az elhízás inzulinrezisztenciáját (Hotamisligil és mtsai., 1993), és a TNF szignálhiányos egereit megvédik az elhízás inzulinrezisztenciájától (Uysal és mtsai., 1997).
TWEAK kiütés: A TNF-rel kapcsolatos gyenge apoptózis induktor (TWEAK), a TNF szupercsalád citokinje fontos a sérülés utáni szövetek átalakulásában (Burkly és mtsai., 2007), valamint a zsírszövet átalakításában is az elhízás fokozott tárolása érdekében ( Li és mtsai., 2009). A TWEAK útvonal elhízott, 2-es típusú cukorbetegeknél aktiválódik (Chacón et al., 2006). A TWEAK-hiány (Campbell, 2006) a makrofág-polarizációt az alternatív módon aktivált „alacsony gyulladású” fenotípusra helyezi át, növeli a kollagénforgalmat és csökkenti a JNK-aktivációt az ivarmirigy zsírszövetében, metabolikus védelmet biztosítva az elhízásban (MS Obin, Tufts Egyetem Orvostudományi Kar, személyes kommunikáció).
IκBα szuprepresszor: Az NF-κB jelátvitel represszorának májban történő expressziója véd a magas zsírtartalmú étrend okozta és alacsony szintű NF-κB által kiváltott inzulinrezisztencia ellen (Cai et al., 2005).
2. A zsírszövet-modellek magukban foglalják
Kollagén 6 kiütés: Úgy tűnik, hogy a zsírraktárak fokozottabb képessége az elhízás átalakítására és a megnövekedett tárolás elfogadására csökkenti az adipocita stresszt és az apoptózist (Khan et al., 2009). Ez a megnövekedett kapacitás a kollagén 6 elvesztésétől függ, és javítja az éhomi glükóz- és glükóztoleranciát, talán a zsírraktárak fizikai, szterikus korlátozásainak enyhítésével.
Transzgenikus adiponektin: Az ob/ob (leptinhiányos) háttér inzulinrezisztenciájával járó súlyos elhízás drámai módon enyhíthető az adiponektin transzgénikus expressziójával (Kim és mtsai., 2007), amely faktor érzékenyíti a sejteket az inzulin szignálozására.
Az ilyen egérmodellek hasznosak lesznek a metabolikus védelem különböző fajtáinak feltárására, valamint arra, hogy az áthallás miként védheti meg a szervrendszereket a társbetegségektől (Denis, 2010).
VI. AZ INSULIN ÁTALAKÍTÁS MEGHATÁROZÁSA A BRD2 LO KÖRNYEZETBEN
Az elhízási járvány ebben a szakaszában kritikus fontosságú a 2-es típusú cukorbetegség fokozott kockázatának anyai-magzati átvitelét szabályozó mechanizmusok mélyebb megértése. Jelentős bizonyíték van, amelyet kezdetben a pima indiánok tanulmányai alapján nyertek, hogy a 2-es típusú cukorbetegségben szenvedő anyák fokozott cukorbetegség-kockázatot jelenthetnek az utódoknak (Dabelea et al., 2000; Dabelea és Pettitt, 2001; Dabelea 2007; Dabelea et al., 2008 ). A 2-es típusú cukorbetegség kialakulása mind az elhízott egyének fokozatosan csökkenő anyagcsere-egészségétől függ, mivel az inzulinrezisztencia és a gyulladás növekszik, mind pedig az β-sejtek inzulintermelésének feszültségétől, amely végül β-sejtek kudarcához vezet. Azt a kérdést, hogy az epigenetikai mechanizmusok hogyan befolyásolják az inzulinhatás csökkenését és az inzulintermelés különálló, de kapcsolódó kockázatait, nem vizsgálták jól.
A fokozott β-sejtek proliferációja és differenciálódása, valamint az inzulin transzkripciójának és a hasnyálmirigy β-sejtjeinek in vivo fokozott felszabadulása kétségtelenül megvédi az elhízott brd2 lo állatokat a glükóz-intolerancia és a β-sejtek elégtelenségétől. A szigetek nem mutatják az apoptózis vagy a stressz jeleit, de már kora kortól kibővülnek, valószínűleg a szigetek homeosztázisának korai zavaraként, amely közvetlenül a Brd2 redukciónak tulajdonítható, nem pedig a periférián az inzulinrezisztenciának (Wang et al., 2009).
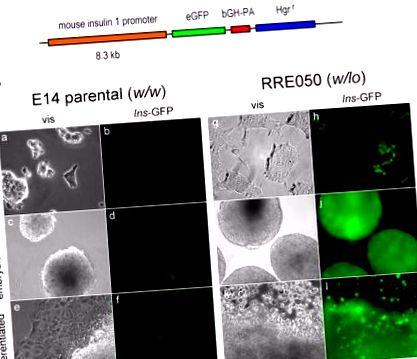
Megvizsgáltuk a csökkent Brd2 expresszió potenciális jelentőségét a fejlesztés során. Meg akartuk tudni, hogy az RRE050 vagy RRT234 eredetű embrionális őssejtekben a csökkent Brd2 expresszió (Wang és mtsai, 2009) megváltoztatta-e az energia-anyagcsere szempontjából releváns biológiát. A β-sejtvonalakban megnövekedett 1 inzulin gén transzkripció közzétett eredményei alapján feltételeztük, hogy az inzulin transzkripció erősödik az RRE050 vagy RRT234 sejtekben. Ennek megfelelően RRE050 embrionális őssejteket transzfektáltunk az Ins1 promóter eGFP riporter konstrukciójával, amelyet dr. Manami Harától kapott nagylelkű ajándékként, majd a sejteket higromicin alatt szelektáltuk az 1. ábra szerint. .
(A) Az egér inzulin 1 promóter vázlata, amely az eGFP (eGFP) expresszióját vezérli. A promóter elemek szintén bemutatásra kerülnek: a szarvasmarha növekedési hormon poli A szekvenciája (bGH-PA) és a higromicin rezisztencia (Hgr r). (B) Az (A) pontban szereplő konstrukcióval transzfektált és differenciálódásnak engedett ES sejtek vizuális (vis) és fluoreszcencia (Ins-GFP) mikrográfiái. A differenciálatlan sejteket zselatinnal bevont szöveti tenyésztő műanyagon tenyésztettük leukémia gátló faktor (LIF) jelenlétében (nem differenciálva), majd az LIF-et visszavontuk, hogy két hétig embrioid testek képződhessenek (embrioid testek), és a tenyésztést egy további további két hét a további differenciálás (differenciált) lehetővé tétele érdekében. A nagyítás az ábra jobb szélén látható. A szülői ES sejteket (E14 szülői; tömeg/tömeg) összehasonlítottuk a Brd2 KO ES sejtekkel (RRE050; tömeg/tömeg), Wang és mtsai, 2009 szerint, a differenciálódás ugyanazon szakaszában.
Figyelemre méltó, hogy ez az eredmény azt mutatja, hogy a csökkent Brd2 szint az inzulin gén transzkripcióját rendkívül korai szakaszban erősíti meg, még azelőtt, hogy az embrionális őssejt elvesztette volna totipotens tulajdonságait az in vitro differenciálódás során. Ezen adatok egyik lehetséges következménye, hogy a Brd2 célzott gátlása vagy az embrionális őssejtek genetikai módosítása terápiás stratégiát nyújthat a β-sejtek kudarcának a β-sejtek regenerálásával vagy az 1-es típusú cukorbetegség génterápiájával. A metabolikus diszfunkció epigenetikus alapú terápiája ezért megvalósítható, bár most nyilvánvalóan részletes mechanisztikus vizsgálatokra van szükség.
VII. AZ EPIGENETIKAI ÁTprogramozás transzlációs következményei: KÖVETKEZTETÉSEK
Az éhségtél esetében a megnövekedett kardiometabolikus kockázat anyai-magzati átvitelén kívül elhízás esetén valószínűleg más folyamatok is működnek, amelyek potenciális epigenetikus komponenssel bírnak. Például a bariatriás műtét utáni testsúly visszanyerése aggasztó problémaként jelent meg a klinikusok számára (Magro et al., 2008). Hosszú távon a bariatrikus betegek jelentős része (20,4% a kórosan elhízott betegeknél és 34,9% a túlsúlyos betegeknél egy vizsgálatban) (Christou és mtsai, 2006) jelentős súlyt kap. A betegek azon része számára, akiknek a visszanyerése nincs összefüggésben a műtéti kudarccal, lehetséges, hogy az epigenetikus tényezők szerepet játszanak az egészséges testsúly megőrzésének nehézségében a műtétet követő tíz évben. Hasonlóképpen, a kevésbé betegesen elhízottak étrendjének és életmódjának módosítása is csak vegyes sikert mutat.
Köszönetnyilvánítás
Köszönjük Dr. Minami Harának, a Chicagói Egyetemnek, az egér inzulin-promóter-eGFP riporter konstrukció nagylelkű ajándékáért. Ezenkívül köszönetet mondunk Caroline Apoviannak, Barbara Corkey-nak, Barbara Nikolajczyknak és Martin Obinnek a hasznos beszélgetésekért és értékes javaslatokért. A GVD-t a Nemzeti Egészségügyi Intézetek (R56 DK090455), a Bostoni Egyetem Klinikai és Transzlációs Tudományos Intézete (UL1-TR000157) és két NIH által támogatott központ támogatja: a Boston Area Diabetes and Endocrinology Research Center (P30 DK057521; PI: Joseph Avruch ) és a Bostoni Táplálkozási Elhízás Kutatóközpont (P30 DK046200; PI: Susan K. Fried). A GVD jelenleg az Obesity Society alaptudományi szekciójának elnöke, és hálásan elismeri a Társaságot a tudományos interakciók és együttműködések támogatásáért és támogatásáért.
- BPA és elhízás Hogyan okoz ez a műanyag súlygyarapodás táplálkozás egészséges táplálkozás
- Tökéletlen eszköz A vita arról, hogy a BMI az elhízás legjobb mércéje - Egészséges vita
- A CART-t kódoló gén polimorfizmusa a pima indiánoknál nem társul az elhízással
- Lehet-e egészséges és elhízott? Nem igazán, állítja a fő tanulmány
- Két SOCS3 génen belüli és közeli két polimorfizmus társulása elhízással három nemzetiségben