A búzadara kétlépcsős transzamidálásának hatása a glutén technológiai tulajdonságaira
Salvatore Moscaritolo
1 gabona minőségi egység (CRA-QCE), Agrárkutatási és Közgazdasági Kutatási Tanács, Roma 00189, Olaszország; [email protected]
Lucia Treppiccione
2 Élelmiszertudományi Intézet, CNR, Avellino 83100, Olaszország; moc.liamg@pertaicul (L.T.); ti.rnc.asi@onirbmottoa (A.O.)
Antonio Ottombrino
2 Élelmiszertudományi Intézet, CNR, Avellino 83100, Olaszország; moc.liamg@pertaicul (L.T.); ti.rnc.asi@onirbmottoa (A.O.)
Mauro Rossi
2 Élelmiszertudományi Intézet, CNR, Avellino 83100, Olaszország; moc.liamg@pertaicul (L.T.); ti.rnc.asi@onirbmottoa (A.O.)
Absztrakt
A lisztérzékenység (CD) immunbetegség által közvetített rendellenesség, amelyet a búza glutén bevitele okoz. A tünetek enyhítésére és a bél nyálkahártyájának normalizálására egész életen át tartó, gluténmentes étrendre van szükség. Korábban azt tapasztaltuk, hogy a mikrobiális transzglutamináz (mTG) által végzett transzamidációs reakció hatékony volt a gliadin-specifikus immunválasz csökkentésére CD-betegeknél. Ebben a tanulmányban a kétlépcsős transzamidációs protokollt alkalmazták a kereskedelmi búza búzadara kísérleti kezelésére. Az enzimatikus reakció hatékonyságát konszolidált biokémiai és immunológiai módszerekkel teszteltük izolált prolaminokon. Megállapítottuk, hogy a vízben oldhatatlan gliadin és a glutenin hozama a búzadara esetében 5,9% ± 0,3% -ra, illetve 11,6% ± 0,1% -ra csökkent kétlépcsős transzamidációs reakció után. A DQ8 transzgénikus egereket használva a gluténérzékenység modelljeként drámai csökkenést tapasztaltunk az IFN-γ-termelésben a lépsejtekben, amelyeket in vitro hoztunk létre transzamidált búzadarab maradék oldhatatlan gliadinnal (N = 6; mediánértékek: 850 vs. 102; kontroll vs. transzamidált búzadara, p Kulcsszavak: lisztérzékenység, transzamidáció, búzadara
1. Bemutatkozás
2. Anyagok és módszerek
2.1. A durumbúza búzadara minőségi jellemzői
A búzadara kémiai és technológiai jellemzését standard elemzésekkel végeztük: fehérjetartalom (ICC 105/2 Kieldhal), gluténtartalom% (ICC 137/1; 155; 158), sárga index (Minolta Chromameter CR-300, CEN standard módszer 15465 ), alveográfiai teszt (ICC 121), Braabender Farinograph (ICC 115/1). A teszteléshez kereskedelmi célú durumbúza került felhasználásra. A búzadarát kísérleti őrlőüzemben szerezték be (Buhler MLU 202, Uzwil, Svájc). Az adatokat az ismételt elemzések átlagának nevezzük, és az ismétlések közötti különbségeket az egyes módszerek meghatározott tartományaiba illesztettük.
2.2. Durumbúza búzadara transzamidációs reakciója
Az élelmiszeripari mikrobiális transzglutamináz (mTG) az Ajinomoto Foods-tól (Hamburg, Németország; ACTIVA ® WM; 81–135 U/g) volt; lizin-etil-észter (K-C2H5) a NutraBio-tól (NutraBio.com, Middlesex, NJ, USA) származik. A búzadarát két térfogat vízben szuszpendáljuk, amely 8 U/g mTG-t és 20 mM K-C2H5-t tartalmaz. Az inkubációt egy Micro MFCS reaktorüzemben (BBraun AG, Melsungen, Németország) végezzük, 16 liter névleges kapacitással. A reaktortelepet előzetesen sterilizálták, majd a hőmérsékletet 30 ° C-on csökkentették. Az első lépést 2 órán át 30 ° C-on hajtjuk végre, és a szuszpenziót centrifugálással nyerjük ki (1000xg, 10 perc). Miután a reaktort csapvízzel alaposan átmosták, egy második enzimlépést hajtottak végre 3 órán át 30 ° C-on, friss enzimmel és azonos koncentrációjú K-C2H5-gyel. A szuszpenziót végül centrifugáltuk (15 000 x g, 10 perc), és a tészta kinyert.
2.3. A búzadara transzamidálásának biokémiai elemzése
A 20 ml búzadara-szuszpenzióból álló mintát 3000xg sebességgel 10 percig centrifugáltuk. A maradék gliadin és glutenin frakciókat módosított Osborne eljárással extraháltuk a fehérje pelletekből [15]. A fehérjetartalmat Bradford-elemzéssel értékelték [16].
2.4. A búzadara transzamidálásának immunológiai elemzése
A HLA-DQ8 molekulát expresszáló transzgénikus egereket endogén egér II osztályú gének hiányában [17] több generáción át GF diétán (Altromin-MT-mod, Rieper SpA, Bolzano, Olaszország) tenyésztettük kórokozótól mentes körülmények között, a állattartó létesítmény (164/99-A. akkreditáció). Minden eljárás megfelelt az olasz egészségügyi minisztérium irányelveinek. A hathetes egereket intraperitoneális injekcióval alapoztuk meg gliadinokkal (300 μg), amelyeket emulgeáltunk Freund teljes adjuvánsában (Sigma) (0. nap). A hiányos Freund adjuvánsban azonos mennyiségű antigént tartalmazó emlékeztetőket injektáltunk a 7. és a 14. napon. Az egereket a 21. napon feláldoztuk lépeik helyreállítása érdekében. A lépeket rozsdamentes acél dróthálón engedték át a sejtek disszociálása céljából. Az eritrocitákat úgy távolítottuk el, hogy a sejtszuszpenziókat Tris-pufferolt ammónium-klorid-oldattal kezeltük. Minden egyes mintához 5x105 sejtet inkubáltunk 0,2 ml táptalajban, 96 üregű, lapos fenekű lemezeken, 37 ° C-on, 96 órán át gliadinek (200 μg/ml) jelenlétében. 72 óra elteltével a felülúszókat összegyűjtöttük, és házon belüli szendvics ELISA-val elemeztük az IFN-y fehérje szintjét.
2.5. Tészta gyártási eljárás
A búzadarát tésztaminták előállítására használták fel egy kísérleti üzemben (Namad – Róma, Olaszország). A 30% -os hidratálási indexet mutató transzamidált nedves tésztát 5 percig szobahőmérsékleten, gyúró előkeverőben homogenizáltuk, majd vákuumban a keverőkamrába helyeztük. A következő lépésben a transzamidált nedves tésztát 100 bar-ig préseltük egy 300 mm hosszú és 45 mm átmérőjű csavaron keresztül 30 ° C-on. A tésztából spagettit formáztunk (size = 1,30 mm) bronz extruderrel. Ezután a tésztát egy kísérleti növényszárító berendezéssel (Afrem – Clextral sas, Firminy, Franciaország) szárítottuk, a következő hőmérsékleti (° C)/relatív páratartalmi (rh) ütemtervet alkalmazva: 77 ° C/85% rh, 3 óra; 70 ° C/77% rh, 3 óra; 1 ° C-on 70 ° C-ról 35 ° C-ra/70% relatív relatív hőmérsékletre csökkentjük; 35 ° C/65% rh, 20 óra; a szárított tésztát végül szobahőmérsékleten, szabályozott atmoszférában tároltuk. A tészta főzési minőségét szenzoros analízissel értékelték D’Egidio és mtsai. [18]. A minőségi szempontokkal kapcsolatos eredményeket három meghatározás átlagértékeként fejeztük ki.
2.6. Statisztikai értékelés
A statisztikai szignifikanciát Kruskal-Wallis teszt és Dunn post-hoc teszt elemzése határozta meg GraphPad PRISM 4.0 szoftver (GraphPad Software, Inc., La Jolla, CA, USA) alkalmazásával. A 0,05 vagy annál kisebb p-értéket szignifikánsnak tekintették.
3. Eredmények
3.1. A búzadara és a szárított tészta minőségi jellemzői
A kémiai és reológiai jellemzőket klasszikus módszerekkel értékeltük: a búzadara fehérjetartalma 12,4% ± 0,1% (d.m.), gluténtartalma 10,3% ± 0,1% (d.m. bázis); a sárga index (b) a búzadara és a szárított tészta esetében 17,5 ± 0,1, illetve 15,7 ± 0,2; és a reológiai jellemzők eredményeként alveográfiai vizsgálatot végeztünk W 210 (10-4 Joule) és p/L 4,5, valamint egy farinográf braabender 55% abszorpcióval és 5,0 perc stabilitással.
3.2. Transamidált búzadara kísérleti gyártása
Empirikusan megállapítottuk, hogy a legjobb reaktorteljesítmény legfeljebb 6,0 kg durumbúza búzadara enzimatikus kezelésével érhető el 13,5 literes végtérfogatban. Ennek megfelelően a búzadarát lassan szuszpendáljuk 10,0 liter 20 mM K-C2H5 vízoldatban, és a szuszpenziót átvisszük a reaktorba. Keverés közben óvatosan hozzáadjuk az ACTIVA ® WM-et. Ezt követően a keverési sebességet növelték, és azt találtuk, hogy 450 fordulat/percre van szükség az enzim egyenletes eloszlásának eléréséhez. Centrifugálás után az üledéket 20 mM K-C2H5-ben (12,0 liter végtérfogat) szuszpendáljuk a második lépés végrehajtása érdekében. Ezzel a megközelítéssel 9,6 kg transzamidált tésztát kaptunk.
3.3. Transzamidált prolaminok elemzése
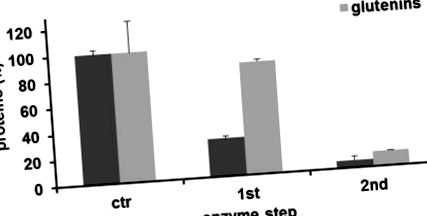
Az mTG katalitikus aktivitásából származó izopeptidkötések termelése a második lépés után drámai módon csökkentette a gliadin hozamát 29,3% ± 1,9% -ra és 5,9% ± 0,3% -ra (átlag ± SD; 1. ábra). Éppen ellenkezőleg, a gluteninek hozamát az első enzimlépés után meglehetősen befolyásolta (86,6% ± 1,6%), a második lépés után pedig 11,6% ± 0,1% -ra csökkent. Ezután a darából kétlépcsős transzamidációs folyamatot követően kivont gliadinek immunológiai hatásaira összpontosítottunk. A T-sejtek által közvetített válasz lehetséges módosításainak meghatározásához HLA-DQ8 transzgénikus egereket használtunk, amelyek csak az emberi MHC II. Osztályú molekulát expresszálják, amelyhez kapcsolódik a CD [17]. A gliadinokkal végzett immunizálást követően a lépsejteket kinyertük és in vitro stimuláltuk különböző gliadinkészítményekkel. Az immunválaszt az IFN-y expresszió értékelésével elemeztük. A 2. ábrán bemutatott eredmények azt mutatták, hogy az immunizált egerek lépsejtjei 72 órás tenyésztés után szignifikáns citokin fehérje szintet indukáltak, amikor natív gliadinnal stimulálták őket. Nevezetesen, amikor a gliadin-specifikus lépsejteket kétlépéses transzamidálásnak alávetett búzadarából izolált maradék oldhatatlan gliadinnal stimuláltuk, az IFN-y termelődése drámai módon blokkolt volt.
A maradék gliadin és glutenin fehérje frakciók értékelése a transzamidációs reakció után, módosított Osborne-eljárással tisztítva. Mindegyik oszlop a három párhuzamos kísérlet kontrolljának (kezeletlen búzadara) százalékában számított értékeket (átlag ± SD) jelenti.
- Az étrendi glutén eliminációjának hatásai visszatérő kisebb aftos szájgyulladásban szenvedő betegeknél, és nem
- Az alacsony energiatartalmú étrend és a magas fehérjetartalmú, alacsony zsírtartalmú étrend szexuális és endotheliális hatásainak összehasonlítása
- Bolyhos teljes kiőrlésű cukkini kenyér palacsinta Ambiciózus konyha
- Az izolált szójafehérje lenmagolajjal összehasonlítva az izolált szójafehérjét kukoricaolajjal és búzával
- Feltörekvő újítások a sajt sótartalmának csökkentésére; A só hatása az ízre, a textúrára és a