A glutation S-transzferáz P1-t szabályozó mikroRNS prosztatarákban
Absztrakt
A méregtelenítési folyamatban részt vevő enzimet, a glutation S-transzferáz P1-t (GSTP1) az epigenetikus módosítások miatt gyakran inaktiválják a prosztatarákban. In silico analízissel azonosítottuk a mikroRNS-ek (miRNS-ek) egy részét, amelyek feltételezett célpontok a GSTP1 szabályozásában. A miRNS-ek kicsi, endogén, nem kódoló RNS-ek, amelyek a különféle fiziológiai és kóros folyamatok kritikus szabályozói, és expressziós szintjük pontos szerepet játszhat a rák korai diagnózisában és prognózisában. Ezeket a kis molekulákat sokféle emberi biológiai mintában detektálták, beleértve a vért, a szérumot, a vizeletet, az ejakulátumot és a szöveteket, amelyek klinikailag hasznos biomarkerként használhatók a prosztatarák korai felismerésében és prognózisában. A fejezet összefoglalja a prosztatarákban a GSTP1 szabályozásában szerepet játszó miRNS-sel kapcsolatos jelenlegi ismereteket, valamint a betegség korai felismerése és prognózisa szempontjából hasznos biomarkereként rejlő lehetőségeiket, valamint a fejlesztés kihívásait és korlátait.
Bevezetés
A prosztatarák továbbra is a férfiak leggyakoribb formája az Egyesült Államokban [1]. Az American Cancer Society becslése szerint 2014-ben körülbelül 233 000 új prosztatarákos esetet diagnosztizálnak, és körülbelül 29 480 férfi hal meg ebben a betegségben [1, 2]. A daganat korai diagnosztizálása és a prosztatarák progressziójának időben történő kimutatása műtét vagy sugárterápia után kritikus fontosságú a hatékony és előnyös klinikai eredmény szempontjából. A szérum alapú teljes prosztata-specifikus antigén (PSA) széles körű alkalmazása a prosztatarák kimutatásához vezetett egy potenciálisan gyógyítható szakaszban; szűrővizsgálati eszközként történő használata azonban továbbra is ellentmondásos, mivel a prosztatarák kockázatának azonosításához nincs valódi tPSA-határérték [3, 4]. Először is, a PSA-szinten 4 ng/ml vagy annál magasabb szinteken kimutatott prosztatarákok körülbelül egyharmada már átterjedt a prosztatakapszulára vagy azon túl, és a PSA-szintű férfiak körülbelül 15% -a
Glutation S-transzferázok
Glutation S-Transferase pi és prosztatarák
Epigenetika és génszabályozás
A génexpressziót bonyolultan szabályozzák az epigenetikus módosítások, például a DNS-metiláció, a hisztonfehérjék poszt-transzlációs módosításai és a génexpresszió transzkripciós szabályozása nem kódoló szabályozó mikroRNS segítségével [42, 43]. Számos tanulmány kimutatta, hogy a GSTP1 gén közelében található szabályozó szekvenciákat általában inaktiválják a DNS hipermetilezése a prosztata karcinogenezisének korai szakaszában [44, 45]. A GSTP1 5′CpG szigeti régiójában eloszló deoxycytidin nukleotidok kiterjedt metilációja nem mutatható ki jóindulatú prosztata szövetben, de magas fokú intraepithelialis neoplasia (HGPIN) és prosztata adenocarcinoma esetén a szövetekben és a folyadékokban, beleértve a plazmát, a szérum prosztata ejakulátumokat, és vizeletminták [46–48].
A hiszton módosítása szorosan összefügg a prosztatarák DNS-metilációjával [49]. Tanulmányok kimutatták, hogy az I. osztályú hiszton-deacetilázok (HDAC) gyakran túlzottan expresszálódnak a prosztatarákban [50]. Tanulmányok kimutatták, hogy a HDAC1 hozzájárul az agresszív tumor viselkedéshez és a rossz prognózishoz, míg a HDAC2 expresszió rövidített relapszusmentes túlélési idővel társul prosztatarákos betegeknél [51]. A HDAC1–3 nagymértékben expresszálódik a prosztatarákban, és a megfelelő HGPIN elváltozások egybeesnek a tumor minták GSTP1 expressziójának elvesztésével [51, 52]. Li és mtsai. kimutatta, hogy a HDAC1 gátlása a maspin, egy daganatot elnyomó szerpin hatására, növeli a GSTP1 expresszióját az emberi prosztatarák sejtjeiben, megerősítve, hogy a HDAC1 kritikus szerepet játszik a maspin által közvetített GSTP1 újrakifejezésében [53].
A nem kódoló RNS-ek a gének kulcsszabályozóinak új osztályaként jelentek meg [54, 55]. A mikroRNS-ek (miRNS-ek) rövid (~ 20–24 nukleotid) nem kódoló RNS-ek, amelyek a génexpressziót leginkább úgy szabályozzák, hogy megkönnyítik a növényekben a megcélzott mRNS hasítását [56]. Érdekes módon a miRNS-ek leginkább transzlációs represszióval befolyásolják célgénjük expresszióját állatokban. A miRNS-ek a tökéletlen komplett bázispárosítással a 3'-nem transzlált régióval (3'UTR) tökéletlen komplett bázissal célozzák meg a célpont fehérjeszintézisének csökkentését vagy a célzott üzenet deadenilezésével, vagy a transzláció visszaszorításával az aktívan transzláló riboszómáknál [57, 58]. Jelenleg a miRBase 2588 érett emberi miRNS-t állít össze az emberi genom összeállításától (GRCh 38) a GenBankig [59]. Az előrejelzések szerint ez a sok miRNS> 45 000 helyet céloz meg, amelyek az emberi gének> 60% -át teszik ki.
A GSTP1 potenciális szabályozása miRNS-ek segítségével
Számos számítási és kísérleti megközelítést alkalmaztak a miRNS-ek és azok célzó génjeinek azonosítására [70 ••, 71]. Ehhez a tanulmányhoz számítógépes megközelítéseket használtunk a miRNS-ek azonosítására, amelyek potenciálisan a GSTP1 expresszióját célozzák és szabályozzák (1. táblázat). Ezek a miRNS-ek a miR-133a/b, miR-144/144 *, miR-153-1/2 és miR-590-3p/5p. Ebben a fejezetben e miRNS-ek rövid leírását, valamint a rákban és a GSTP1-szabályozásban való részvételüket emeljük ki.
miR-133a/b
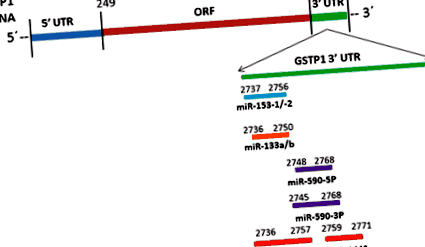
A miR-133-a/b, miR-153-1/2, miR-590-3P/5P és miR-144/144 * célhelyek sematikus ábrázolása a GSTP1 3'UTR-en
miR-144/miR-144 *
miR153-1/2
miR-590-3p/5p
A mikroRNS céladatbázisok, mint például a TargetScan és a miRanda, azt jósolták, hogy a miR-590-3p/5p képes szabályozni a GSTP1 mRNS-t, és/vagy a miR-590-3p fehérje expressziója 7mer-et képez a GSTP1 3'UTR 57-63-os pozícióiban. A GSTP1 mRNS-szekvenciájának vizsgálata feltárta, hogy a miR-590-3p/5p potenciális célhelyek találhatók a 3'UTR régió 2748–2748 nukleotidjainál (1. ábra). A miR-590-3p/5p egyes emberi rákos megbetegedésekről kimutatták, beleértve a májsejtes karcinómát, a tiszta sejtes vesesejtes karcinómát, a myeloid leukémiát és a méhnyakrákot [102-105]. Kimutatták, hogy a miR-590-5p újraszabályozása elősegíti a tiszta sejtes vesesejtes karcinóma sejtek szaporodását és invázióját a p21 (Waf1/Cip1) expresszió csökkentésével [103]. Kimutatták, hogy a kasztrátrezisztens prosztatarákban is differenciáltan expresszálódik a jóindulatú prosztata hiperpláziához képest [106]. A TargetScan a miR-590-3p/5p potenciális célgénjeként jósolta a PTEN-t, és azt találták, hogy aktiválja a PI3K-AKT jelátviteli utat a PTEN lefelé történő szabályozásával az AKT1-S473 foszforiláció elősegítése érdekében [107], amely fontos szerepet játszhat a GSTP1 szabályozásában. prosztatarákban.
Következtetés, korlátozások és jövőbeli irány
A szérum PSA szint mérése nem határozza meg megfelelően a prosztatarákot, és nem jósolja meg a prognózist a végleges terápia után. Ezért jelentős kihívást jelent új, nem invazív biomarker-azonosító stratégiák kidolgozása a prosztatarák pontos detektálására és előrejelzésére. A miRNS-ek az onkogén és a tumor elnyomó gének fontos szabályozói, amelyek elfogják a tumorgenezissel járó különféle jelátviteli utakat és kóros folyamatokat. Számos publikáció számolt be arról, hogy a miRNS az új biomarkerek osztályaként rejlik a diagnózisban és a betegség prognózisában [63–68, 69 ••]. In silico elemzésünk azt sugallja, hogy a miRNS-ek a GSTP1 expresszió potenciális szabályozásával képesek ellátni funkcióikat, és fontos szerepet játszhatnak a prosztata karcinogenezisében (1. táblázat; 1. ábra). A GSTP1-t szabályozó felsorolt feltételezett miRNS-ek azonosításával részletesebb szabályozói szerepet lehet megfejteni, amely alkalmazható lehet a prosztatarák korai felismerésében és prognózisában.
A fejlesztés és a hagyományos biomarkerek helyettesítése azonban továbbra is korlátozott. Ez magában foglalja a megalapozott endogén miRNS-kontroll hiányát a testnedvek miRNS-szintjének normalizálására. Ebben a tekintetben az U6 kis nukleáris RNS-t gyakran alkalmazzák a miRNS-szintek normalizálására; instabil jellege és szérumban való lebomlása azonban nem minősíti ideális standard kontrollnak. Egy másik korlátozás a miRNS felszabadulása a testnedvekbe, és ennek funkcionális szerepe és következményei ismeretlenek és/vagy korlátozott következetlenségek maradnak a miRNS prosztatarákos működésének elemzésében. Továbbá, a prosztatarákban szenvedő sok miRNS esetében a pontos ok-okozati mechanizmus (ok) az ilyen kutatások jelentős erőfeszítései ellenére sem kerültek megállapításra. Ezért további vizsgálatokra van szükség a miRNS prosztatarákban betöltött szerepének és következményeinek megértéséhez új, nagy teljesítményű technikák segítségével. Egy másik megfontolandó megfontolás az, hogy a miRNS, valamint a cél mRNS poszttranszkripciós génszabályozását az RNS-kötő fehérjék (RBP) tovább modulálják. Számos RBP-t jellemeztek a közelmúltban, és sokan szerepet játszanak mind a miRNS, mind az mRNS stabilitásában.
Összegzésképpen elmondható, hogy a GSTP1 expresszióját és működését szabályozó miRNS-ek kimutatásának technikai fejlődése nagy ígérettel járhat a prosztatarák molekuláris biomarkereként. Ezen miRNS-szabályozó GSTP1 vizsgálatok további fejlesztése és alkalmazása olyan klinikai mintákon, beleértve a vért, vizeletet, ejakulátumot és prosztata biopsziát a rákszűrés és a korai felismerés szempontjából, nagy ígéretekkel járhat klinikai tesztjelöltként. Új vizsgálatsorozatra van szükség, amely kritikusan értékeli a miRNS-ek prediktív értékeit a prosztatarákban.
- A glutation S-transzferáz P1-t szabályozó mikroRNS prosztatarákban
- Prosztata rák megelőzése Johns Hopkins Medicine
- A prosztatarák kockázati tényezői Johns Hopkins Medicine
- A prosztatarák aránya itt a japán férfiaknál 3x alacsonyabb; s Miért
- Prosztatarák Útmutató az öregedő férfiak számára