A gyümölcs- és gyümölcslé-epigenetikus aláírások független immunszabályozó utakhoz kapcsolódnak
Társított adatok
Absztrakt
Az epidemiológiai bizonyítékok határozottan arra engednek következtetni, hogy a gyümölcsfogyasztás számos egészségügyi előnyt jelent. Annak ellenére, hogy általános az egyetértés abban, hogy a gyümölcs és a gyümölcslé táplálkozási szempontból hasonló, a léfogyasztás epidemiológiai eredményei ellentmondásosak. Célunk az volt, hogy DNS-metilációs jeleket használjunk a gyümölcs- és gyümölcslé-epigenetikus aláírások jellemzésére a PBMC-kben, valamint azonosítsuk az ezekhez a csoportokhoz tartozó megosztott és független aláírásokat. A Framingham utódainak 8 vizsgáján részt vevő 2148 egyén genomszintű DNS-metilációs jegyeit (Illumina Human Methylation 450k chip) elemeztük a gyümölcs- vagy gyümölcsfogyasztás közötti korrelációkra standard lineáris regresszió alkalmazásával. Alacsony P-értékű CpG-webhelyek (P Kulcsszavak: személyre szabott táplálkozás, DNS-metiláció, epigenetika, gyümölcsfogyasztás, gyümölcsléfogyasztás
1. Bemutatkozás
2. Anyagok és módszerek
2.1. A tanulmány résztvevői
A jelen tanulmány 2148 kaukázusi egyént vett részt, akik részt vettek a Framingham Heart Study utódok kohorszvizsgáján 8 2005–2008 között, és rendelkezésükre állt minden releváns fenotípus- és genomszintű DNS-metilációs adat. A résztvevők 979 férfiból és 1169 nőből álltak, 40–92 év közöttiek (medián 65). Amint azt korábban leírtuk [32], az FHS utódcsoportot 1971-ben toborozták, és 5124 utódot tartalmazott az eredeti FHS kohortból és házastársaikból. Az alkalmazott antropomorf méréseket az utódok vizsgáján végeztük el 8.
2.2. Diétás intézkedések
Az étrendi bevitelt félig kvantitatív Framingham élelmiszer-gyakorisági kérdőívvel (FFQ) értékeltük [33,34]. Az FFQ-kat a nem intézményesített résztvevőknek postázták a vizsgálat előtt, és megkérték a résztvevőket, hogy a kitöltött kérdőívet hozzák el kinevezésükre. A résztvevők beszámoltak arról, hogy az elmúlt évben átlagosan milyen gyakran fogyasztottak minden egyes élelmiszer normál adagját. A jelentett gyakoriságokat használták az egyes tételek szokásos napi/heti adagjainak megbecsülésére. Az egyes élelmiszerekből levezetett heti adagokat használtuk elemzéseink során, és 2 kategória létrehozására használtuk fel: gyümölcs és gyümölcslé (S1. Táblázat). A maradék módszerrel korrigáltuk a vizsgált ételeket a teljes energiafogyasztáshoz.
2.3. DNS-metilációs adatfeldolgozás
A perifériás vér mononukleáris sejtjeiből (PBMC) izolált DNS-t korábban az Infinium Human Methylation450K Bead Chip-szel [35] (Illumina) vizsgáltuk és a dbGaP-be helyeztük [Study Accession: phs000724.v6.p10]. A genom egészére kiterjedő DNS-metilációs szint 2619 FHS-résztvevőtől volt letölthető. A nemi kromoszómákon található próbákat, illetve azokat, amelyek P-értéke 0,001-nél nagyobb volt a minták 75% -ában, eltávolítottuk. Azokat a biszulfit-konvertált genomban egynél több helyre feltérképező, vagy az ismert egyetlen nukleotid polimorfizmus (SNP) helyével átfedő térképeket is eltávolítottuk [36]. A tömb 485 000 szondája közül 325 963 szondát vittek tovább és dolgozták fel a minfi csomag segítségével [37]. Az Infinium I és II típusú szonda elfogultságát korrigálták a részhalmaz-kvantilis alkalmazásával a tömb normalizálás (SWAN) algoritmusán belül [38]. A szonda nyers értékeit korrigáltuk a színegyensúlytalanság és a háttér szempontjából a kontrollok normalizálásával. A metilációs szinteket β értékekként jelentik, amelyek a metilezett gyöngyökből kapott jel töredéke a metilezett és nem metilezett gyöngyjelek összegéhez viszonyítva. Az elemzésre rendelkezésre álló 2619 személy közül 12 egyénnek nem sikerült a minőségellenőrzése, és eltávolították őket a további elemzésből.
Az ismert összetevő változók globális metilációs profilokra gyakorolt hatásának meghatározásához fő komponens elemzést használtak. A chip, a chip elhelyezkedése, a nem, az életkor és a családhoz való kapcsolódás szignifikánsan összefüggésben állt a fő összetevőkkel (S1. Ábra, S2. Táblázat). A családi rokonságot a közös törzskönyvek alapján határozták meg, amelyek a nem rokon házastársakat konzervatív megközelítésként vették figyelembe a közös környezeti tényezők figyelembevételével [39]. A chip és a chip elhelyezésének hatásait a COMBAT segítségével távolítottuk el, miközben védettük a gyümölcs- és gyümölcsléfogyasztást [40]. A helyettesítő analízist (SVA) alkalmazták további ismeretlen technikai vagy biológiai zavaró változók azonosítására a COMBAT által kiigazított maradványokban [41], például a fehérvérsejtszám-összetételben [42]. A helyettesítő változók szorosan kapcsolódtak az ismert kovariánsokhoz, mint például az életkor, a nem, a rokonság és a betegség állapota (S3. Táblázat). Az összes további elemzéshez maradék COMBAT-korrigált metilációs β értékeket használtunk.
2.4. Statisztikai elemzések
Az adatokat R szoftverrel elemeztük (v3.3.1, R Foundation for Staistical Computing, Bécs, Ausztria). A gyümölcsfogyasztás és az egyes CpG helyek DNS-metilációs szintje közötti összefüggés értékeléséhez lineáris regresszióanalízist végeztünk az R csomag limma [43] felhasználásával, a kovariátokként felvett helyettesítő változókkal. A nemet, a fenotípust, a rokonságot és a betegség állapotát az SVA rögzítette (S3. Táblázat), és így a regressziós modellben nem vették figyelembe őket. Lineáris regressziót végeztünk 2148 QC-n áteső kaukázusi egyednél, amelyhez szükséges fenotípus-, FFQ- és DNS-metilációs információkkal rendelkezünk.
Az empirikus P-értékeket 10 000 permutációból származtatták. Az alacsony P-értékű dúsítás értékeléséhez a gyümölcs- vagy gyümölcsléfogyasztást permutáltuk, majd lineáris regressziót alkalmaztunk a CpG-helyek és a P közötti korreláció értékelésére 1. ábra A, B; S4 és S5 táblázat). A gyümölcs- és a gyümölcsfogyasztás egyaránt dúsult az alacsony P-értékek szempontjából (empirikus P −5 mindkét vizsgálat esetében; 1. ábra C, D; S3. Ábra). Az epigenetikus aláírások (P −5). Ez arra utal, hogy bár a gyümölcs- és gyümölcslé-epigenetikus aláírások nagyrészt függetlenek, ugyanazon gének nagy részét befolyásolhatják.
3.2. Gyümölcs és gyümölcslé epigenetikus aláírások GSEA
A gyümölcs- és gyümölcslé-epigenetikus aláírások közelében dúsított utakat GSEA-val azonosítottuk (N = 1843, illetve 1872 gén). Míg a gyümölcs és a gyümölcslé epigenetikus aláírásai ugyanazon útvonalak sokaságában dúsított gének közelében voltak; például az immunrendszer, a citokin jelátvitel és a sejtciklus, ezeknek a dúsításoknak az alapját képező gének és asszociatív sejtjelzési útvonalak meglehetősen eltérőek és egyediek az egyes csoportok esetében. A lé-specifikus epigenetikus aláírást gazdagították a veleszületett és adaptív immunrendszer-gének esetében, pontosabban transzformáló növekedési faktor (TGF) -β, vaszkuláris endoteliális növekedési faktor (VEGF), toll-szerű receptor (TLR) 4 és nukleáris faktor kappa-könnyű lánc többek között az aktivált B sejtek (NFk-β) jelátviteli utak fokozója (S7. táblázat). A gyümölcslé-specifikus citokin jelátviteli gének közé tartozik a mieloid differenciálódás elsődleges válasza (MYD) 88, az interferon szabályozó faktor (IRF) 8 és az IRF4, amelyek immunspecifikus transzkripciós faktorok, amelyek szükségesek az immunsejt-folyamatokhoz, például a T-sejtek differenciálódásához a T-helperhez (Th) 2 és Th17 vagy a B-sejtek aktiválása (áttekintve: [46]). A gyümölcsfogyasztás széles körben összefüggésben áll a fokozott immunfunkcióval; ezek az adatok specifikus epigenetikusan szabályozott proinflammatorikus utakra utalnak, amelyek hozzájárulhatnak.
Ezzel ellentétben az immunrendszer génjei, amelyek a gyümölcsspecifikus epigenetikus aláírással társulnak, csak az adaptív immunrendszer útvonalaihoz, különösen az antigénfeldolgozás bemutatásához gazdagodtak. A gyümölcsspecifikus epigenetikus szignatúra közelében lévő citokin jelző gének közé tartozik az emberi leukocita antigén (HLA) -F és a HLA-DPB1, mindkettő az antigén bemutatásában és az immunsejtek aktiválásában részt vevő molekula. Ez összhangban van egy korábbi, idős embereknél végzett intervenciós vizsgálattal, ahol a gyümölcsfogyasztás fokozott antigén megjelenéssel járt [47]. Sőt, mindkét csoport gazdagabb volt az általános sejtciklus, a meiózis és a mitózis útvonalai szempontjából, de a gyümölcsspecifikus epigenetikus aláírás 17% -kal több génhez kapcsolódott ezeken az utakon, mint a lé-specifikus epigenetikus aláírás (75, illetve 62 gén, ill. 62). A további gyümölcsspecifikus utak magukban foglalják azokat, amelyek részt vesznek a sejtciklus szabályozásában és a kromoszóma vagy telomer fenntartásában, amelyek fontosak az immunrendszer egészséges növekedésének és öregedésének elősegítésében (S7. És S8. Táblázat) [48,49]. Ezek az adatok együttesen azt jelzik, hogy a gyümölcs- és gyümölcsléfogyasztáshoz kapcsolódó epigenetikai módosítások befolyásolhatják az immunrendszer működésének különböző területeit.
3.3. Gyümölcs és gyümölcslé epigenetikus aláírások IPA a megosztott gének közelében
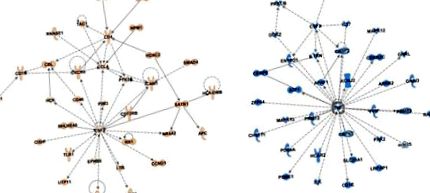
A WBC-k DNS-metilációs profiljai a limfociták készletéből származnak. Az olyan epigenetikusan társult utak felderítése érdekében, amelyek specifikus limfocita populációkat vonhatnak maguk után, IPA-hálózat elemzéseket végeztünk, hogy azonosítsuk azokat a specifikus fehérje-fehérje kölcsönhatású hálózatokat, amelyek a gyümölcs- és gyümölcslé-specifikus epigenetikus aláírások közelében gazdagodnak a gének számára. A gyümölcsspecifikus elemzés két szignifikáns fehérje – fehérje interakciós hálózatot eredményezett (2. A ábra; S4A ábra; a hálózat mind a kettőnél 38 pontot kapott). Az egyik hálózat a kolóniastimuláló faktor (CSF) 2, a kemokin ligandum (CCL) 4 és a 4 differenciálódási klaszter (CD 2 A) körül helyezkedik el, a makrofágok vonzásához, proliferációjához és aktiválásához kapcsolódó összes molekula körül [50,51] . Ez összhangban van az antigénprezentációs folyamatok fenti GSEA-dúsításával, és arra utal, hogy a makrofág-közvetített antigén-megjelenést befolyásolhatják a gyümölcsspecifikus epigenetikus aláírások.
Az ötletességi út elemzése fehérje-fehérje interakciós hálózatok, amelyek olyan génekből származnak, amelyek 5 kb-os körzetben vannak az alacsony P-értékű CpG-helytől (P 2. B ábra; S4B ábra; hálózati pontszám 38-nál). Az első hálózat (2. B ábra) a tumor nekrózis faktor (TNF) α, amely egy fő proinflammatorikus citokin, amely a veleszületett immunrendszer akut gyulladásos reakcióit közvetíti, és a CSF3, egy molekula, amely stimulálja a csontvelőben a granulocita termelést és felszabadul a véráramba [ 52]. A második a MYD88, IRF8, IRF4 és a DNS-kötődés (ID) 3 inhibitora, az immunsejt-folyamatokhoz szükséges immunspecifikus transzkripciós faktorok, például a T-sejt Th2 és Th17-re történő differenciálódása vagy a B-sejtek aktiválása középpontjában áll [53] (áttekintve: 46]), valamint a CC motívum kemokinreceptor (CCR) 7 egy molekula, amely a Th1 sejtek differenciálódásához és toleranciájához kapcsolódik [54]. Ezek az adatok egybevágnak a GSEA elemzéseivel, amelyek feltételezik a veleszületett és adaptív immunút társulását a lé epigenetikus aláírásával. Az IPA-elemzések együttesen további információkat nyújtanak a gyümölcs- vagy gyümölcslé-specifikus epigenetikusan társított sejtjelátviteli utakról, amelyek révén az immunotolerancia (gyümölcs) vagy a gyulladásos folyamatok (gyümölcslé) befolyásolhatók.
3.4. DHS gazdagító elemzés
A gyümölcslével és a gyümölcsspecifikus epigenetikus aláírásokkal társuló immunsejtpopulációk ismeretének bővítése érdekében az eFORGE online program segítségével az immunrendszer gazdagítása érdekében az immunsejt-specifikus immunsejteket átkutattuk a specifikus immunsejt-populációkból származó genom egész DNS-t meghaladó túlérzékenységi helyein [44]. A gyümölcsspecifikus epigenetikus aláírás (N = 739 CpG helyek; P-6, 9,17 × 10-6, 0,0018, 4,65 × 10-4; S5B ábra). Ez összhangban áll az IPA elemzésekkel, amelyek kiemelik a B és T sejtek differenciálódásával és aktiválásával járó sejtjelzési útvonalak gazdagodását. A hatás irányának értékeléséhez, vagyis hogy a megnövekedett léfogyasztás korrelál-e a csökkent CpG-hely metilációs szintjeivel (negatívan korrelál) vagy a megnövekedett metilációs szinttel (pozitív korreláció), a CpG helyeket P-4-gyel és NK-val (P = 5,63 × 10 −5) sejt DHS (S5F ábra), ami arra utal, hogy a megnövekedett léfogyasztás csökkentheti a globális DNS-metilációs szintet a specifikus primer immunsejtpopulációk, különösen a T- és NK-sejtek szabályozó régióinak DHS-jén belül.
Annak érdekében, hogy jobban megértsük, milyen útvonalakat befolyásolhatnak a fenti helyek a B és T sejtekben, IPA fehérje – fehérje interakciós hálózat elemzést végeztünk az alacsony P-értékű CpG-helyek közelében lévő gének számára dúsított specifikus utak azonosítására, amelyeknél kevesebb metiláció volt megnövekedett gyümölcsléfogyasztással. Ez az elemzés két hálózatot hozott létre. Az egyik hálózat a TNF-re (S6. Ábra; hálózati pontszám = 43), egy fő proinflammatorikus molekulára, míg a második az ID3-ra, a fehérjetirozin-foszfatázra, a 6-os típusú receptor nélküli receptorra (PTPN6) és a CCR7-re (hálózati pontszám = 43), a vérképző sejtek differenciálódásában részt vevő molekulák [55] és a tolerancia [54,56]. A promóter régiókban a csökkent metiláció gyakran társul a megnövekedett génexpresszióval, ezért a megnövekedett gyümölcslé bevitel mellett a promóter metilációjának megfigyelt csökkenése fokozhatja az NK vagy T sejt aktiválásakor bekövetkező jelátvitelt. Érdekes módon az NK-sejtek megnövekedett lítikus aktivitása összefüggésbe hozható a megnövekedett gyümölcslé-fogyasztással [57]. Összességében ez azt sugallja, hogy a lé-specifikus epigenetikus aláírások elősegíthetik az immunválasz fokozását az aktivált NK- és T-sejtek között, amelyek egy részhalmaza támogatja a fokozott sejtdifferenciálódást és az immunotoleranciát is.
4. Megbeszélés
A vizsgálatunk során megfigyelt epigenetikai különbségek a gyümölcs és a gyümölcslé közötti gyümölcsrost-tartalom változásának tulajdoníthatók. A rost, amely nagymértékben emészthetetlen molekula, megváltoztatja az együttfogyasztott tápanyagok emésztési sebességét, és ezáltal befolyásolja a bél elhelyezkedését és mechanizmusát, amely révén a gyümölcsből származó tápanyagok felszívódnak és végül feldolgozásra kerülnek (áttekintve [22]). A bélfelszívódás ezen változásának nagy része valószínűleg a tápanyagok bélmikrobiota általi lebontásának változása miatt következik be [21,60,61], amelyek összetétele a bélben változik. Ennek alátámasztására egy megfigyelési tanulmány kimutatta, hogy a gyümölcs- és zöldségfogyasztás gyulladáscsökkentő hatása magasabb volt azoknál az egyéneknél, akiknél magas a rostfogyasztás a gyümölcsökből és zöldségekből [62]. Ez arra utal, hogy azok az egyének, akik több gyümölcslevet fogyasztanak, részesülhetnek a gyümölcsrost további formáinak elfogyasztásában. Az okoktól függetlenül megfigyelési eredményeink indokolttá teszik a gyümölcs- és gyümölcslé-fogyasztás specifikus immunológiai előnyeinek további tanulmányozását.
Megfigyeljük a tanulmány korlátozásait. A megfigyelési vizsgálatok jellege miatt megállapításaink korrelatívak és nem következtethetnek az oksági összefüggésekre. Ezenkívül nem vonhatjuk le azt sem, hogy eredményeink egy része további ételeknek tudható be, amelyeket rendszeresen gyümölcs vagy gyümölcslé mellett fogyaszthatnak. A következtetéseink irodalmi támogatása alapján azonban úgy véljük, hogy ez nem valószínű.
Először bizonyítottuk, hogy a gyümölcslé és a gyümölcsfogyasztás összefüggésben van a globális epigenetikai variációkkal, és hogy ezek a nagyrészt független aláírások arra utalnak, hogy a gyümölcs- és gyümölcsléfogyasztás befolyásolja az immunsejtek különböző populációit és az immunfunkció különböző aspektusait, különös tekintettel az immunfelügyeletre és a gyulladás előtti út aktiválódására. Emellett elemzéseink új epigenetikusan szabályozott célmolekulákat és útvonalakat vonnak magukba, amelyek ezekhez a csoportokhoz kapcsolódnak, amelyek új betekintést engednek ezeknek az asszociációknak a mögöttes molekuláris mechanizmusaiba. Az első lépés annak megértése, hogy a táplálékbevitel hogyan járul hozzá a fiziológiai fenotípusokhoz, például az immunfunkcióhoz, a táplálkozás felhasználása felé az emberi egészség és végső soron a személyre szabott táplálkozás javítása érdekében.
Köszönetnyilvánítás
A Framingham szívvizsgálatot a Nemzeti Szív-, Tüdő- és Vérintézet (NHLBI) végzi és támogatja a Boston Egyetemmel (N01-HC-25195. Számú szerződés) együttműködve. Ez a kézirat nem a Framingham Heart Study kutatóival együttműködve készült, és nem feltétlenül tükrözi a Framingham Heart Study, a Boston University vagy az NHLBI véleményét vagy nézeteit. A Framingham adatok számítási elemzését az USANA Health Sciences finanszírozta.
- Gyümölcs előnyei egy pohár 100% -os OJ Florida narancslé Florida narancslé
- Sárgarépa almalé recept Teljesen természetes gyümölcs; Veggie Blend
- Gyümölcslé Tej Kefir Kombucha Home
- Gyümölcs turmixok görög joghurttal; Narancslé az anyagcsere felpörgetésére Az egészséges táplálkozás SF kapuja
- Gyümölcslé; Babaápolási tanácsok