A ketogén diéták, mint adjuváns rákterápia: Előzmények és lehetséges mechanizmusok
Absztrakt
A rákos sejtek a normál sejtekhez viszonyítva jelentős változásokat mutatnak az anyagcserében, amelyek a mitokondriális eredetű reaktív oxigénfajok (ROS), például az O2 • - és a H2O2, egyensúlyi állapotának növekedését eredményezik. Azt is felvetették, hogy a rákos sejtek fokozzák a glükóz és a hidroperoxid metabolizmusát, hogy kompenzálják a megnövekedett ROS-szintet. Tekintettel erre az elméleti konstrukcióra, ésszerű azt javasolni, hogy a rákos sejtek arra kényszerítése, hogy mitokondriális oxidatív anyagcserét alkalmazzanak ketogén diéták táplálásával, amelyekben magas a zsírtartalom, valamint alacsony a glükóz és más szénhidrátok tartalma, szelektíven okozna metabolikus oxidatív stresszt a rákban, szemben a normál sejtekkel. A rákos sejtekben megnövekedett metabolikus oxidatív stressz várhatóan szelektíven érzékenyíti a rákos sejteket a hagyományos sugárzásokra és kemoterápiákra. Ez az áttekintés összefoglalja azokat a bizonyítékokat, amelyek alátámasztják azt a hipotézist, hogy a ketogén diéták biztonságosan alkalmazhatók a hagyományos sugárterápiák és kemoterápiák adjuváns terápiájaként, és megvitatja azokat a javasolt mechanizmusokat, amelyek révén a ketogén diéták fokozhatják a rákos sejtek terápiás válaszait.
Bevezetés
Mi a ketogén étrend?
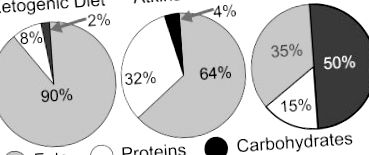
A ketogén étrend, az Atkins-diéta és az amerikai étrend kalóriatartalmának összehasonlítása. Egy adott napon az amerikaiak átlagosan 265 g szénhidrátot (az összes kalória 50% -át), 78,3 g teljes zsírt (az összes kalória 35% -át) és 78,1 g fehérjét (az összes kalória 15% -át) fogyasztanak. Az összes kalória százalékának felhasználásával ezek az értékek összhangban vannak az Egyesült Államok Mezőgazdasági Minisztériumának 2010-es aktuális ajánlásaival, amelyek az összes kalória 45–65% -át szénhidrátból, az összes kalória 20–35% -át zsírból és az összes kalória 10–15% -át írják elő. fehérjéből (80).
Amikor az egyén ketogén étrendet fogyaszt, a zsíranyagcsere a zsírsavak máj általi oxidációja révén megy végbe, így a keton testek képződnek, beleértve az acetoacetátot, a β-hidroxi-butirátot és az acetont. A ketonok a vérben a szövetekbe kerülnek, ahol acetil-CoA-vá alakulnak, amely szubsztrát a citromsavciklus első lépésében. A ketogén étrend alacsony szénhidráttartalma a vércukorszint mérsékelt csökkenését és összességében nagyobb glikémiás kontrollt eredményezhet, ami alacsonyabb hemoglobin A1C-szintet eredményez [18]. Ez a kezelés stimulálhatja az emberek glükoneogenezisét is, kompenzálva a vércukorszint csökkenését [19]. A ketogén étrend betartását és hatékonyságát a szérum és a vizelet β-hidroxi-butirátjának mérésével lehet ellenőrizni [20].
A ketogén étrendek, mint betegségterápia felfedezése
Hippokratész óta az elhúzódó koplalási periódusokat rögzítették az epilepszia terápiás eszközeként [21]. A 20. század elején az orvosi szakirodalom több olyan esetről is beszámol, amelyek szerint a különböző betegségekben, köztük az epilepsziában szenvedő betegek számára előnyös volt a rövid, 2-3 hetes böjt, és ezek a tanulmányok a böjt sikerét dehidrációnak, ketózisnak vagy acidózisnak tulajdonították [21]. 1921-ben Dr. R.M. Wilder a Mayo Klinikán olyan étrendet javasolt, amelyben a kalóriák legnagyobb része zsírból származik, utánozva az éhgyomri biokémiai változásokat az epilepszia kezelésére. Erre az étrendi összetételre találta ki a ketogén diéta kifejezést [21]. Az 1950-es években olyan biztonságos és hatékony görcsoldó gyógyszerek kifejlesztésével, mint a fenitoin és a nátrium-valproát, a ketogén étrend iránti érdeklődés elapadt, de a terápiát még mindig alkalmazták olyan esetekben, amikor a betegség tünetei nem voltak hatékonyak más gyógyszeres terápiákkal szemben.
A klinikai tapasztalatok alapján a ketogén étrend az 1990-es évek közepén kezdett újra megjelenni, mint frontális és elfogadható alternatíva olyan gyermekkori epilepsziás betegeknél, akik nem reagáltak más görcsoldó gyógyszeres terápiára. A University College London nemrégiben végzett, randomizált, kontrollált vizsgálata egyértelműen megmutatta a ketogén étrend előnyét a gyermekkori rohamok kezelésében. A diétás csoport 54 betegének végső elemzésében 61% -uk tapasztalta a rohamok jelentős csökkenését, szemben a kontroll csoportban szenvedő betegek 8% -ával [22]. Ezenkívül a diéta körülbelül 6 hónapos fogyasztása után nem volt bizonyíték a gyermekkori megismerésre vagy a társadalmi alkalmazkodásra gyakorolt jelentős káros hatásokra [23].
A ketogén étrend klinikai alkalmazásai
A ketogén étrend epilepszia kezelésében történő alkalmazásának biztonságosságának és hatékonyságának fokozott ismerete ennek az étrendi beavatkozásnak a sikeres alkalmazását eredményezte más rendellenességek esetén. A ketogén étrend legnevezetesebb és legjobban tanulmányozott alkalmazása az elhízás kezelésére szolgál, amelyet Dr. Robert Atkins népszerűsített (lásd 1. ábra) (Dr. Atkins Diet Revolution 1972). A ketogén étrend szintén hasznosnak bizonyult a glükóz transzporter hibás és más veleszületett anyagcserezavarokban szenvedő betegek kezelésében [24]. A beszámolók szerint a diéta ígéretesnek bizonyul az amiotróf laterális szklerózis progressziójának lassításában [25], és egyre több bizonyíték áll rendelkezésre arra vonatkozóan, hogy a ketogén étrend más neurodegeneratív betegségek esetén is hasznos lehet, beleértve az Alzheimer-kórt és a Parkinson-kórt [26]. Ezen kívül vannak esettanulmányok és kis esettanulmányok, amelyek autizmus [27] depresszióban [28], policisztás petefészek szindrómában [29] és 2-es típusú diabetes mellitusban szenvedő betegek javulását mutatják [18].
Ketogén étrendek a rákterápiában
A közelmúltban a ketogén étrendeket a rákterápia segédanyagaként tanulmányozták mind állatmodellekben, mind emberi esetekről. Már 1987-ben Tisdale és mtsai. ketogén étrendet fogyasztó vastagbél adenokarcinóma xenograftokkal rendelkező egerekben csökkent a tumor súlya és javult a cachexia [30]. További vizsgálatok kimutatták, hogy a ketogén étrend csökkenti a tumor növekedését és javítja a túlélést a malignus glioma [31–33], a vastagbélrák [34], a gyomorrák [35] és a prosztatarák [36–38] állatmodelljeiben. Ezenkívül ketogén étrendet feltételeztek, néhány alátámasztó bizonyítékkal, hogy erősítsék a sugárzás hatásait rosszindulatú glioma modellekben [39], valamint nem kissejtes tüdőrák modellekben [5]. Kimutatták, hogy a böjt, amely a ketózis állapotát is előidézi, fokozza a kemoterápiára való reagálást a preklinikai rákterápiás modellekben, valamint javítja a kemoterápiával tapasztalt normális szöveti mellékhatások egy részét [40]. Az éhezési ciklusokról azt is beszámoltak, hogy késlelteti a daganatok növekedését és érzékenyíti a rákos sejtek egy sorát a kemoterápiára [40,41].
A klinikai eredmények egy része esettanulmányt tartalmaz két női gyermekről, előrehaladott stádiumú malignus asztrocitómáról, akik 21,8% -os csökkenést mutattak a tumor SUV-ben, amikor ketogén diétával táplálták ezeket a betegeket, a 2-dezoxi-2 felvétele alapján [18F ] fluor-d-glükóz (FDG) pozitron emissziós tomográfia (PET) alkalmazásával [42]. Egy újabb esettanulmány javulást mutatott egy 65 éves, glioblastoma multiformában szenvedő nőbetegben, akit korlátozott kalóriatartalmú ketogén étrenddel, standard kezeléssel együtt [43]. Fontos, hogy az életminőség-vizsgálat előrehaladott rákos betegeknél azt találta, hogy a ketogén étrendnek nincsenek súlyos káros hatásai, javult az érzelmi működése és csökkent az álmatlansága [44].
A ketogén étrend javasolt hatásmechanizmusa rákban
Mitokondriális anyagcsere és rák
A normális sejt- és tumorsejt-anyagcsere összehasonlítása amerikai étrenden és ketogén étrenden. A normál sejtekhez képest feltételezzük, hogy a tumorsejtek megnövekedett mitokondriális DNS-mutációkkal, valamint változásokkal járnak a nukleárisan kódolt mitokondriális fehérjék expressziójában, ami a mitokondriális légzés során fokozza a reaktív oxigénfajok (ROS) termelését. A megnövekedett tumorsejt-ROS növeli a tumorsejt-függőséget a glükóz metabolizmustól, aminek következtében NADPH és piruvát keletkezik a pentóz-foszfát sönt és a glikolízisből származó piruvát révén. A NADPH és a piruvát redukálja a hidroperoxidokat. A ketogén étrend csökkenti a daganatos sejtek NADPH-termelő képességét, mivel a legtöbb szövetben a zsíranyagcsere nem képes glükoneogenezisen átmenni, hogy glükóz-6-foszfátot (G-6-P) képezzen, amely szükséges a pentóz-foszfát söntbe jutáshoz. Így a ketogén étrendnek tovább kell növelnie a tumorsejtek oxidatív stresszét a normál sejtekhez viszonyítva, korlátozva a NADPH regenerálódását.
A rákos sejtek glükózfüggősége
A glikolízis közvetíti a glükóz enzimatikus bomlását piruváttá, amely oxigén jelenlétében acetil-CoA-vá alakul és a mitokondriumban a citromsav-ciklusba kerül. Oxigén hiányában a piruvát alternatív módon laktáttá alakul. A normál sejtek összekapcsolják a piruvát termelést a mitokondriális légzéssel, hogy oxidatív foszforilezés útján hatékonyan előállítsák az ATP-t, és általában alacsony szintű glikolízist, valamint laktáttermelést mutatnak. A normál sejtekkel ellentétben a rákos sejtek még oxigén jelenlétében is megnövekedett glükózfogyasztást mutatnak [1], ami feltehetően a hibás mitokondriális légzés miatt következik be, amely kompenzációs válaszként fokozott glikolízist igényel.
Az elmúlt 60 évben számos állatkísérlet nemcsak megerősítette a megnövekedett glükózfogyasztás megfigyelését a rákos sejtekben, hanem a glükóz fontosságát a tumor túlélésében és az áttétekben is. Az energiatermelő szubsztrátok fluxusa a vastagbélrákban kimutatta, hogy a rosszindulatú daganatok nettó glükózfelvétele és laktátfelszabadulása 30, illetve 43-szorosan meghaladja a perifériás nem rosszindulatú árfolyamokat, miközben a tumor és a perifériás szövetek között nem volt szignifikáns különbség zsírsav- vagy ketonegyensúlyban. Az FDG PET meggyőzően bizonyítja, hogy a legtöbb emberi karcinómában megnő a glükózigény a környező normál szövethez képest [58].
A kóros aerob glikolízis mellett a rákos sejtek fokozott pentóz-foszfát út aktivitást mutatnak [3,59]. A pentóz-foszfát út oxidálja a glükózt, így két molekula a redukáló ekvivalens nikotinamid-adenin-dinukleotid-foszfát (NADPH) és a ribóz-5-foszfát. A NADPH a glutation/glutation peroxidáz rendszer, valamint a tioredoxin/tioredoxin peroxidáz rendszer kofaktorként működik [60]. Ezek a tiol rendszerek felelősek a H2O2 és a szerves peroxidok méregtelenítéséért, ezáltal fenntartva a redox egyensúlyt az oxidatív károsodások megelőzésével és helyreállításával.
A glükóz metabolizmusáról ismert, hogy nagy szerepe van a peroxidok méregtelenítésében, mind a piruvát képződése révén (amely közvetlenül dezacetilezési reakció révén vonja el a peroxidokat), mind pedig a redox kofaktor NADPH regenerálásán keresztül. Korábbi tanulmányok kimutatták, hogy a glükózmegvonás szelektíven oxidatív stresszt és toxicitást okoz az emberi rákos sejtekben a normál sejtekhez képest, ami megfordul a szuperoxid és peroxid eltávolítók hozzáadásával [2,3]. Ezenkívül számos in vitro és in vivo vizsgálat sikeresen megvizsgálta a glikolitikus inhibitorok alkalmazását a szelektív rákos sejtek toxicitásának előidézésére metabolikus oxidatív stresszt magában foglaló mechanizmus révén [3,7,61–65].
A ketogén étrend növeli a rákos sejtek oxidatív stresszét
A ketogén étrend lehetséges kockázatai
A ketogén étrendről kiderült, hogy hatékony a görcsrohamok kezelésében és a súlycsökkenés kiváltásában, de feltehetően néhány lehetséges mellékhatást okoznak. A magas zsírfogyasztás akut mellékhatásai jellemzően letargia, hányinger és hányás az étrend intoleranciája miatt, különösen gyermekeknél [70] (3. ábra). A gyermekek hajlamosak a hipoglikémiára az alacsony glükózbevitel és hányinger miatt [70]. Ezzel szemben a gyomor-bélrendszeri kényelmetlenség a felnőtteknél gyakori mellékhatás a diéta magas zsírtartalma miatt [71]. A ketogén diétákkal kapcsolatos prospektív kísérleti tanulmány a betegek koleszterinszintjének jelentős és progresszív növekedéséről számolt be 1 év után [72]. Korábbi tanulmányok arról is beszámoltak, hogy a ketogén étrendet folytató betegek szérumszintjeiben hiányosságok mutatkoznak az ásványi anyagokban, például a szelénben, a rézben és a cinkben, ami arra utal, hogy az étrend alatt megfelelő nyomelemek pótlása szükséges [73].
A ketogén étrendhez kapcsolódó lehetséges akut és krónikus mellékhatások.
Bár a ketogén étrend hosszú távú fogyasztása során nem számoltak be súlyos káros változásokról, a nitrogénes salakanyagok kiválasztódása miatti vesekárosodás szintén lehetséges mellékhatás [74]. Míg egyetlen tanulmány sem számolt be a ketogén étrend használatával kapcsolatos abszolút vesekárosodásról, a kezelhetetlen epilepsziában szenvedő gyermekeket érintő esetek 6% -a számolt be vesekövek jelenlétéről a ketogén étrend 1–5 évig történő elfogyasztása után [75,76]. A legtöbb olyan vizsgálatot, amely a ketogén étrend káros hatásait vizsgálja, olyan epilepsziás gyermekeknél végezték, akiknek az étrendjük fogyasztása 1-6 éven keresztül elhúzódott. A gyermekeknél jelentett legtöbb káros hatás csak azoknál a betegeknél jelentkezik, akik több mint 1 évig tartják a ketogén étrendet, beleértve a hipertrigliceridémiát, a növekedés csökkenését (az inzulinszerű növekedési faktor – 1 csökkent szintje) és a csont ásványianyag-tartalmának progresszív csökkenését. Ezenkívül a ketogén étrend legsúlyosabb káros hatásai megelőzhetők vagy korrigálhatók megfelelő intézkedésekkel, például vitamin-kiegészítőkkel, a csontfunkció felmérésével és orális kálium-citrát alkalmazásával a vesekő kockázatának csökkentésére [76,77].
Ezzel szemben a felnőttek ketogén étrendjének vizsgálata egyre kevesebb és kisebb mértékű káros hatást mutat. Az alacsony szénhidráttartalmú ketogén étrendet vizsgáló felnőttek 6 hónapos tanulmányában az egyetlen észlelt káros hatás az alacsony sűrűségű lipoprotein (LDL) koleszterinszint növekedése, remegés és nyugtalanság volt [78]. Egy másik vizsgálatban az 1 éven át ketogén étrendet folytató 72 felnőtt beteg közül csak 3-nak volt káros hatása, kettőnél emelkedett LDL-koleszterinszint és egynél vesekő alakult ki [79]. A ketogén étrendhez kapcsolódó másik várható változás az emelkedett vér ketonszint. Ez aggodalomra ad okot olyan cukorbetegeknél, akiknél nagyobb a kockázata a ketoacidózis kialakulásának, amely potenciálisan életveszélyes állapot. A ketogén étrend használatának eredményeként a vér ketonszintje a legtöbb felnőtt betegben szerény, és nem jár magas vércukorszinttel, ezért alacsony a ketoacidózis kockázata.
Klinikai vizsgálatok a ketogén étrend alkalmazásával a rák kezelésében
Jelenleg 62 vizsgálatban értékelik az alacsony szénhidráttartalmú étrendet mint különféle betegségek lehetséges terápiáját, amelyek közül 11 vizsgálat a ketogén étrendet adjuváns rákterápiának értékeli. A németországi Würzburgi Egyetemen azokat a betegeket vonták be a ketogén étrendet magában foglaló kísérletekbe, akiknek a hagyományos rákterápiája kudarcot vallott és más mentési lehetőségek nélkül. Az előzetes jelentések azt mutatják, hogy azok a betegek, akik több mint 3 hónapig folytathatták a ketogén diétaterápiát, stabil fizikai állapot mellett javulást mutattak, daganat zsugorodott vagy lassult a növekedés [44].
A németországi Tübingeni Egyetemi Kórházban Dr. Johannes Rieger és Dr. J. Steinbachand végeztek egy 1. fázisú ERGO vizsgálatot, amelynek célja annak meghatározása, hogy az enyhe ketogén diéta befolyásolhatja-e a glutamino visszatérő glioblasztómában szenvedő betegek életminőségét és túlélését. Súlyos nemkívánatos eseményeket nem jelentettek (http://ClinicalTrials.gov/show/> NCT00575146).
Az iowai egyetemen három, az első fázisban végzett vizsgálat folyik, amely a ketogén diéta tolerálhatóságát értékeli kemoterápiával és sugárterápiával kombinálva, lokálisan előrehaladott hasnyálmirigy, tüdőrák, valamint fej- és nyakrák esetében (http://ClinicalTrials.gov ). A tipikus sémát a 4. ábra mutatja a. Miközben a szokásos ellátási sugárzást és kemoterápiát kapják, a betegek ketogén étrendet fogyasztanak 5 hétig; A szérum glükóz- és ketonszinteket naponta értékeljük heti oxidatív stressz markerekkel kombinálva. A ketogén étrend mintáját a 4b. Ábra szemlélteti .
Következtetések
A kemo-sugárzás közelmúltbeli fejlődése ellenére a rákos betegek prognózisa továbbra is gyenge, és a legtöbb jelenlegi kezelést súlyos nemkívánatos események korlátozzák. Ezért nagy szükség van olyan kiegészítő megközelítésekre, amelyeknek korlátozott a beteg toxicitása, miközben szelektíven fokozzák a rákos terápiás reakciókat a normál szövetekkel szemben. A ketogén étrend potenciális étrendi manipulációt jelenthet, amelyet gyorsan megvalósíthatnak a rákos sejtek és a normál sejtek közötti eredendő oxidatív metabolikus különbségek kiaknázása céljából, a standard terápiás eredmények javítása érdekében, a szelektíven fokozva a metabolikus oxidatív stresszt a rákos sejtekben.
Bár a ketogén étrend szokásos rádió-kemoterápiákkal kombinálva nem teljesen tisztázott mechanizmus, a preklinikai eredmények azt bizonyították, hogy a ketogén étrend rádió-kemoterápiával kombinálva biztonságosan és potenciálisan hatékonyan alkalmazható a reakciók javítására. egérrák modellek. Ezek a preklinikai vizsgálatok lendületet adtak a ketogén étrend használatának kiterjesztésére a jelenleg folyamatban lévő I. fázisú klinikai vizsgálatokra.
Összeférhetetlenség
A szerzők kijelentik, hogy nincsenek összeférhetetlenségük.
Köszönetnyilvánítás
A szerzők köszönetet szeretnének mondani a KetoCal gyártóinak, hogy 4: 1 arányú étrend-készítményt nyújtottak a folyamatban lévő preklinikai és klinikai vizsgálatokhoz. Ezt a munkát részben támogatta a Carver Redox Biológia és Orvostudomány Kiválósági Kutatási Programja (R01CA133114, R21CA161182, R01182804-01, R21CA139182, P30CA086862 és UL1TR000442), az RSNA Kutatási és Oktatási Alapítvány RR1020 támogatása, valamint egy nagylelkű ajándék. Mrs. Nellie K. Spitz, Mrs. Marie Foster és az IBM Corporation.
- Ketogén étrend a rákterápiában
- Ketogén diéták és a rák kialakulásának bizonyítékai
- Keto a rák Ketogén metabolikus terápiájához, mint célzott táplálkozási stratégiához, Miriam Kalamian
- A rákhoz kapcsolódó magas fehérjetartalmú étrend, ha aggódna
- Magas fehérjetartalmú étrend és rákkockázat