Ketogén diéták és rák: új bizonyítékok
Absztrakt
A ketogén étrend kombinációja a szokásos kemoterápiás és sugárterápiás lehetőségekkel segíthet javítani a daganat válaszát, bár további kutatásokra van szükség.
500 bc-nél a böjtöt számos orvosi betegség hatékony kezelésére használták. A böjt a modern időkben folytatódott, és 1910-ben Guelpa és Marie böjtöt javasoltak epilepszia elleni kezelésként. 1921-ben Woodyatt megjegyezte, hogy éhezés vagy magas zsírtartalmú, alacsony szénhidráttartalmú étrend alkalmazása olyan betegeknél, akiknek nincsenek szignifikáns orvosi társbetegségei, acetont és β-hidroxi-butirátot eredményeztek, 2 olyan energiaforrást, amelyet a máj glükóz hiányában termelt. Az alacsony szénhidráttartalmú, magas zsírtartalmú étrendről azt gondolták, hogy az éhezés vagy az éhezés alternatívája, és sok ugyanolyan kívánt hatást vált ki, miközben továbbra is táplálja az egészséges sejteket. A ketogén étrend (KD) kifejezést később Wilder és Peterman alkotta meg, és megfogalmazták a ma is alkalmazott zsír/szénhidrát arányt: 1 g fehérje testtömeg-kilogrammonként gyermekeknél és 10-15 g szénhidrát naponta, valamint zsír a fennmaradó kalóriákhoz. Mindkét kutató arról számolt be, hogy ez a diéta javította pácienseik mentáltságát és megismerését.1
A KD alkalmazása a rákterápia adjuvánsként szintén kezdett megjelenni. 1922-ben Braunstein megjegyezte, hogy a cukorbetegek vizeletéből a glükóz eltűnt a rák diagnosztizálása után, ami arra utal, hogy a glükózt olyan rákos területekre toborozzák, ahol a normálnál magasabb arányban fogyasztják. Ez alatt az idő alatt a Nobel-díjas Otto Warburg megállapította, hogy a rákos sejtek a glikolízis során jól fejlődnek, magas laktátszintet produkálva még bőséges oxigén jelenlétében is. Warburg számos in vitro és állatkísérletet végzett ennek az eredménynek a bemutatására, amelyet Warburg-néven ismernek.
A 20. század közepére a KD alkalmazása az epilepszia kezelésében és a rákkutatásban lecsökkent. Az 1990-es évek közepén-végén, a Charlie Alapítvány létrehozásával azonban az étrend lassan visszanyerte elismerését. 1 Számos in vitro és állatkísérlet eredményéről számoltak be, és emberi adatok is elkezdtek halmozódni.
A HATÁS MECHANIZMUSAI
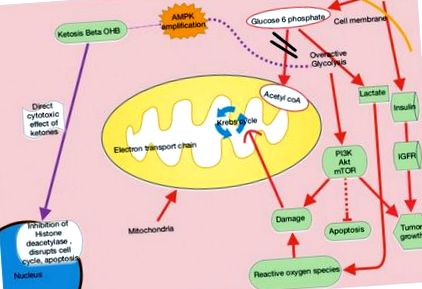
A glükóz általában stimulálja a hasnyálmirigy β sejtjeinek inzulin felszabadulását, ami lehetővé teszi a glükóz bejutását a sejtekbe és energiát szolgáltat. Magas szénhidrát- és glükózbevitel mellett a hasnyálmirigy egyre több inzulint választ ki, ami elősegíti a növekedési hormon receptorok és a növekedési hormonok kölcsönhatását az inzulinszerű 1-es növekedési faktor (IGF-1) előállításához a májban - elősegítve a sejtek növekedését és proliferációját, ami káros lehet a rákos betegek számára. Az 1. és 3. glükóz transzporterek (Glut-1, Glut-3) túlzott expressziója sok rákban is előfordul, és megfelel az agresszív daganatok glükózfelvételének mértékének, amint azt a pozitronemissziós tomográfia (PET) mutatja. 2 A hexokináz túlzott expressziója, a sebesség - korlátozza a glikolízis enzimet, tovább ösztönzi a piruvát és a laktát termelését, amelyek reaktív oxigénfajok károsodását okozzák. A hexokináz sebességet korlátozó enzim transzlációja a citoszolból a külső mitokondriális membránba, ahol kölcsönhatásba lép a feszültségfüggő anioncsatornákkal, megzavarhatja a kaszpázfüggő citokróm felszabadulást, ami elnyomja a rákos sejtek apoptotikus útjait, és ellenállóbbá teszi a rákot a kemoterápiával szemben. .3
Ha a glükóz kevés, a test felismeri, hogy alternatív energiaformát kell készíteni a sejtek számára. Ezután a máj ketonokat és zsírsavakat termel, amelyek normális sejteket biztosítanak, de nem előnyösek a rákos sejtek számára. A rákos sejtek diszfunkcionális mitokondriumokkal és esetleg elektrontranszport-lánc hibákkal rendelkeznek, amelyek megzavarják a mitokondrium normális adenozin-trifoszfát (ATP) termelését. Ennek eredményeként a rákos sejtek nagymértékben függenek a glikolízis kevésbé hatékony folyamatából származó ATP-től (1. ábra).
Ketogén diéta anyagcsere útjai
A ketogén étrendek utánozzák az éhgyomri állapotot, amikor a test a glükózhiányra reagálva ketonokat termel energia céljából. A Warburg-hatás részét képező felesleges laktáttermelés kompenzálja a diszfunkcionális mitokondriális oxidatív foszforiláció okozta ATP-termelési hibákat.2,4 Az ebből eredő tumor glükózfüggősége kihasználható KD alkalmazással. A ketogén diéták szelektíven éheztetik a daganatot, biztosítva azokat a zsírokat és fehérjéket, amelyeket egyébként a glükózfüggő tumorsejtek nem tudnának felhasználni.
KD-kben a magas zsírtartalom és az alacsony szénhidráttartalom 4: 1 aránya utánozza az éhezés metabolikus hatásait (2. ábra). Ezek az étrendek lassítják a rákot az inzulin/IGF és az intracelluláris jelátviteli utak, például a foszfoinozidid-3-kináz (PI3K)/protein-kináz B (Akt)/a rapamicin emlős célpontja (mTOR) gátlásával. A ketogén diéták emellett felerősítik az adenozin-monofoszfát-aktivált protein-kinázt (AMPK), amely gátolja az aerob glikolízist, és elnyomja a tumor proliferációját, az inváziót és a migrációt. A metasztatikus rák egérmodelljei azt mutatják, hogy maguk az exogén ketonok közvetlen citotoxikus hatást gyakorolnak a tumor életképességére. 5 β-hidroxi-butirát módosíthatja a kromatint a hiszton-dezacetilázhoz való kötődéssel és ezáltal gátlásával, végül elnyomva a transzkripciót és megfékezve a rákos sejtek proliferációját (1. ábra).
A ketogén diéták makroelem-összetétele
KETOGÉNIAI ÉTLET ELŐNYÖK
Aggodalomra ad okot a fehérje biztosítása a veseproblémák kockázatának kitett betegek számára. A diabéteszes nephropathia egérmodelljei azonban javított vesefunkciót mutattak a KD alkalmazásával. A hipotézis az volt, hogy a KD használata, amely hosszan tartó emelkedett 3-β-hidroxi-vajsavszintet eredményez, szintén csökkenti a glükózra adott molekuláris reakciókat, és következésképpen csökkenti a vesekárosodást.6 Az étrend használata a fiatal és felnőtt patkányokban egyaránt csökkentette a fájdalmat és a gyulladást. Úgy gondolták, hogy a hatásmechanizmusok csökkentik a reaktív oxigénfajtákat és megnövelik a központi adenozinszintet
KÁROS HATÁSOK
A fogyókúra a további súlycsökkenés miatt aggódó rákos betegek számára aggasztó. A szokásos étrend túlnyomórészt szénhidrátokból áll, és magas a kalóriatartalma (3. ábra). Beck és Tisdale a vastagbél karcinóma egérmodelljeiben a KD alkalmazásának a késleltetett cachexia hatását vizsgálták. Megállapították, hogy a fogyókúra hatékonyabb volt, mint az inzulin a fogyás visszafordításában, és további hatással volt a daganat méretének csökkentésére. Ezenkívül Tisdale és munkatársai úgy találták, hogy a kachektikus rákos betegeknél a KD alkalmazása elősegítheti a súlygyarapodást.8
A módosított ketogén (Atkins) diéták makroelem-összetétele
Lehetséges magyarázat, hogy az egészséges szöveti táplálkozás szelektíven késlelteti a tumor növekedését, míg a rákos sejtek nélkülözik a táplálékot (szénhidrátok). A terápiás súlypontnak követnie kell a kezdeti súlyvesztést KD-vel, ellentétben a nem KD-s betegek kóros gyors fogyásával. 9 A vesekövek, a köszvény és a tüneti hipoglikémia szintén várható várható káros hatások (AE).
Esettanulmányok
JELENLEGI KUTATÁS
A normál egerekhez képest az alacsony szénhidráttartalmú étrenden elhelyezett, daganatot hordozó egerek glükóz-, inzulin- és tejsavszintje alacsonyabb volt.4 A fej- és nyakrákban szenvedő betegek in vivo mikrodialízissel végzett vizsgálatában a tejsavszint csökkenése volt megfigyelhető a daganat szöveteiben. egy 4 napos KD.13. A legtöbb korai tanulmány és esettanulmány a rákos megbetegedésekben az agydaganatokra összpontosított. ) vagy egyedi esettanulmányok (táblázat) .11,17–20
asztal
Alacsony szénhidráttartalmú pilóta biztonsági és tolerálhatósági kísérletei
TrialDiet DurationPatientsBeiratkozott, n beteg
Tolerált étrend, nKorai egészségi állapot miatt lemondó vagy diétázni nem tudó betegek, rossz egészségi állapot, korai halálozás, nstabil betegség, nProgresszív betegség, nPartial Response, nHatékony hatásokKommentárok
| TÖLTÉS: Finom és kollégái17 | 4 hét | 10 Mell Petefészek/petevezeték Vastagbél Tüdő Nyelőcső | 5. | 5. | 0 | 5 (4 hét) | 4 | 1 | Átlagos fogyás: 4,1% (P =, 45) Nincs káros hatás | Módosított Atkins-diéta: 20 szénhidrát g/d Korlátlan fehérje 2 csésze zöldség naponta A ketózis korrelált a pozitron emissziós tomográfia – számítógépes tomográfia standardizált felvételi értékével A stabil betegség korrelál a háromszoros ketózissal (P = 0,018) |
| ERGO: Rieger és munkatársai18 | A progresszióig | 20 Kiújult glioblasztóma | 17. | 3 Gyenge bevitel | 0 | 0 | 17. 1 kisebb válasz 2 stabil betegségben szenvedő beteg (6 hét) | Csak a megmentő kemoterápia után látható, sugárzással vagy anélkül. Összesen 8 beteg kapott megmentést 1 teljes válasz 5 részleges válasz | Átlagos súlycsökkenés: 2,2% (statisztikailag szignifikáns) 2 betegnél 3. fokú leukopenia volt Nincs más fokozat 3 káros hatás | 60 szénhidrát g/d Alacsony szénhidráttartalmú étrend és növényi olajok Korlátlan kalória Elsődleges végpont: a diéta% -os megszakítása Másodlagos végpontok: biztonság, a ketózis elérésének% -a, életminőség a 17 progresszív betegségben szenvedő beteg közül 8 mentő kemoterápián és étrenden változtatott, amelyek 5 részleges és 1 teljes választ eredményeztek Medián teljes túlélés diétával: 32 hét Medián progresszió nélküli túlélés: 5 hét |
| Wuerzburgi tanulmány: Schmidt és munkatársai19 | 5–12 hét | 16. Méh-petefészek Mell Fültő Sarcoma Hasnyálmirigy Pajzsmirigy Kettőspont Tüdő | 5 (12 hét) 2 (6 hét) 2 (7 hét) 2 (8 hét) 1 (5 hét) 1 (4 hét) 3 (2 hét) | 3 | 2 | 5. | 6. | 0 | Átlagos fogyás: az Atkins-diéta és az androgén-deprivációs terápia 2,9% -a (P> NCT00932672) prosztatarákban szenvedő betegeknél. Az izraeli Tel Aviv Sourasky Orvosi Központ korábban kezelt kemoradiációs betegeket toboroz magas fokú gliadaganatokban egy nyílt vizsgálatra (> NCT01092247) a KD hatékonyságának a daganatok növekedésének és megismétlődésének megakadályozásában történő vizsgálatára. A Szent József Kórház és Orvosi Központ (Phoenix, AZ) újonnan diagnosztizált glioblastoma betegeket toboroz egy 1/2 fázisú prospektív vizsgálatra (> NCT02046187), amely előzetes reszekciót, majd KD-t sugárterápiával és egyidejű temozolomiddal, majd adjuváns temozolomid kemoterápiával folytat. Az elsődleges végpont az AE-ben szenvedő betegek száma, a másodlagos végpontok a teljes túlélés, a progresszióig eltelt idő és a QOL. Az Iowai Egyetem prosztatarákban és nem kissejtes tüdőrákban szenvedő betegeket toboroz 2 első fázisú vizsgálatra (> NCT01419483 és> NCT01419587), KD bevonásával, Nutritia KetoCal 4: 1 alkalmazásával (Gaithersburg, MD). |
KÖVETKEZTETÉS
Esettanulmányokból és vizsgálatokból származó adatok azt sugallják, hogy a KD használata biztonságos és tolerálható a rákos betegek számára. Noha ideális lenne egy nagyobb kísérlet elvégzése randomizált terápiás megközelítéssel, a gyógyszeralapú vizsgálatok jelenlegi hangsúlya hatalmas akadályt jelent. További fő akadály a páciensek kezdeményezése és betartása. Egyelőre a nyomozóknak anekdotikus adatokkal kell dolgozniuk. A mitokondriumokban található génexpressziós minták, valamint a ketolitikus és glikolitikus enzimek mutációinak vizsgálata hasznos lehet a potenciálisan reagáló betegek kiválasztásában. Ennek az étrendi megközelítésnek a szokásos kemoterápiás és sugárterápiás lehetőségekkel való kombinálása segíthet javítani a daganatreakciót, és további kutatásokra van szükség.
A szokásos étrendek makroelem-összetétele
Lábjegyzetek
A szerző nyilvánosságra hozatala
A szerző nem számol be tényleges vagy potenciális összeférhetetlenségről a cikk kapcsán.
- A ketogén étrendek, mint adjuváns rákterápia Előzmények és lehetséges mechanizmusok
- A növekvő bizonyítékok alátámasztják a hús alapú étrendek marhahús magazinjának számos előnyét
- Magas fehérjetartalmú étrend és rákkockázat
- Magas fehérjetartalmú fogyókúrás étrendek és állítólagos káros hatások Hol vannak a bizonyítékok
- A rákhoz kapcsolódó magas fehérjetartalmú étrend, ha aggódna