A magnézium-sztearát, egy széles körben alkalmazott élelmiszer-adalékanyag, in vitro és in vivo genotoxikus potenciállal rendelkezik
Cheryl A. Hobbs
Toxikológiai program, Integrated Laboratory Systems, Inc., PO Box 13501, Research Triangle Park, NC 27709, USA
Kazuhiko Saigo
b Drogbiztonsági kutató laboratóriumok, Shin Nippon Biomedical Laboratories, Ltd., 2438 Miyanoura-cho, Kagoshima-City, Kagoshima 891-1394, Japán
Mihoko Koyanagi
c Globális tudományos és szabályozási ügyek, San-Ei Gen F.F.I., Inc., 1-1-11 Sanwa-cho, Toyonaka, Oszaka 561-8588, Japán
Shim-mo Hayashi
c Globális tudományos és szabályozási ügyek, San-Ei Gen F.F.I., Inc., 1-1-11 Sanwa-cho, Toyonaka, Oszaka 561-8588, Japán
Társított adatok
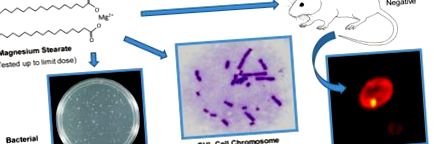
Grafikai absztrakt
Absztrakt
1. Bemutatkozás
A magnézium-sztearát a zsírsav, a sztearinsav magnéziumsója (1. ábra). Évtizedek óta széles körben használják az élelmiszeriparban emulgeálószerként, kötőanyagként és sűrítőanyagként, valamint csomósodásgátló, kenőanyagként, felszabadító és habzásgátló szerként. Számos étrend-kiegészítőben, cukrászdában, rágógumiban, gyógynövényekben és fűszerekben, valamint sütési összetevőkben van jelen. A magnézium-sztearátot általában inaktív összetevőként használják gyógyszerészeti tabletták, kapszulák és porok előállításánál is.
A magnézium-sztearát kémiai szerkezete. A magnézium-sztearát, más néven oktadekánsav, két sztearát-aniont és magnézium-kationt tartalmazó sóként létezik.
Élelmiszeripari alkalmazásokhoz a magnézium-sztearátot általában két eljárás egyikével állítják elő. A közvetlen vagy fúziós eljárás magában foglalja a zsírsavak közvetlen reakcióját magnéziumforrással, például magnézium-oxiddal, a zsírsavak magnéziumsóinak képződéséhez. Közvetett vagy kicsapási eljárás során nátrium-szappant állítanak elő zsírsavak vízben lévő nátrium-hidroxiddal történő reakciójával és a termék kicsapásával magnéziumsók hozzáadásával a szappanhoz. Az alapanyagként használt zsírsavak étkezési zsírokból és olajokból származnak, és főleg sztearinsavból és palmitinsavból állnak. A végtermék 4,0-5,0% magnéziumot tartalmaz, száraz anyagra számítva, és a zsírsav-frakció ≥90% sztearinsav és palmitinsavból áll, amelyek legalább 40% -a sztearinsav. Nagyon finom por, amely tapintású zsíros és gyakorlatilag vízben nem oldódik.
Lenyeléskor a magnézium-sztearátot feloldjuk magnéziumionban, valamint sztearinsavban és palmitinsavban. A magnézium elsősorban a vékonybélben, kisebb részben a vastagbélben szívódik fel. A magnézium nélkülözhetetlen ásványi anyag, több száz enzimatikus reakció kofaktoraként szolgál, és nélkülözhetetlen a szénhidrátok, lipidek, nukleinsavak és fehérjék szintéziséhez, valamint a neuromuszkuláris és a szív- és érrendszeri funkciókhoz [1], [2]. A test magnéziumtartalmának többsége a csontokban és az izmokban tárolódik [1], [3]. Kis mennyiség (~ 1%) van jelen a szérumban és az interstitialis testfolyadékban, többnyire szabad kationként létezik, míg a fennmaradó rész fehérjéhez kötődik, vagy anion komplexként létezik [3]. A vese nagyrészt felelős a magnézium homeosztázisáért és a szérumkoncentráció fenntartásáért [1], [3]. A kiválasztás elsősorban a vizelettel történik, de izzadságban és anyatejben is. A sztearinsav és a palmitinsav az étkezési olajok és zsírok anyagcseréjének terméke, amelyek metabolikus sorsa jól megalapozott. Ezek a zsírsavak ß-oxidáción keresztül 2 szénatomot eredményeznek, amelyek belépnek a trikarbonsav körforgásba, és az anyagcseretermékeket felhasználják és kiválasztják [4].
2. Anyag és módszerek
2.1. Vegyszerek
Minden genotoxicitási vizsgálat GLP-kompatibilis volt; a koncentrációra szánt dóziskészítmények elemzését azonban a japán szabályozó ügynökség nem kérte, és ezeket a vizsgálatokat kérte. A magnézium-sztearátot (99% relatív sztearinsav és palmitinsav; CAS-szám: 557-04-0; San-Ei Gen F.F.I., Inc., Osaka, Japán) szobahőmérsékleten tároltuk. A készítményeket közvetlenül a felhasználás előtt készítettük úgy, hogy vivőanyagot adtunk a lemért vizsgált anyaghoz és ultrahanggal oldottuk; alacsonyabb koncentrációkat állítottunk elő soros hígítással. A dimetil-szulfoxidot (DMSO) a Sigma-Aldrich Japan K.K. (Shinagawa-ku, Japán). 2- (2-furil) -3- (5-nitro-2-furil) akrilamidot (AF-2), 2-aminoantracént (2AA), nátrium-karboxi-metil-cellulózt és mitomicin C-t (MMC) a Wako Pure Chemical Industries cégtől vásároltunk., Ltd., Oszaka, Japán. A 9-aminoakridin-hidroklorid-monohidrátot (9AA) és az N-etil-N'-nitro-N-nitrozoguanidint (ENNG) a Nacalai Tesque, Inc.-től (Kiotó, Japán) vásároltuk. A japán Pharmacopeia fiziológiás sóoldatot a Otsuka Pharmaceutical Factory, Inc.-től (Tokushima, Japán) vásároltuk.
2.2. Bakteriális reverz mutációs vizsgálat
2.3. In vitro kromoszóma-aberrációs vizsgálat
A frissen felolvasztott sejteket 72 órán át tenyésztettük, majd 1x104 sejt/ml-re hígítottuk; A szuszpenzió 5 ml-ét kezelési csoportonként két 6 cm-es műanyag Petri-csészébe helyeztük, és 72 órán át tenyésztettük. Ezután 2,5 ml tápközeget eltávolítottunk minden egyes petri-csészéből, és 0,5 ml S9 keveréket (5% végkoncentráció) vagy táptalajt adtunk a vizsgálatokhoz metabolikus aktiválással vagy anélkül. A táptalajhoz adott vivőanyag, magnézium-sztearát vagy MMC (20 μg/ml végkoncentráció) készítmények térfogata 10% volt; B [a] P-t adtunk hozzá 0,5% -ban (0,15 μg/ml végkoncentráció). 6 órán át tartó tenyésztés után a sejteket egyszer öblítettük fiziológiás sóoldattal, 5 ml friss táptalajt adtunk hozzá, és a sejteket további 18 órán át tenyésztettük. Folyamatos expozícióhoz 72 órával a tenyésztés megkezdése után 0,5 ml magnézium-sztearát-készítményt, vivőanyagot vagy MMC-oldatot (végkoncentráció 0,05 μg/ml) adtunk hozzá, és a sejteket 24 vagy 48 órán át tenyésztettük. Colcemidet adtunk minden petri-csészéhez 0,1 μg/ml végkoncentrációban 2 órával a tenyésztési periódus vége előtt.
2.4. Állattenyésztés
Hím Crj: CD-1 (ICR) egerek (Charles River Laboratories Japan, Inc.) 7 hetesek voltak a kezelés idején. Az állatokat alumínium ketrecekben, nedvszívó ágyakkal (White Flakes, Charles River Laboratories Japan, Yokohama, Japán) helyeztük el egy specifikus kórokozóktól mentes létesítményben, 12 órás fény/12 órás sötét ciklussal. Az egereknek kobalt-60 besugárzott szilárd takarmányt (CE-2, CLEA Japan, Inc., Tokió, Japán) és ad libitum vizet kaptunk.
2.5. In vivo erythrocyta micronucleus (MN) vizsgálat
Az MN-PCE gyakoriságát úgy határoztuk meg, hogy megszámoltuk a mikrotagok számát (MN) 2000 PCE-ben állatonként kódolt minták és olajmerítő lencse felhasználásával (végső nagyítás: 1000 ×). Minden állatból ötszáz eritrocitát [PCE + normokromatikus eritrociták (NCE)] pontozunk, hogy meghatározzuk a PCE százalékos arányát az összes eritrocitában, mint a csontvelő sejtjeinek kémiailag indukált növekedési szuppressziójának indexét.
2.6. statisztikai elemzések
Chi-négyzet teszt (egyoldalú, p. 1. táblázat. Összhangban a tartomány-megállapítási vizsgálat eredményeivel (S1 kiegészítő adattáblázat), az öt Salmonella vagy E. coli egyikében sem volt pozitív mutagén válasz a magnézium-sztearátra. A metabolikus aktivációval vagy anélkül tesztelt törzsek. A pozitív kontroll vegyi anyagok átlagos metabolikus aktivációval és anélkül egyaránt megfigyelhető revertáns értékei legalább kétszeresek voltak az egyidejű oldószeres kontrollok fölött. A hordozóban és a pozitív kontroll csoportokban a revertáns telepek száma A revertáns telepek növekedésének indukciójának hiánya vagy bármilyen látszólagos koncentrációfüggő válasz azt jelzi, hogy a tesztelt vizsgálati körülmények között a magnézium-sztearát nem mutagén a bakteriális reverz mutációs vizsgálatban.
Asztal 1
A magnézium-sztearát baktérium reverz mutációs vizsgálatának eredményei.
- Magnézium-sztearát mellékhatások, felhasználások és egyebek
- A magnézium-sztearát biztonságos és hatékony töltőanyag - A rekord egyenes táplálkozási felülvizsgálatának beállítása
- A magnézium-sztearát biztonságos az étrend-kiegészítőkben
- A magnézium-sztearát káros vagy ártalmatlan 6 feltételezett veszély
- A magnézium-sztearát nem mérgező, nem probléma Debra; s Természetes ínyenc