A megnövekedett plazma lipidszint súlyosbítja az izom patológiáját a Duchenne izomdisztrófia mdx egér modelljében
Absztrakt
Háttér
A Duchenne-féle izomdisztrófiát (DMD) a dystrophin expressziójának elvesztése okozza, és ez súlyos ambuláns és szívműködés-csökkenéshez vezet. Azonban a dystrophin-hiányos mdx egér DMD modell csak a betegség nagyon enyhe formáját fejti ki. Csoportunk és mások vaszkuláris rendellenességeket mutattak ki az MD állatmodelljeiben, annak valószínű következménye, hogy az erek ugyanazokat a dystrophin-asszociált glikoprotein komplex (DGC) fehérjéket expresszálják, mint a vázizmok.
Mód
A DMD izomkárosodásához való erek hozzájárulásának tesztelése, mdx 4cv az egereknek megnövekedett lipidszintet kaptak apolipoprotein E (ApoE) gén kiiktatással normál chow- vagy lipidben gazdag nyugati étrenddel kombinálva. Az ambuláns és a szívműködést (echokardiogrammal) 4 és 7 hónapos korban értékelték. Feláldozás után izomszövettani és aortafestést alkalmaztunk az izompatológia és az érelmeszesedés kialakulásának felmérésére. Megmértük az összkoleszterin, a nagy sűrűségű lipoprotein (HDL), a trigliceridek és a kreatin-kináz (CK) plazmaszintjét is.
Eredmények
Bár a bal kamrai szív térfogata nőtt mdx-ApoE egerek a mdx egerek, a szívműködés paraméterei nem változtak. Csak a vad típusú és az ApoE-null összehasonlításához mdx-Az ApoE KO egerek jelentős ambuláns diszfunkciót mutattak. Annak ellenére, hogy a plazma CK-ban nem volt szignifikáns különbség, a szövettani elemzések azt mutatták, hogy a magas mdx-Az ApoE egerek az izom patológiájának súlyos exacerbációjával jártak mdx egerek: a myofiber károsodásának és a fibrofattyúpótlás jelentős növekedése a gastrocnemius és a triceps brachii izmokban, jobban emlékeztetve az emberi DMD patológiájára. Végül, bár az ApoE és a mdx-Az ApoE csoportokban megemelkedett a plazma lipidszintje, mdx-Az ApoE ateroszklerotikus plakklerakódást mutatott, amely egyenlő vagy kevesebb, mint az ApoE egereké.
Következtetések
Mivel mások kimutatták, hogy a lipid-rendellenességek korrelálnak a DMD súlyosságával, adataink azt sugallják, hogy a plazma lipidek lehetnek az elsődleges hozzájárulók az emberi DMD súlyosságához, és hogy a közismerten enyhe fenotípus mdx az egerek részben az endogén alacsony plazma lipidprofiloknak tulajdoníthatók. Ennélfogva a DMD-betegek számára előnyös lehet a lipidcsökkentő és érrendszeri célzott terápia.
Háttér
A distrofin egy 427 kDa fehérje, amelyet az X kromoszóma rövid karján kódolnak. Kulcsfontosságú tagja a dystrophin-glycoprotein komplexnek (DGC), amely átíveli a plazmamembránt és összekapcsolja az extracelluláris mátrixot az intracelluláris citoszkeletonnal [1]. A distrofin kötődik a citoszkeletális aktin szálakhoz és a plazmamembrán más DGC fehérjéihez, létrehozva egy kapcsolódási pontot, amely szükséges a sarcolemmális szerkezet fenntartásához és a mechanikai stressz elleni védelemhez [2]. A funkcionális dystrophin expresszió elvesztése Duchenne (DMD) és Becker izomdisztrófiák (BMD) kialakulásához vezet, melyeket súlyos és progresszív izomgyengeség és pazarlás jellemez a fokozott sarcolemma-törékenység és a myofiber sérülésekre való hajlam miatt [2,3,4].
A DMD a legelterjedtebb MD-típus, világszerte 3600–6000 férfi születésből csaknem 1 esetben fordul elő, és az összes MD-eset körülbelül 80% -át teszi ki [5, 6]. A gyermekek általában rendellenes járással, progresszív izomgyengeséggel, borjú pseudohypertrophiával és emelkedett szérum kreatin-kináz (CK) szinttel rendelkeznek. Az izmok hipertrófiája azonban fokozatosan átadja a helyét a jelentős izomdegenerációnak és a fibrofattyú átalakulásának [7,8,9], így a fiúk 90% -a 12 éves korára kerekesszékbe szorul [10]. Habár a DMD-s betegek pusztító vázizom-patológiát mutatnak, a kardiomiociták fokozott érzékenységet mutatnak a mechanikus stressz okozta sérülésekre is, amelyek fokozott szívfibrózishoz vezetnek [11], és gyakran letális szívműködési zavarok alakulnak ki, amelyek általában dilatált kardiomiopátiaként (DCM) nyilvánulnak meg [12,13,14, 15]. A súlyos szívbetegség következtében a jelentős rekeszizom-károsodás miatti károsodott légzési funkciók mellett a DMD-betegek várható élettartama körülbelül 30 éves korra rövidül [10, 16].
Mivel mi és mások dokumentáltuk a DGC-asszociált fehérjék expresszióját az érrendszeri endothel sejtekben és a simaizomsejtekben [27, 28], feltételeztük, hogy a DGC fehérjék érrendszeri mutációi befolyásolhatják az MD elsődleges izomdiszfunkcióit. Ennek a hipotézisnek a tesztelésére, mdx az egereknek megnövekedett plazma lipidszintet kaptak, amelyek vaszkuláris betegségekkel és érelmeszesedéssel jártak. Ezt az apolipoprotein E (ApoE) gén inaktiválásával érték el, amely koleszterinben gazdag részecskék felhalmozódását okozza a plazmában [29, 30]. A kapott mdx-Az ApoE egerek megnövekedett lipidszintet mutatnak, ami az izom patológiájának jelentős súlyosbodásával jár, jobban összefoglalva a DMD beteg fenotípusát. Adataink arra utalnak, hogy a közismerten enyhe fenotípus mdx az egerek a natívan alacsony plazma lipidprofiloknak és az emberekhez képest jobb érrendszeri egészségnek tulajdoníthatók. Mivel a közelmúltbeli jelentések a plazma és a szövet lipid rendellenességeit tárták fel DMD-s betegeknél [31, 32], azt javasoljuk, hogy a plazma lipidek jelentősen hozzájárulhassanak az MD patológiájához, és hogy a DMD-s betegek számára előnyös lehet a lipidszint-csökkentő és érrendszeri célzott terápiák.
Mód
Állattenyésztés és tenyésztés
Valamennyi állatot 12 órás fény/sötét ciklusban helyeztük el, hőmérséklet-szabályozással, és az összes kísérletet az UBC Állattenyésztési Bizottság jóváhagyásával hajtottuk végre. A kísérleti egereket rendes chow-ra (LabDiet 5001) vagy Western-étrendre (Harlan, TD88137; 0,2% összes koleszterin, 21% összes zsír és 34% szacharóz tömegre) helyeztük 8 hetes korukban. Az egereket 4 és 7 hónapos korukban feláldoztuk terminális érzéstelenítés alatt (3,5% v/v izoflurán 2 L O2-on) szívszúrás útján, és felmelegített Krebs-oldattal [118 mmol/L NaCl, 22,5 mmol/L NaHCO3, 4 mmol/L KCl, 1,2 mmol/L NaH2PO4, 2 mmol/L CaCl2, 2 mmol/L MgCl2 és 11 mmol/l szőlőcukor].
Ambuláns funkció értékelés
A lépés hosszát úgy mértük, hogy lefestettük az egerek hátsó lábát, és hagytuk, hogy lefutjanak egy kb. 1,5 m hosszú papírral bélelt kis folyosón. Ugyanazon láb lábai közötti távolságot három egymást követő futás során mértük és átlagoltuk, a leállási területek kivételével.
In vivo szívműködés
Az egereket 0,75–1,25% mennyiségben altattuk v/v izofluránt 2 L O2 nyomáson, 400 és 425 BPM között tartott pulzus mellett, és négykamrás echokardiogramot készítettünk a VisualSonics Vevo 2100 rendszer alkalmazásával. A szívkamra és a kamra falának nyomon követését számos fiziológiai és funkcionális szívparaméter meghatározása céljából végeztük, mint például a szívteljesítmény, a frakcionális rövidülés, a stroke térfogata, a kilökődési frakció, valamint a bal kamra átmérője és térfogata mind a diasztolában, mind a szisztolában.
Evan kék színezék vizsgálata
A korábban ismertetett protokollok szerint [35] 3,0% izoflurán v/v, az egereket intravénásán 200 μl 0,5% -os Evan kék festékkel PBS-oldatban injektálták az alsó vena cava-ba. Az állatokat 10 percig perfundáltuk, mielőtt a méhnyak diszlokációjával leöltük őket, és összegyűjtöttük az izmokat. 24 órás 56 ° C-os szárítás után a szárított izmokat lemérjük, és 500 µl formamidba helyezzük 24 órán át 56 ° C-on. A mintákat centrifugáltuk, minden egyes mintából 200 μl-t adtunk a 96 lyukú lemezekre két példányban, és megmértük az abszorbanciát 500 nm-en. Standard görbét alkalmaztunk ng Evan kék színezékének extrapolálására, amelyet azután az izomszövet száraz tömegére normalizáltunk.
Izomszövettan
A rekeszizom, a tibialis anterior (TA), az extensor digitorum longus (EDL), a gastrocnemius, a quadriceps femoris és a triceps brachii izmokat gyűjtöttük össze. A szöveteket 24 órán át 10% -os formalinban rögzítettük, majd 70% -os etanolba helyeztük. Az izom paraffinba ágyazódott, és 8 μm vastag tárgylemezekre tagoltuk, amelyeket hematoxilin- és eozin- (H&E) vagy Masson-féle trichromfoltokkal festettünk. Alizarin vörös foltot is elvégeztünk a kiválasztott vázizomlemezeken a kalcium lerakódásának vizualizálása céljából. A zsír százalékát úgy számítottuk ki, hogy az Aperio ImageScope szoftverben nyomon követtük az adipocita régiókat, és elosztottuk a területet az izom teljes területével. Az egészséges myofibers által elfoglalt izomterület százalékos arányának meghatározásához a nem myofiber területeket (pl. Adipociták, koleszterin felhalmozódások, meszesedés és gyulladásos sejtek), valamint a sérült, nekrotikus régiókat levontuk az összes izomterületről. A kollagéntartalmat pozitív pixelszámláló algoritmus alkalmazásával mértük Aperio ImageScope szoftverben Masson trichrommal festett tárgylemezein a következő paraméterek alkalmazásával: színárnyalat értéke 0,66 és színárnyalat 0,25. A szíveket 10% -os formalinban rögzítették, paraffinba ágyazva és Masson trikrómjával megfestették.
Az ellentétes izmokat összegyűjtöttük, és azonnal tragakantba ágyazva keresztmetszetben, villanófagyasztva folyadék-nitrogénnel hűtött izopentánban és -80 ° C-on tároltuk. A fagyott izmokat - 20 ° C-on, 8 μm vastagságban metszettük, és olajvörös O-val festettük az izomszövetben megjelenő semleges lipidek megjelenítésére Mehlem, Hagberg [36] által kidolgozott protokollnak megfelelően. Az érrendszeri sűrűség vizualizálása céljából CD31-t (PECAM-1) detektáltunk az izom cryosekcióiban anti-CD31 antitest (1: 100 hígítás, Cell Signaling, D8V9E # 77699) alkalmazásával, a gyártó által javasolt immunhisztokémiai (IHC) protokollal.
Plazmaelemzés
A plazmát heparinizált csövekbe gyűjtöttük ki nem futtatott egerek szívszúrásával, 4000 fordulat/perc sebességgel 10 percig 4 ° C-on lepörgettük és -80 ° C-on tároltuk. A plazmamintákat a Siemens Advia 1800 rendszer segítségével értékeltük a kreatin-kináz (CK NAC), a koleszterin (CHOL-2), a nagy sűrűségű lipoprotein (D-HDL) és a trigliceridek (TRIG-2) szintjére, és a vizsgálatokat a a gyártó utasításait.
Aorta érelmeszesedés
A szíveket az atrioventrikuláris sík mentén elvágták és optimális vágási hőmérsékletű (OCT) vegyületben lefagyasztották, az aorta gyökérszakaszokat olajvörös O-val festették [36]. Az aorta gyökér plakkterületét négyzet milliméterben mértük. A teljes aortákat 10% -os formalinban rögzítettük, 70% -os etanollal öblítettük, és 20 percig áztattuk szűrt IV szudán oldatban (5 g Sudan IV 500 ml 70% etanolban és 500 ml acetonban). Miután az aortákat 70% -os etanollal öblítettük, 20 percig 80% -os etanolban áztattuk, majd 1 órán át folyó vízben öblítettük és 10% -os formalinban tároltuk. Rögzített nyitott aortákról készítettünk fényképeket elemzés céljából, és a lepedék lefedettségének százalékos arányát úgy határoztuk meg, hogy a lepedék területét elosztottuk az ér teljes területével.
Statisztikai analízis
A statisztikai elemzéseket a GraphPad Prism 6 alkalmazásával végeztük. Több csoport egy időben történő összehasonlításához egyirányú varianciaanalízist (ANOVA) többszörös összehasonlító tesztet használtunk az egyes csoportok átlagainak összehasonlításához. Ha több csoportot több időpontban hasonlítottak össze, kétirányú ANOVA többszörös összehasonlító tesztet alkalmaztak. Tukey módszerét alkalmazták a több összehasonlítás korrigálására. A P A 0,05 alatti érték statisztikailag szignifikánsnak tekinthető. Az adatok az átlagot plusz az átlag standard hibáját (SEM) és n az egerek számát mutatja kísérletenként.
Eredmények
A megnövekedett plazma lipidszint kisebb szívváltozásokat okoz mdx egerek
Hiperlipidémiás mdx az egereknél károsodott az ambuláns funkció és tartós a hátsó lábszár hipertrófia
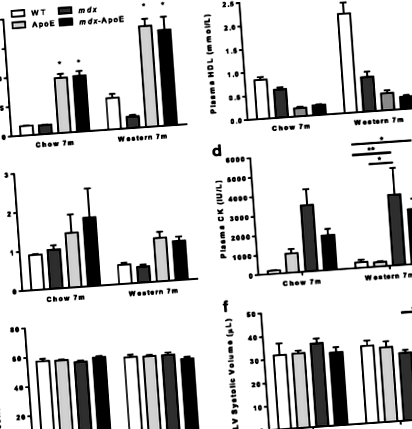
Az ambuláció tekintetében észrevehető károsodást tapasztaltunk a hiperlipidémiás járóképességben mdx egerek. A WT vagy ApoE egerekhez képest a lépéshosszmérések szignifikáns 20–25% -os csökkenést mutattak a lépés hosszában mdx-Az ApoE egerek 7 hónapos korukban etettek chow-t vagy nyugati étrendet, míg mdx az egerek nem szignifikáns csökkenést mutattak a lépéshosszban (2a – b. ábra). A 7 hónapos eutanáziát követően észrevettük, hogy a vázizomzat tartósan növekszik mdx-Az ApoE egerek nyugati étrendet tápláltak a WT-vel összehasonlítva (2c-d. Ábra), és hasonló eredményeket tapasztaltak 7 hónapos csecsemővel etetett csoportokban is (az adatokat nem mutatjuk be). Mivel a borjú hipertrófia viszonylag korai esemény a DMD-ben, hasonló elemzéseket végeztünk egy második kohorszban egy korábbi 4 hónapos időpontban, és még súlyosabb hátsó végtag hipertrófiát észleltünk mdx és mdx-Az ApoE egerek nyugati étrendet tápláltak, nincs szignifikáns különbség a dystrophin-hiányos csoportok között (2d. Ábra).
A megemelkedett plazma lipidszint súlyosbítja mdx-kapcsolódó myofiber károsodás és a vázizomzat átalakulása
Hasonlóképpen, a triceps brachii izom súlyosan súlyosbodott mdx-ApoE egerek a 4a – b. Ábrán látható módon. A teljes izomterület elemzése feltárta a teljes izomterület kezdeti növekedését mdx-ApoE triceps brachii 4 hónaposan nyugati étrenden (4c. Ábra). Bár ez a hipertrófia 7 hónapos korára kiegyenlített (4c. Ábra), az izomösszetételben drámai változások voltak mdx-Az ApoE triceps brachii izmok az összes többi csoporthoz képest ebben az időpontban: fokozott zsír- és kollagénlerakódás (a teljes izomterület körülbelül 10, illetve 20% -a) és csökkent életképes izomterület (4d – f. Ábra). Ismét megnövekedett kollagénlerakódás mindkét nyugati táplálékkal táplált táplálékban mdx és mdx-Az ApoE tricepsz már 4 hónapos korban megfigyelhető volt (4e. Ábra).
Ezzel szemben csak az izmok patológiájának súlyosbodása felé mutató kisebb, nem szignifikáns tendenciát figyeltünk meg a quadriceps femorisban. mdx-ApoE egerek: hasonló növekedés a fibrózis között mdx és mdx-Jelentős zsírbetörés nélküli ApoE-csoportok (6. kiegészítő fájl: S5A – E ábra). Hasonlóképpen a hiperlipidémia sem befolyásolta mdx-társult patológia a rekeszizomban (7. kiegészítő fájl: S6A ábra): mindkettő mdx és mdx-A nyugati étrendben lévő ApoE egerek szignifikáns mértékű fibrózist és myofiber károsodást mutattak, az egészséges miofiber terület hasonló csökkenésével a 4. és 7. hónapban a nyugati étrenden (7. kiegészítő fájl: S6B – E ábra). Végül nem figyeltünk meg drámai izompatológiát az összegyűjtött tibialis anterior (TA), soleus vagy extensor digitorum longus (EDL) izmokban (az adatokat nem mutatjuk be). Adataink együttesen megnövekedett izomsorvadást, myofiber károsodást és fibrofattyú infiltrációt sugallnak egyeseknél, de nem minden mdx-kapcsolódó izmok.
A dystrophin elvesztése nem súlyosbítja a vaszkuláris érelmeszesedést
Vita
Mivel adataink alátámasztják egy korábbi tanulmány megállapításait, amely a tompa lepedék lerakódását figyelte meg mdx-ApoE egerek az ApoE egerekhez képest [44], és kimutattuk, hogy normális vagy akár megnövekedett érrendszeri sűrűség van az izomkárosodás területén, az izom patológiájának súlyosbodása mdx-Az ApoE valószínűleg nem a plakk által kiváltott ischaemiás események következtében kialakuló izomelhalás. Ehelyett adatunk azt sugallja, hogy a megnövekedett érpermeabilitás mindkét esetben megfigyelhető mdx és mdx-Az ApoE izom megkönnyítheti a plazma lipidek behatolását az izomszövetbe a mdx-ApoE egerek, amelyekben magas a koleszterin és a lipid tartalom. A súlyos izomelváltozások szövettani jellemzői alapján mdx-ApoE egerek összehasonlítva mdx egerekben endogén módon alacsony cirkulációjú lipidek, azt javasoljuk, hogy a vérplazmából származó lipidek szivárgása az érzékeny izomszövetekbe myofiber toxicitást eredményezzen, és hogy minél magasabb a plazma lipidje, annál nagyobb a myofiber károsodása és a fibrofattyú helyettesítése.
mdx-Az ApoE mint a DMD továbbfejlesztett modellje
Plazma lipidek: egy új spin az érelméletben?
Lipidek és lipoproteinek, mint a DMD elsődleges közvetítője és a lehetséges terápiás célpontok
Tévedni az óvatosság oldalán, míg a mi mdx-Az ApoE modell jobban megfelel a DMD-ben megfigyelt patológiának, mint a mdx egér endogén alacsony lipidszintjével, néhány fontos különbség megmarad. Például, bár az ApoE egerek lipidszintje jobban reprezentálja az emberi lipidprofilt, mint a vad típusú egerek, a keringő VLDL és a chilomikron maradványok szintje magasabb, mint az emberekben jellemzően [61]. Mindazonáltal meg kell jegyezni, hogy az ApoE egerek ateroszklerotikus elváltozásai spontán módon fejlődnek ki hasonló mechanizmus révén, mint a hiperlipidémiás embereknél [62]. Ezenkívül modellünk különbözik a DMD-s betegekétől mdx-Az ApoE egereknél csak kis változás mutatkozott az ambuláns működésben, és nem sikerült jelentős DCM-t kifejleszteniük, amelyek a DMD fontos kóros eredményei.
Adataink összességében arra utalnak, hogy a DMD-s betegek számára előnyös lehet a hiperlipidémiás betegek számára rendszeresen ajánlott étrend, amely anti-aterogén HDL-koleszterinszint emelésére és a pro-atherogén LDL-koleszterinszint csökkentésére törekszik. Végül a DMD-beteg lipidprofiljának biztonságos módosítását koleszterin- vagy TG-csökkentő gyógyszerekkel is meg kell vizsgálni. Ezt egy korábbi tanulmány is alátámasztja, amely szerint a lipidcsökkentő gyógyszer, a szimvasztatin, a sztatin család tagja, jelentősen javítja az izom működését és a fibrózist, rabdomiolízisre utaló jelek nélkül mdx egerek [63]. Úgy gondolták azonban, hogy ez az előny azóta a gyógyszer antioxidáns „pleiotropikus” hatásain keresztül valósul meg mdx A lipidszint, bár endogén módon alacsony, a szimvasztatin-kezeléssel nem csökkent tovább. Érdekes módon sok csoport mutatta előnyeit az érrendszeri terápiák alkalmazásával mdx vagy DMD, például nitrogén-monoxid (NO) donorok és angiotenzin II receptor blokkolók (ARB) [64,65,66,67]. Ezért a lipidszint-csökkentő vagy érrendszeri célú megközelítések optimalizálása a DMD-ben egyedülálló terápiás és kezelési lehetőségeket kínálhat, amelyeket meg kell vizsgálni.
Következtetések
Vizsgálatunk összességében enyhe szívváltozásokat, károsodott ambuláns funkciókat és drasztikusan súlyosbodott vázizom-patológiát tárt fel a hiperlipidémiában mdx-A DMD ApoE-modellje, amely jobban összefoglalja a DMD-ben megfigyelt betegség súlyosságát, mint a standard mdx egerek. Ezért adataink arra utalnak, hogy a keringő lipidek jelentősen hozzájárulhatnak a DMD patológiájának kialakulásához és előrehaladásához, és hogy az egér modelljei natívan alacsony plazma lipidszintjük miatt enyhébb fenotípusokat mutathatnak. Mivel a klinikai kutatások potenciális vaszkuláris és lipid rendellenességeket jeleztek a DMD-ben, egyértelmű, hogy a DMD patofiziológiája összetettebb, mint azt korábban megértették, és hogy a lipidszint-csökkentő és az érrendszert célzó terápiák előnyösek lehetnek a DMD kezelésében.
- Az alkoholmentes steatohepatitis GAN diéta által kiváltott elhízott egérmodelljének humán lefordíthatósága
- Megnövekedett étrendi fruktóz az emelkedett húgysavszint és alacsonyabb májenergia-raktárak miatt -
- Magas vér koleszterinszint MedlinePlus Medical Encyclopedia
- Lipid - Besorolás és kialakulás Britannica
- Lipáz teszt (vagy szérum lipáz) szintek, cél, eljárás, eredmények