A patkányok testzsírtartalmának leptin okozta növekedése
Absztrakt
A leptin egy zsírszármazékból származó hormon, amelyről feltételezik, hogy negatív visszacsatolási jel az energiaegyensúly szabályozásában (46). A leptin központi (12, 43) vagy perifériás (37) beadása gátolja a normál testsúlyú rágcsálók táplálékfelvételét, és korrigálja az elhízási szindróma számos aspektusát a leptinhiányos ob/ob egerekben (20, 33). A perifériás leptin kezeléssel járó negatív energiamérleg a testzsír tömegének csökkenését és a sovány testtömeg fenntartását eredményezi (20); ezzel szemben a leptin központi adagolása mind a zsír, mind a sovány szövet elvesztését eredményezheti (5). Annak ellenére, hogy a leptin a normál testsúlyú rágcsálók energia-egyensúlyának hatékony szabályozója, az elhízott vagy idős állatokban magas az endogén leptin koncentrációja a keringésben, de leptin-rezisztensek, mert a leptin beadása nem befolyásolja az élelmiszer bevitelét vagy a testsúlyát ).
Korai megfigyelések szerint a perifériás leptin-rezisztencia megelőzte a magas laktinszintű táplálékkal ellátott egerekben a központi leptin-rezisztencia kialakulását (9) arra a következtetésre jutottak, hogy a perifériás leptin-rezisztencia abból adódik, hogy a leptin nem képes átjutni a vér-agy gáton (1), A leptinrezisztencia a leptin nem képes aktiválni receptorait (38). Ezekkel a megfigyelésekkel összhangban az étrend által kiváltott elhízott patkányok leptinrezisztenciája a hipotalamusz receptorok aktiválásának sikertelenségével jár, míg a hátsó agyi receptorok továbbra is reagálnak a leptinre (25). Mások (29) ugyanakkor arról számoltak be, hogy a leptin receptorok csak a hipotalamusz bizonyos területein nem reagálnak a leptin-rezisztens étrend okozta elhízott egerekben, ami azt sugallja, hogy a rezisztencia inkább a receptor érzékenységének megváltozásával jár, mintsem a leptin véren történő transzportjával. -agygát.
A CD patkányok adatai további hipotézisre vezettek bennünket, hogy nem stimulált körülmények között a hátsó agyban és/vagy a periférián elhelyezkedő leptin receptorok antagonizálják az előagy leptin aktivitásának katabolikus hatását. Az itt leírt vizsgálatok célja annak tesztelése volt, hogy az előagy és a hátsó agy leptin receptorai eltérő hatással vannak-e a test összetételére. Ez úgy valósult meg, hogy krónikusan beadták a leptin alacsony dózisait a patkányok 3. vagy 4. kamrájába, vagy a patkányokat perifériásan leptinnel infúzióval, miközben az előagy vagy a hátsó agy receptorainak aktivációját a leptin receptor antagonista leptin mutein fehérje (mutein) infúziójával gátolták 42) a 3. vagy 4. kamrába.
MÓD
Az ezekben a vizsgálatokban használt patkányok hím Sprague-Dawley patkányok voltak (Harlan Laboratories, Indianapolis, IN), amelyeket 0700-tól kezdve minden nap 12 órán át világítottak. Valamennyi állat szabad hozzáféréssel rendelkezett a chow-hoz (LabDiet 5012; PMI Nutrition International, Brentwood, MO) és a vízhez, hacsak másképp nem szerepel. Minden patkánynak volt egy nylabone (Nylabone Products, Neptune, NJ) a ketrecben a dúsítás céljából. Az összes állati eljárást a Georgia Egyetem és a Georgia Health Sciences University intézményi állatgondozási felhasználási bizottságai hagyták jóvá.
1. kísérlet: A 4. kamra alacsony dózisú leptin infúziójának hatása.
Az infúzió 12. napján az ételt 7: 00-kor eltávolítottuk a patkányketrecekből. 10:00 órától patkányokat öltek meg, és törzsvért gyűjtöttünk a szérum leptin méréséhez (Rat Leptin RIA kit, Millipore). Az inguinális, epididymális, retroperitoneális és mesenterialis fehér zsírt és IBAT-ot boncoltuk, lemértük, és visszatértük a tetembe. A tetemzsírt a korábban leírtak szerint határozták meg (15).
További 14 patkányt Alzet-pumpákkal szereltünk fel, hogy PBS-t vagy 0,6 μg leptint/24 óra juttassunk a 4. kamrába. Az infúzió öt napja után csoportonként két patkányt 7:00 és 12:00 óra között tápláléktól megfosztottak, majd heparinizált sóoldattal, majd 4% paraformaldehiddel perfundálták. Az agyakat összegyűjtöttük, és egy éjszakán át 4% paraformaldehidben hagytuk, majd szacharóz-azid oldatban tároltuk. Koronális 30 μm metszeteket készítettünk, és a hipotalamusz és az agytörzs foszforilált jelátalakítóját és a transzkripció-3 aktivátorát (pSTAT3) immunohisztokémiai módszerrel detektáltuk a korábban leírtak szerint (14). A fennmaradó 10 patkányt (csoportonként 5) ételtől megfosztották 7: 00-tól 11: 00-ig, és a hipotalamusz vagy az agytörzs szövetblokkjait összegyűjtötték a foszforilezett STAT3, a foszfoinozidid-3-kináz (pPI3K p85), extracelluláris mérésére. szignálhoz kapcsolódó kinázok 1/2 (pERK1, pERK2) és AMP-aktivált protein-kináz (pAMPK), a 3. citokin jelátviteli szuppresszor (SOCS3) és a protein-tirozin-foszfatáz (PTP1B) Western-blot alkalmazásával, a korábban leírtak szerint (17). Az összes primer antitestet a Cell Signaling Technology-tól (Danvers, MA) kaptuk, kivéve az anti-PTP1B-t, amelyet Abcam-tól (ab2009; Abcam, Cambridge, MA) kaptunk.
2. kísérlet: A 3. kamra alacsony dózisú leptin infúzióinak hatása.
Az 1. kísérlet eredményei azt mutatták, hogy az alacsony dózisú, 4. kamrai leptin infúziót kapó patkányok testzsírot nyertek a leptin infúzió 12 napja alatt. Ezt a vizsgálatot annak megerősítésére végezték, hogy a leptin alacsony dózisú infúziói a 3. kamrába súlyvesztést okoztak. Huszonnyolc patkányra felszereltünk egy 3. kamrai kanült, amint azt korábban leírtuk (6). A kanül elhelyezésének koordinátái a vízszintes koponya középvonalán a bregmához képest anteroposterior −2,8 mm, laterális 0,0 mm és ventrális −9,0 mm voltak. A kiindulási táplálékfelvételt és a testtömeget 5 napon keresztül mértük a műtét után 1 hét múlva. A patkányok 320-350 g-ot nyomtak a vizsgálat kezdetén. A kiindulási periódus végén a patkányokat négy súly-egyeztetett csoportra osztottuk, és egy Alzet (1002-es modell) szivattyút csatoltunk a kanülhöz, amely PBS-t vagy 0,3, 0,6 vagy 0,9 μg leptint adott naponta. Az infúzió 3. napján farok vérmintát vettünk a szérum leptin méréséhez. Testösszetétel és szérum inzulin (patkány inzulin RIA készlet, Millipore), glükóz, glicerin (szabad glicerin reagens F6428; Sigma-Aldrich), szabad zsírsavak (FFA; NEFA C készlet, Wako Chemicals, Richmond, VA) és triglicerid (TG) ) 12 napos infúzió után mértük. A máj lipid- és glikogéntartalmát is mértük a korábban leírtak szerint (16).
3. kísérlet: A 4. kamrai mutein és a perifériás leptin infúzió hatása.
4. kísérlet: a 3. kamrai mutein és a perifériás leptin infúzió hatása.
Hipotézisünk szerint az előagyi leptin receptorok antagonizálják a hátsó agy leptin receptorainak reakcióit; ezért ez a tanulmány azt tesztelte, hogy a 3. kamra leptin receptorainak blokádja növeli-e a testzsír-tömeg növekedését a perifériás leptin-infúzióban részesülő patkányokban. Hetvenkét patkányt egy-egy 3. kamrai kanüllel láttak el, és 1 hétig hagyták helyreállni a műtét után. A kiindulási táplálékfelvétel és a testtömeg-mérés 5 napjának végén a patkányokat nyolc súly-egyeztetett csoportra osztottuk, és a kísérleti protokoll fennmaradó része megegyezett a 3. kísérletével. Kezelési csoportonként további két patkányt illesztettünk be kanülekkel és Alzet szivattyúkkal a fent leírtak szerint. 5 napos infúzió után a patkányokat ketaminnal altattuk és perfundáltuk a pSTAT3 immunhisztokémiai kimutatására.
5. kísérlet: a leptin által kiváltott zsírosodás étrendi modellje.
Adatelemzés.
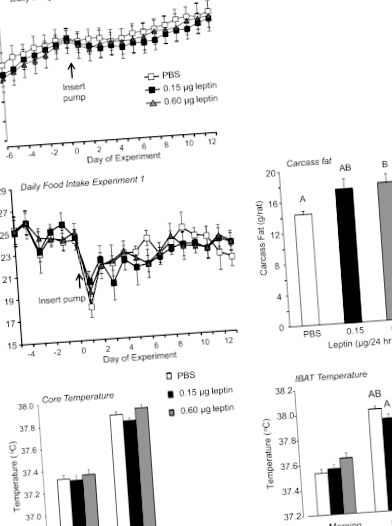
A kezelési csoportok között statisztikailag szignifikáns különbségeket a Statistica szoftver 9.0 verziójával (StatSoft, Tulsa, OK) használtuk. A különbségeket P-nél szignifikánsnak tekintettük 1. ábra Az iButtons által mért IBAT és maghőmérsékletet reggel 3 órára (8: 30–11: 30) átlagolták, amikor a hőmérséklet a nap legalacsonyabb volt, az este pedig 3 óra (7: 30–10: 30) ), amikor a hőmérséklet a kísérlet legutóbbi 9 napján a legmagasabb volt. Ezután az egyes patkányok átlagát minden csoportra átlagoltuk. Nem volt szignifikáns hatása a leptinnek a reggeli IBAT-ra (P 1. ábra). Hasonló minta volt jelen a maghőmérsékleten is, de a különbség nem érte el a szignifikanciát (P 1. ábra). Noha az összes mért zsírraktár súlya általában nagyobb volt 0,6 μg/nap leptinnel beadott patkányokban, mint a kontrollokban, ezek a különbségek nem érték el a szignifikanciát (az adatokat nem mutatjuk be). A vizsgálat végén mért szérum leptin nem különbözött a csoportok között (az adatokat nem mutatjuk be).
Napi testtömeg, napi táplálékfelvétel, hasított test zsírtartalom, maghőmérséklet és intrascapuláris barna zsír (IBAT) hőmérséklete az 1. kísérletben patkányoknak. Az adatok átlagértékek ± SE 11 vagy 12 patkányból álló csoportokra, akik PBS vagy leptin 4. kamrai infúzióját kapták napok.
A leptin szignálfehérjék mérése a hipotalamuszban és az agytörzs szövetében napi 5 napos 0,6 μg leptin infúzió után nem mutatott változásokat az agytörzs STAT3, PI3K vagy ERK1/2 foszforilációjában (2. ábra); és a PTP1B expresszió sem nőtt. A SOCS3 nem volt kimutatható olyan szinten, amely megbízhatóan számszerűsíthető volt. Meglepő módon a leptin infúziója a 4. kamrába a pPI3K kismértékű, de jelentős növekedését okozta a hipotalamusz szövetében. A STAT3 aktiválása a hipotalamuszban viszonylag nagy eltérést mutatott az egyes állatokban az egyes kezelési csoportokban, és bár a 4. kamra leptin infúziójának tendenciája volt a pSTAT3 növekedésére, ez statisztikailag nem volt szignifikáns (2. ábra). A leptin 4. kamrai infúzióját kapó patkányok STAT3 jelentős aktivációjának hiányát a magzati traktus (NTS) és a hipotalamusz íves magjában (ARC) az immunhisztokémia is megerősítette (3. ábra). Mivel az aktiválási szint alacsony volt azoknál a patkányoknál, amelyek 5 napig kapták az Alzet pumpákból a PBS vagy a leptin 4. kamrai infúzióit, a patkány szövetét is, amely 1 mg/kg leptin ip injekciót kapott 30 perccel a szövetgyűjtés előtt. a 3. ábrán a pSTAT3 detektálás érzékenységének pozitív kontrolljaként.
A STAT3, PI3K és ERK1/2 leptin szignálfehérjék foszforilációjának (p) Western-blot-analízise, valamint SOCS3 és PTP1B expressziója patkányok hipotalamuszában és agytörzsében 5 napig napi kamrai infúziót kapott PBS-ben vagy 0,6 μg leptinben. Az adatok 5 patkány átlagai ± SE.
A pSTAT3 immunhisztokémiai kimutatása a magnézis traktus (NTS) és a hipotalamusz íves magjában (ARC) patkányokban PBS 4. kamrai infúziót vagy 0,6 μg/nap leptint kapott 5 napig vagy 1 mg/kg ip injekcióval. leptin, mint pozitív kontroll. Az ARC vagy az NTS képei ugyanazon patkányoktól származnak egy adott kezelési csoport esetében. AP, területi postrema; CC, központi csatorna; SolM, a magányos traktus mediális magja; 3. V, 3. kamra; ArcM, a hipotalamusz mediális ARC-je; ME, mediális eminenciás. A felvételt követően a képeket a kontraszt és a fényerő érdekében állították be.
2. kísérlet.
Ebben a kísérletben az összes patkány, amely kis kamra infúziót kapott kis leptin dózisban, fogyott és kevesebbet evett a kísérleti időszak 12 napja alatt a kontrollhoz képest (4. ábra). A fogyás a zsír és a sovány szövet kombinációja volt (4. ábra). A leptin csökkentette az összes mért zsírraktár méretét, bár a napi 0,6 vagy 0,9 μg leptinnel beadott patkányok retroperitoneális zsírja nem volt szignifikánsan kisebb, mint a kontrolloké (1. táblázat). A máj energiatárolói szintén jelentősen kimerültek, a máj súlya, a lipid és a glikogén alacsonyabb volt a leptinben, mint a kontroll patkányokban (1. táblázat). A szérum leptint ~ 50% -kal, a szérum inzulint pedig 80% -kal csökkenték a leptinnel infúziós patkányokban a kontrollokhoz képest, de a leptin nem volt hatással FFA-ra, TG-re vagy glicerinre (az adatokat nem közöltük).
- Hogyan növelhető a sovány testtömeg 13 lépés (képekkel) - wikiHow Health
- Hogyan lehet növelni a korpás muffin egészséges táplálkozás SF kapu rosttartalmát
- Hogyan növelhető a sovány testtömeg 13 lépés (képekkel) - wikiHow Health
- Hogyan lehet növelni a testsúlyt 7 napos stílusban az életben
- Hogyan szerezz olyan testet, mint Jennifer Lopez - Hayley Pomroy táplálkozási tippek