A Plexin C1 idegi vezető receptor késlelteti a melanoma progresszióját
Tárgyak
Absztrakt
Bevezetés
A plexin receptorok az I. típusú transzmembrán fehérjék (A – D) családjai, amelyek kötődnek a szemaforinokhoz. 1, 2, 3 Plexin receptorokat azonosítottak a szétszóródási faktor receptorok extracelluláris doménjével való homológiájuk alapján, és citoplazmatikus doménjeik erősen konzerváltak. 1, 4 Noha nem rendelkeznek belső kináz aktivitással, a plexinek intracelluláris doménje tartalmaz egy belső Ras-GTPáz aktiváló (GAP) domént, ami a GTP GDP-vel való cseréjét eredményezi az M-Ras és az R-Ras. 5, 6, 7, 8 Egy nemrégiben készült jelentés azt mutatja, hogy a plexin receptorok szintén rendelkeznek Rap1-GAP aktivitással, különösen magas szintű Rap1-GAP aktivitással a Plexin C1-ben. 9 A Rho-guanin nukleotidcsere faktorok és Rho-GAP kötődési helyeit azonosították a plexin receptorok citoplazmatikus doménjében is, amelyek közvetítik a pleiotróp hatást a sejtek migrációjára, valamint a neuritok kinövését a Rho és Rac aktivitás szabályozásával. A 10, 11 szemaforinok egy nagy mennyiségű transzmembrán és szekretált fehérje, amelyek a plexin receptorok ligandumai, és amelyeket eredetileg az idegrendszerben azonosítottak. 12 A szemaforintól függően a neuropilin és a Plexin receptorokat, vagy önmagában a Plexin receptorokat is megkötik, hogy közvetítsék hatásukat.
Eredmények
A plexin C1 szabályozza a melanoma és a melanocyták migrációját
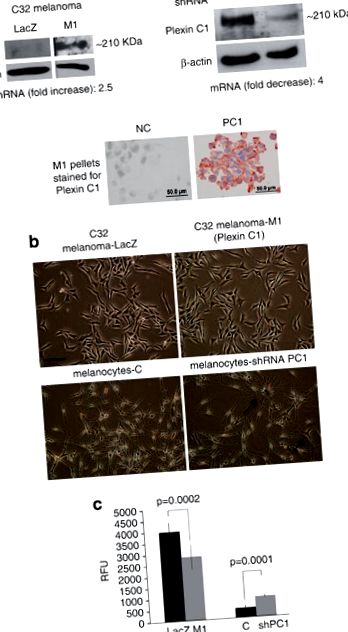
A plexin C1 gátolja a melanoma és a melanocyták irányított migrációját. (a) A LacZ és M1 sejtek összes sejt-lizátumát 7,5% SDS – PAGE-n oldottuk fel, és blotoltuk a Plexin C1-re. A várt méretű (~ 210 kDa) sávot detektáltuk az M1 sejtekben. A normál humán melanociták Western blotja, amelyet Plexin C1-re némítottunk, a Plexin C1 teljes elnémulását mutatja a nem cél kontrollokhoz képest. A plexin C1-t a membránon azonosítottuk a plexin C1-re festett M1 sejtek pelleteiben. ’NC’ = primer antitest helyett nem immun szérummal festett sejtek. (b) Plexin C1-t expresszáló melanoma sejtek és melanociták fáziskontraszt mikrográfiája, amelyekben a Plexin C1 elnémul. A Plexin C1 elhallgattatása növelte a dendricitást a melanocytákban, de a Plexin C1 bevezetése nem volt nyilvánvaló hatással a melanoma morfológiájára. Bár: ∼ 100 μm. (c) A Plexin C1-t (M1) expresszáló melanoma sejtek migrációja lényegesen kisebb volt a LacZ kontrollokhoz képest. Ezzel szemben azok a melanociták, amelyekben a Plexin C1 elnémult, szignifikánsan nagyobb migrációt mutatott a kontroll sejtekhez képest. Az eredmények négy külön kísérletre vonatkoznak. Mindegyik oszlop kilenc kút ± sdd átlaga. RFU, relatív fluoreszcencia egységek.
A plexin C1 szabályozza az R-Ras aktivációt a melanocitákban és a melanoma
A Plexin C1 belső R-Ras és Rap1 GAP aktivitással rendelkezik. 7, 9 Mivel az R-Ras és a Rap1 szabályozza a melanoma vándorlását, 27, 28, 29, 30 meghatároztuk, hogy a Plexin C1 szabályozza-e az R-Ras és a Rap1 aktiválódását melanomában. Az R-Ras és a Rap1 fehérje egyensúlyi állapota hasonló volt a melanocitákban és a melanómában, magasabb volt az R-Ras szintje a Rap1-hez képest (2A. Ábra). A többi vizsgált melanoma sejtvonal (WW165 és WM115) hasonló eredményeket mutatott (az adatokat nem mutatjuk be). A sejteket 24 órán át szérumban éheztettük (melanoma), vagy növekedési faktorok vagy szérum (melanocyták) nélkül táptalajban növesztettük, mielőtt a GTP-R-Ras affinitás-megkötését elvégeztük. Meglepő módon a melanocitákban szignifikánsan magasabb volt az aktív R-Ras szintje, mint a C32 melanómában (2B. Ábra). Még akkor is, ha a melanoma sejteket szérumot tartalmazó növekedési körülmények között elemezték, az aktív R-Ras szintje magasabb volt a melanocitákban (az adatokat nem közöljük). A plexin C1 expresszió fordítottan korrelált az R-Ras aktivációjával a melanocitákban és a melanomában. A Plexin C1 elnémítása megduplázta az aktív R-Ras szintjét a melanocitákban, a Plexin C1 expressziója pedig a melanómában az aktív R-Ras szintjét közel 40% -kal. Mindkét sejttípusban az R-Ras-GTP változásai szignifikánsak voltak (P 2. ábra
Mivel az R-Ras expressziója a szövetekben in vivo meglehetősen korlátozott, az R-Ras Plexin C1-függő szabályozásának jelentőségét melanómában tovább vizsgáltuk a beteg mintáiból származó melanocita elváltozások R-Ras expressziójának elemzésével. A nevi, az elsődleges melanoma és az áttétes melanoma immunhisztokémiai festett szöveti mikrosávai azt mutatták, hogy az R-Ras expressziója erősen korlátozott a bőrben, hiányzik az epidermiszben, a függelékekben, a simaizomban, a limfocitákban és az endothel sejtekben, és csak a rezidens bőr makrofágjaiban volt kimutatható. Valójában az R-Ras expressziója lényegében a melanocita sejtekre korlátozódott az elváltozásokon belül (2C. Ábra). Az R-Ras túlnyomórészt primer melanomában expresszálódott, amelyben a tumorok 40/77 (52%) expresszálta az R-Ras-t. Az R-Ras-t a melanóma plazmamembránján azonosították, különösen erős expresszióval a in situ (bőrön belüli) rekesz. Amikor az elsődleges melanómában az R-Ras expresszió intenzitási pontszámait (IS) megbontották kóros stádiumok szerint, a pT1 melanomák 73% -a expresszálta az R-Ras-t átlagosan 0,69 (± 0,44) IS-rel, szemben a pT2 és magasabb melanómákkal, amelyekben csak 11/38 (29%) expresszálta az R-Ras-t, átlagos intenzitási pontszám 0,28 ± 0,04 (P 3. ábra
A plexin C1 negatívan szabályozza a melanoma és a melanocyták szaporodását. (a) A Plexin C1-t (M1) expresszáló melanoma sejtek szaporodása csaknem 50% -kal csökkent a LacZ kontrollokhoz képest. Ezzel szemben a melanociták (‘MC’), amelyekben a Plexin C1 elnémult, jelentősen megnövekedett proliferációt mutatnak. A jobb oldali panel reprezentatív képeket mutat a Click-IT tanulmányokból. Az eredmények három külön kísérletre vonatkoznak. A sávok az Edu-pozitív sejtek átlagos százalékát mutatják ± s.d. (b) A sejteket 24 órán át bazális táptalajba helyeztük, majd a lizált és az összes sejtfehérjét 10% SDS – PAGE-n feloldottuk és foszforilezett Erk1/Erk2-re blottoltuk. Az aktív Erk1/Erk2 szintjeiben nem észleltek különbségeket. A szenzenciához kapcsolódó β-galaktozidáz (pH 6,0) expresszióját LacZ és M1 sejtekben számszerűsítettük. A p-galaktozidázra festett sejtek reprezentatív fénymező képei láthatók. A β-galaktozidáz-pozitív sejtek százalékos arányában nem volt szignifikáns különbség (P= 0,12). Az eredmények két kísérletre vonatkoznak. A nyilak a β-galaktozidáz pozitív sejteket jelzik; Bar ∼ 30 μ M .
A Plexin C1 késlelteti a tumor kialakulását egerekben
Vizsgálataink azt mutatják, hogy a Plexin C1 expressziója egy humán melanoma sejtvonalban gátolja a melanoma progressziójának két kulcsfontosságú lépését, a migrációt és a proliferációt, de ellenállóbbá teszi őket az apoptózissal szemben a PI3-kináz-függő Akt aktiváció révén. Annak megállapítása, hogy a Plexin C1 elnyomja-e a tumor progresszióját in vivo, a tumor képződését NOD.Cg-ben mértük-Prkdc szidás Il2rg tm1Wjl/SzJ egerek. A sejteket kétoldalúan injektáltuk az egerek szárába (n= 5), valamint a tapintható daganatok kialakulását és a tumor mennyiségét hetente dokumentálták. A Plexin C1 szignifikánsan késleltette a daganatok kialakulását a 2. és a 3. héten, összehasonlítva a LacZ-t expresszáló kontroll sejtek tumorjaival (P 5. ábra
A Plexin C1 késlelteti a tumor növekedését az egerekben. (a) A daganatok száma és daganatmennyisége (mm 2) az injekció után 1–5 hétig. Az M1 sejtekkel injektált egerekben a daganatok száma lényegesen kevesebb volt a 2. és a 3. héten; a tumor térfogata lényegesen kisebb volt a 2–4. héten. Az eredményeket átlagos tumorszám/térfogat ± s.d. (b) LacZ kontrollokból származó tumorokat hordozó egerek és Plexin C1 (M1) expresszáló sejtek fényképei. A nyilak a felszín alatti szubkután daganatokat mutatják az áldozat idején. Rúd ∼ 5 mm. A daganatok hematoxilinnal és eozinnal (H&E) festett szakaszait mutatjuk be. A nyilak a nekrózis/apoptózis területeit jelzik, amelyek kiterjedtebbek voltak a kontroll egerek daganataiban. A Plexin C1 immunocytokémiai (ICC) foltjai azt mutatják, hogy a Plexin C1 expresszió megmarad az M1 sejtek daganataiban (jobb alsó panel), a LacZ kontrollok tumoraiban pedig nincs Plexin C1 expresszió. Bar: μ 100 μ M. (c) A tumorok TUNEL-foltja több TUNEL-pozitív magot mutat a LacZ tumorokban, összehasonlítva az M1 sejtek tumorjaival. Fluoreszcens mikrográfiák reprezentatív képei. A metszeteket DAPI-val festettük a magok kiemelésére. Rúd = 1 mm.
Vita
A Plexin C1 azért érdekel minket, mert normál humán melanocitákban magas szinten expresszálódik in vitro és in vivo, szabályozza a melanocita adhéziót, és elveszik az alanyok melanomájában in vivo. A Plexin C1 expresszióját alacsony dózisú ultraibolya-B besugárzás szabályozza (személyes megfigyelések), ami arra utal, hogy a Plexin C1 UV-függő szabályozása elősegítheti a melanoma iniciációját vagy progresszióját. E munka célja annak a hipotézisnek a tesztelése volt, hogy a Plexin C1 elnyomja a melanoma progresszióját. Ebben a jelentésben megmutatjuk, hogy a Plexin C1 késlelteti a tumor progresszióját az egér xenograftjain és azon keresztül in vitro tanulmányok azonosították a Plexin C1 szerepét a melanoma proliferáció és migráció szabályozásában. Talán azért, mert a Plexin C1 nagy receptor, a C32 sejtekben csak szerény expressziót értünk el, és számos kísérlet ellenére más melanoma sejtvonalakban sem tudtunk expressziót elérni. A receptor azonban helyesen lokalizálódott a transzduktánsok plazmamembránján, és az expresszió megmaradt xenograft tumorokban. A melanocitákban a Plexin C1 elnémításának hatásainak elemzését kiegészítő vizsgálatokként végeztük a receptor túlzott expressziójára melanómában.
Kissé meglepő, hogy a normál melanociták magasabb R-Ras aktivitással rendelkeznek, mint a melanómában. Hasonló megfigyelések történtek, amikor a melanocitákat összehasonlították a WW165 melanoma sejtvonalával (publikálatlan megfigyelések). A melanocitákat növekedési faktorban gazdag táptalajban tenyésztik, amelynek hatása az eltávolítás után akár 24 órával is fennmaradhat, ami a nyugvó GTP-hez kötött R-Ras magas szintjét eredményezheti. Az R-Ras funkciója a melanocitákban még vizsgálandó. Bár az R-Ras-t a tenyészetben melanociták expresszálják, a bőr melanocitáiban nem detektálták in vivo, de primer melanoma transzformált melanocita sejtjeiben detektálták. Ezért az R-Ras expressziója bekövetkezhet az ultraibolya besugárzás által elindított stressz-válasz útvonalakra adott válaszként, vagy az onkogén transzformáció következtében. A melanociták erősen dendritikus sejtek, és az R-Ras aktivitás kritikus fontosságú az axon kinövése és a neuritképződés szempontjából. 36, 37 Feltételezzük, hogy a melanocitákban az R-Ras vagy a Rac és Rho szabályozásával, vagy a melanocita dendrit képződésének és fenntartásának kulcsfontosságú szabályozó molekuláinak, a β1-integirn affinitás modulálásával szabályozza a dendricitást. 38, 39, 40 A Plexin C1 tehát részben szabályozhatja a melanocita dendricitást az R-Ras aktivitás szabályozásával.
A Plexin C1 modellje a melanoma progressziójának korai szakaszában. (a) A Plexin C1 jelátvitelének javasolt modellje melanomában. A plexin C1 elnyomja az R-Ras aktivitást, amely várhatóan csökkenti a melanoma tapadását és migrációját. A proliferáció szintén csökken az Erk1/Erk2 független jelátviteli utakon keresztül. A PI3-kináz útvonal aktiválása azonban megsemmisíti a Plexin C1 tumor szuppresszív hatását, elősegítve a sejtek túlélését. (b) Az R-Ras és a Plexin C1 összehangolt növekedést (R-Ras) és csökkenést (Plexin C1) mutat az expresszióban a nevusban és a primer melanomában in vivo. Mivel a Plexin C1 elnyomja az R-Ras aktivitást a melanomában és a melanocytákban, a végső hatás várhatóan fokozott R-Ras-függő downstream fenotípusok lesz, beleértve a fokozott tapadást és a migrációt.
Anyagok és metódusok
Reagensek
Sejtek és sejttenyészet
Az újszülött fitymákat a University of Rochester Research Subjects Review Board irányelveinek megfelelően szereztük be, és ezek képezték a tenyésztett humán melanociták forrását. Az emberi melanocitákat Opti-MEM-ben (Gibco-BRL, Grand Island, NY, USA) tenyésztettük, amely 5% FBS-t (marha magzati szérum; Atlanta Biologicals; Lawrenceville, GA, USA), 10-4 M izo-butil-metilxantint ( IBMX), Anti-Anti (Gibco-BRL), 2,5 n M kolera-toxin, 0,1 m M dbcAMP, 25 ng/ml forbol-észter. A C32 primer humán melanoma sejteket az ATCC-től (Manassas, VA, USA) szereztük be, és tenyésztettük EMEM-ben (BioWhittaker, Walkersville, MD, USA) és L-glutaminban (Lonza, Walkersville, MD, USA) 10% FBS-sel, Anti- Anti- és 1 mM nátrium-piruvát (Invitrogen, Carlsbad, Kalifornia, USA). A C32 sejtek tartalmazzák a V600E mutációt a BRAF génben. 31
A Plexin C1-t expresszáló melanoma sejtek létrehozása
A Myc-DDK-ban lévő humán Plexin C1 nyílt leolvasási keretét (RC211396; Origene Technologies, Rockville, MD, USA) szubklónoztuk a pLVX-IRES-NEO biscistronális lentivírus vektorba (Clontech, Grand Island, NY, USA). Magas titer replikációképtelen VSV-G pszeudotípusú lentivírust készítettünk Lenti-X HT Packaging System segítségével 293 FT sejtben (Clontech). Lentivírussal társított p24 ELISA kitet (Cell Biolabs, San Diego, Kalifornia, USA) használtunk a vírus kvantitatív meghatározásához. A sejteket lentivírussal transzdukáltuk, a fertőzés sokasága 2,5 volt. A kontrollok üres vektorral transzdukált sejtekből álltak. A transzdukció után három nappal neomicinnel (Sigma Co.) szelektálunk.
A Plexin C1 elnémítása
Az emberi melanocitákat 105 sejtbe helyeztük egy hatlyukú lemezre. A sejteket 2,5-szeres fertőzéssel fertőztük MISSION Lentivirus részecskékkel (Sigma Co.), amelyek expresszálták az shRNS-t pLKO.1-CMV-neo-ban, és célba vették a humán Plexin C1-t (TRCN0000060645 klón). Lentivírusban nem célzott shRNS-sel (shRNS-NT) fertőzött sejteket használtunk kontrollként. A csendes sejteket neomicinnel szelektáltuk.
Western blottolás
A sejteket RIPA pufferben (150 mM NaCl, 1% NP-40, 0,5% DOC, 0,1% nátrium-dodecil-szulfát (SDS), 50 mM Tris-HCl) proteázgátlókkal (Boehringer Mannheim, Gmbt, Németország) és a fehérjét mennyiségileg meghatároztuk szarvasmarha szérum albuminnal (Bio-Rad Laboratories, Hercules, CA, USA). A fehérjét SDS – PAGE (poliakrilamid gélelektroforézis) géleken oldottuk fel és standard eljárásokkal blottoltuk. Az immunreaktív fehérjék vizualizációját fokozott kemilumineszcencia reakcióval hajtottuk végre (Pierce Chemical, Rockford, IL, USA).
A szöveti mikrosugarak felépítése és elemzése
A projekt megkapta az Institutional Review Board mentességet a Rochesteri Egyetem Human Subjects Review Board részéről: 4. kategória (45 CRF 46.101): a már meglévő adatok másodlagos felhasználása. Huszonhat jóindulatú nevi esetet, 77 bőrön elsődleges melanoma esetet és 37 metasztatikus melanoma esetet választottunk ki a Formalin-fixált, paraffinba ágyazott levéltári anyagból, az Erős Emlékhely Patológiai Osztálytól. Az egyes tárgylemezekből három reprezentatív területet választottunk, és mindegyik blokkból mintát vettünk az ezeknek a területeknek megfelelő 1 mm magokból. Minden nevus dermális nevus volt; az elsődleges melanomák a pT1 kóros állapotok voltak (n= 36), pT2 (n= 20), pT3 (n= 8) és pT4 (n= 13). A metasztatikus melanomák nyirokcsomókból (20/37), bőrből (9/37) és szilárd szervekből származnak, beleértve a tüdőt, a májat, a csontot és a beleket (8/37). Mindegyik festett magot fénymikroszkóp alatt vizsgálta az egyik szerző (GS). A festést számszerűsítettük hiányzó (0) vagy jelen lévő (1+) mennyiségként, és az intenzitás pontszám (IS) meghatározásához a három mag átlagát átlagoltuk. A 43 magot minimum 200 sejttel vizsgálták β-galatosidáz expresszióra fényes mező mikroszkóppal, és meghatározták a β-galatosidase expresszáló sejtek százalékos arányát.
Click-IT vizsgálatok
A festést PureCol bevonattal ellátott fedőlemezeken tenyésztett sejteken végeztük Click-IT assay-vel (Invitrogen). A click-IT-pozitív magokat 495 nm gerjesztési hullámhosszú szűrővel azonosítottuk. A pozitív magokat legalább 200 sejtben megszámoltuk, és a pozitív magok százalékát úgy határoztuk meg, hogy elosztottuk az összes maggal, DAPI ellenfestéssel azonosítottuk, és 341 nm gerjesztési hullámhosszú szűrővel néztük meg.
Migrációs vizsgálatok
Összességében 96 üreges fluorometriai migrációs vizsgálatokat vásároltunk a Millipore-tól (Billerica, MA, USA). Összesen 104 sejtet ültettünk egy 96-lyukú kamra felső üregébe, és hagytuk, hogy egy 8 μm-es membránon át 10% FBS-t tartalmazó táptalaj felé vándoroljanak. A migrációs vizsgálatokat három kútban végeztük.
A tumor szakaszok TUNEL festése
A formalinnal fixált paraffinba ágyazott tumorszelvények TUNEL felvételét a DeadEnd Flurometric TUNEL rendszer segítségével (Promega, Madison, WI, USA) detektáltuk. A TUNEL-pozitív magokat 495 nm gerjesztési hullámhosszú szűrő segítségével tettük láthatóvá. A metszeteket DAPI-val ellenfestettük, 341 n M gerjesztési hullámhosszú szűrővel néztük meg .
Egér xenograft vizsgálatok
NSG egerek (NOD.Cg-Prkdc szidás Il2rg tm1Wjl/SzJ) beszerzését a Jackson Laboratóriumtól (Bar Harbor, ME, USA) végeztük. Az egereket a Rochesteri Egyetem Orvosi Központjának állattartó intézményében helyezték el, a Rochesteri Egyetem Orvosi Központ laboratóriumi állatgyógyászati osztályának állatgondozási irányelveinek megfelelően. Összesen 2 × 106 melanoma sejtet injektáltunk szubkután mindkét egér mindkét oldalába (n= 5). A daganatok fejlődését heti tapintással ellenőriztük, és a daganatok hosszát és szélességét (mm-ben) féknyergekkel mértük. A daganat térfogatát 4π-nek (hossz × szélesség) számoltuk. Az egereket az injekció beadása után 5 héttel leöltük, a daganatokat összegyűjtöttük, megmértük és súlyoztuk.
Fordított transzkripciós polimeráz láncreakció és összehasonlító valós idejű PCR
A teljes RNS-t az RNeasy Mini Kit (QIAgen, Valencia, CA, USA) alkalmazásával izoláltuk. A Plexin C1 amplifikálására szolgáló primerek a következők voltak: fwd: 5′- IndexTerm AACCATTGCACTGCAACC-3 ’; rvs: 5′- IndexTerm GATTCCATCTTCAAGAATCACG-3 ′. A körülmények: 95 ° C, 3 perc (1 ciklus); 95 ° C 15 s, 54,5 ° C, 30 s, 72 ° C, 40 s (40 ciklus). A β-aktin amplifikálásához használt primerek a következők voltak: fwd: 5′- IndexTerm CACGCACGATTTCCCGCTCGG-3 '; rvs: 5′- IndexTerm CAGGCTGTGCTATCCTGTAC-3 ′. A körülmények 95 ° C, 3 perc (1 ciklus); 95 ° C 15 s, 54,5 ° C, 30 s, 72 ° C, 40 s (40 ciklus). A PCR-ciklus számát β-aktinná normalizáltuk, hogy az egyes mintákhoz korrigált relatív ciklusszámot kapjunk.
Az Fc-jelölt Sema7A tisztítása
Az Fc-jelölt Sema7A-t a korábban leírt módon 293FT sejtek transzfektánsainak tenyészet-felülúszójából (Invitrogen) izoláltuk. A rekombináns fehérje aktivitását Erk1/Erk2 aktivációval elemeztük normál melanocitákban (3. kiegészítő ábra).
Statisztikai analízis
Az átlagok közötti különbségeket kétfarkú Student-ek elemezték t-teszt. A P-érték
- Az edzés progressziója mikor; Hogyan lehet előrehaladni a súlyzós edzésen
- Fogyás előrehaladása - 90 kg-tól - Folyamatban
- Zóna diéta eszközök, tartalom; Források Súlycsökkenés útmutatás
- A TNT késlelteti az utolsó hajó lövését a csillag Eric Dane depressziója miatt - határidő
- Az α tumor nekrózis faktor meghatározó tényezője a patogenezisnek és a betegség progressziójának a mycobacteriumokban