A rövid távú koplalás hatása a máj és a vázizom lipid-, glükóz- és energia-anyagcseréjére egészséges nőknél és férfiaknál
Jeffrey D. Browning
* A Texasi Egyetem Délnyugati Orvosi Központ Belgyógyászati Klinikája, Dallas, TX, TX
† Belgyógyászati Klinika, A Fejlett Képalkotó Kutatóközpont, a Texasi Egyetem délnyugati orvosi központja, Dallas, Dallas, TX
Jeannie Baxter
† Belgyógyászati Klinika, A Fejlett Képalkotó Kutatóközpont, a Texasi Egyetem délnyugati orvosi központja, Dallas, Dallas, TX
Santhosh Satapati
† Belgyógyászati Klinika, A Fejlett Képalkotó Kutatóközpont, a Texasi Egyetem délnyugati orvosi központja, Dallas, Dallas, TX
Shawn C. Burgess
* A Texasi Egyetem Délnyugati Orvosi Központ Belgyógyászati Klinikája, Dallas, TX, TX
† Belgyógyászati Klinika, A Fejlett Képalkotó Kutatóközpont, a Texasi Egyetem délnyugati orvosi központja, Dallas, Dallas, TX
§ Farmakológiai Tanszék, a Texasi Egyetem Délnyugati Orvosi Központja, Dallas, Dallas, TX
Absztrakt
Az emberi anyagcsere elsődleges szubsztrátjai a glükóz és a zsírsavak (FA-k), amelyek relatív jelentősége az élelem rendelkezésre állásától függ (éhomi éhezés) (1, 2). Táplált állapotban az inzulin emelkedett, a glükóz felhasználása túlsúlyban van, és a szabad FA nettó áramlása folyik a májból a zsírszövetbe. A táplálékról az éhgyomorra történő átmenet során az inzulin leesik, ami a zsírszövetből szabad FA-k fokozott felszabadulásához vezet, amelyeket a sovány szövetek (pl. Izom és máj) használnak energiatermeléshez, vagy trigliceridként (TG) tárolnak. A koplalás és az éhezés során a lipolitikus felszabadulás mértéke szexuálisan dimorf módon meghaladja az egész test energiaigényét, a nőknél és férfiaknál a felszabadulás mértéke ∼64%, ∼50% -kal nagyobb, mint az oxidációs sebességnél (3). Ez szexuálisan dimorf lipid- és glükóz-anyagcserét eredményezhet az izmokban és a májban.
Jelen tanulmány a sovány szövet TG-tartalmának változásait vizsgálta egészséges férfiaknál és nőknél 48 órás böjt alatt, proton mágneses rezonancia spektroszkópiával (1 H-MRS), és ezeket a megállapításokat a biokémiai úton meghatározott szénhidrát-, lipid- és energia-anyagcsere változásaival hozta összefüggésbe. kalorimetrikus és MRS alapú stabil izotóp nyomjelző mérések. Több stabil izotóp nyomjelzőt alkalmaztunk a máj glükóztermelésének, glikogenolízisének, glükoneogenezisének és a trikarbonsav (TCA) ciklus metabolikus útjának éhomi reakciójának értékelésére. A nőket és a férfiakat külön megvizsgálták annak megállapítására, hogy az ismert szexuálisan dimorf éhgyomri lipid-anyagcsere (16) kiterjed-e a sovány szöveti lipidfelhalmozódásra és az éhgyomri anyagcserére.
KUTATÁSI TERVEZÉS ÉS MÓDSZEREK
Résztvevők
Egészséges személyeket toboroztak tanulmányozásra a Texasi Egyetem délnyugati orvosi központjában. A vizsgált populáció kilenc nőből és kilenc férfiból állt, akiknek jellemzőit a Asztal 1 . A vizsgált nők mindegyike premenopauzás volt, kettő orális fogamzásgátlót szedett. A jegyzőkönyvet és a beleegyezési űrlapot az UTSW Intézményi Felülvizsgálati Testülete hagyta jóvá, és minden résztvevő írásos tájékozott beleegyezést adott a beiratkozás előtt.
ASZTAL 1.
A beiratkozott alanyok jellemzői nemek szerint
| Nők (n = 9) | Férfiak (n = 9) | P érték | |
| Kor (év) | 24. (23–42) | 21 (21–23) | 0,189 |
| Nemzetiség/faj (n) | |||
| Nem spanyol fehér | 6. | 7 | 0,599 |
| Nem spanyol fekete | 2 | 1 | 0,527 |
| Spanyol | 1 | 0 | 0,303 |
| ázsiai | 0 | 1 | 0,303 |
| Testtömeg-index (kg/m) | 27. (22–32) | 25 (23–27) | 0,427 |
| Glükóz (mg/dl) | 86 (84–90) | 90 (85–93) | 0,907 |
| Összes koleszterin (mg/dl) | 167. (163–184) | 164. (155–194) | 0,489 |
| HDL-c (mg/dl) | 60 (52–64) | 40 (37–49) | 0,021 |
| LDL-c (mg/dl) | 91 (83–109) | 119. (93–135) | 0,343 |
| Trigliceridek (mg/dl) | 67 (58–79) | 52 (50–94) | 0,604 |
| AST (U/l) | 19. (17–22) | 23. (19–24) | 0,176 |
| ALT (U/l) | 16. (11–20) | 20 (18–22) | 0,064 |
Az értékek mediánok, zárójelben interkvartilis tartomány található. A párosítatlan t-próbával és a Chi-négyzet próbával elemzett adatok. ALT, alanin-aminotranszferáz; AST, aszpartát-aminotranszferáz; HDL-c, nagy sűrűségű lipoprotein koleszterin; LDL-c, alacsony sűrűségű lipoprotein koleszterin. Konverziók: trigliceridek, HDL-c és LDL-c (mg/dl) × 0,02586 = mmol/l; glükóz (mg/dl) × 0,05551 = mmol/l.
Tervezés
A résztvevőket felvették a Klinikai és Transzlációs Kutatóközpontba (CTRC), ahol 48 órán keresztül böjtöltek. A 0. napon az alanyok 12:00 órakor saját készítésű ebédet ettek, és 16:00 órakor vették fel őket a CTRC-be. Az alanyok a 0. napon történő felvétel időpontjától a 2. nap 12:00 óráig böjtöltek. 08:30 és 09:00 (1. és 2. nap) között minden alanyon átesett a légzési hányados mérése Delta Trak II közvetett kaloriméterrel (Sensormedics (Yorba Linda, Kalifornia). A máj és az intramyocelluláris TG-tartalmat a felvételkor és az 1. és a 2. napon 12:00 órakor mértük. A résztvevők egy csoportja (nők = 6, férfiak = 7) további vizsgálatokon ment keresztül stabil izotóp nyomjelzők alkalmazásával. 22:00 és 09:00 (0–1. Nap) között az alanyok két nyomjelzőt kaptak szájon át: [U-13 C] propionátot (~ 1200 mg) 08: 30-kor és 70% -os [2 H] víz (5 g/kg testvíz, a férfiak testsúlyának 60% -ában, a nőknél a testtömeg 50% -ában számolva) 22: 00-kor, 02: 00-kor és 06: 00-kor. Az alanyok a böjt hátralévő részében ad libitumban 0,5% [2H] vizet itattak. Az alanyoknak ezután intravénásan 2,25 mg/kg bolus [3,4-13 C] glükózt adunk, majd 2 órás infúziót (0,0225 mg/kg/perc). Az infúziós periódus végén 50 ml-es vérvétel történt. Ezeket az eljárásokat a böjt 2. napján megismételtük, kivéve az éjszakai töltést 70% [2H] vízzel.
Étrendi makrotápanyagok bevitele koplalás előtt
Az étrendi nyilvántartásokat a vizsgálat előtt 3 napig gyűjtötték, és a CTRC dietetikusa értékelte. Az étrend 48% (tartomány: 43-50%) szénhidrátból, 38% (tartomány: 37-40%) zsírból és 15% (tartomány: 14-17%) fehérjéből állt. Az étrendi makrotápanyagok összetétele összehasonlítható volt a nemek között; a férfiaknál azonban a napi energiafogyasztás szignifikánsan nagyobb volt a nőknél (2825 [tartomány, 2654-3140] vs. 1 563 [1424-2100] kcal/nap; P = 0,010).
Izotópok és egyéb anyagok
Hetvenszázalékos [2H] vizet és 99% -os [U-13C] propionátot (nátriumsó) kaptunk a Cambridge-i izotópoktól (Andover, MA). Sterilitást és pirogén tesztelt [3,4-13 C] glükózt az Omicron Biochemicals, Inc.-től (South Bend, IN) szereztünk be. Egyéb általános reagenseket a Sigma-tól (St. Louis, MO) vásároltunk.
Vérminták
4 óránként minden alanyból 3 ml vért vettek. A vért nem heparinizált, EDTA-tartalmú csövekbe gyűjtöttük, és azonnal centrifugáltuk a plazma izolálásához. A mintákat azonnal lefagyasztották és -80 ° C-on tartották, majd egyszer felolvasztották és elemezték. A plazma glükóz, koleszterin, TG és nagy sűrűségű lipoprotein koleszterin (HDL-c) koncentrációit Vitros 250 spektrofotometrikus analizátorral (Ortho-Clinical Diagnostics, Rochester, NY) határoztuk meg. Enzimhez kapcsolt immunszorbens vizsgálati készleteket használtunk a plazma inzulin, leptin és adiponektin koncentrációk (Millipore, Billerica, MA), valamint a plazma-mentes zsírsav (FA) koncentrációk mérésére (Wako Chemicals USA, Richmond, VA). A plazma ketontesteket kereskedelmi készlet (Wako Chemicals, Richmond, VA) alkalmazásával határoztuk meg. Egyéb kémiai vizsgálatokat egy külső laboratórium végzett (Quest Diagnostics, Madison, NJ).
A máj glükóz- és energia-anyagcseréjének mérése
A plazmát perklórsavval extraháltuk, és a glükózt a korábban leírtak szerint tisztítottuk (17, 18). A tisztított plazma glükózt 2-izopropilidén-glükofuranózzá (monoaceton-glükózzá) alakították át 2H- és 13C-NMR-analízis előtt, amint azt korábban részletezték (17–19). A mintákat 14,1 Tesla Varian Inova spektrométeren (Varian Instruments, Palo Alto, CA) elemeztük, amely 3 mm-es szélessávú szondával volt felszerelve 92 MHz-re 2 H-spektrumra vagy 150 MHz-re 13 C-spektrumra hangolva. A rezonancia területeket az ACD/Labs 12.0 (Advanced Chemistry Development, Inc., Toronto, Ontario, Kanada) alkalmazásával határoztuk meg.
A H2, H5 és H6 glükóz relatív deutérium-dúsulásait 2H-NMR-rel értékeltük, és ezeket az értékeket használtuk a glükoneogenezis és a glikogenolízis frakcionális hozzájárulásának meghatározásához az endogén glükóztermeléshez, amint azt korábban részleteztük (17). A TCA-ciklust metsző utakat 13C-NMR-analízissel értékeltük az [U-13C] propionát metabolizmusának eredményeként képződött glükóz C2 izotopomerek (20). A modellel kapcsolatos feltételezésekről korábban beszámoltak (21). Az endogén glükóztermelést a [3,4-13 C] glükóz hígításával mértük, a korábban leírtak szerint (22). A 2H-NMR-rel mért frakcionált glikogenolízist és glükoneogenezist piruvát-karboxiláz (PC)/foszfoenol-piruvát-karboxi-kináz (PEPCK), piruvát-ciklus és glükoneogenezissel normalizáltuk a 13 C-NMR-rel mért TCA-ciklus fluxusához és az endogén glükóztermelés sebességéhez (µmol/kg/perc) használtuk az abszolút fluxusok kiszámításához ezen utak mindegyikén (23).
A máj és az intramyocelluláris TG mérése
Statisztikai analízis
Máj TCA ciklus aktivitás koplalással
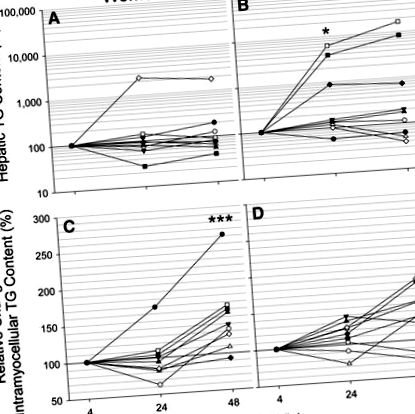
A rövid távú éhezésnek a májban a szubsztrát oxidációjára gyakorolt hatásának meghatározásához a máj TCA-ciklus aktivitását a glükóz 2 H és 13 C izotopomer analízisével értékeltük (28). A markáns éhomi ketózissal szemben és az FA rendelkezésre állásának növekedése ellenére a TCA ciklus forgalma csökkent az éhezés során (P = 0,021) (3A. Ábra, D). Ráadásul a böjt alatt a nemek között nem volt különbség a TCA-ciklus aktivitásában, még akkor sem, ha figyelembe vettük a sovány testtömeg különbségeit.
VITA
Jelen tanulmány eredményei emlékeztetnek az éhomi anyagcsere különbségére a hím C57BL/6J és SJL/J egerek között, amelyeket korábban Guan és mtsai. (6) A nőkhöz hasonlóan az SJL/J egerek is rezisztensek voltak a koplalás okozta máj TG-k növekedésére. Ez az ellenállás annak köszönhető, hogy a vázizomzat koplalás közben fokozza a szabad FA felvételét és oxidációját, megkímélve a májat az FA túlterhelésétől. A FA vázizmok általi fokozott felvételével és tárolásával összhangban a nők koplalással jelentősen növelték az intramyocelluláris TG-tartalmat, amelyet férfiaknál nem figyeltek meg (3. ábra). Kimutatták, hogy a nők vázizmaiban magasabb a zsírsav-transzporter (FAT/CD36) és a β-oxidációs enzim fehérjetartalma (29, 30). Hasonlóképpen Mittendorfer és mtsai. (31) szignifikánsan nagyobb sovány szövetmentes FA felvételt és oxidációt mutattak képzetlen nőknél a testmozgás okozta lipolízis során. Csakúgy, mint az SJL/J egereknél, a máj TG-tartalmának a koplalás nélküli növekedése a nőknél részben azzal magyarázható, hogy a csontvázizomzat nagyobb képességgel rendelkezik a keringő FA felvételére és feldolgozására.
A glükoneogén fluxust fokozza a máj lipidoxidációja (14, 15) glükoneogén kofaktorok (azaz ATP, NADH) termelése és a PC alloszterikus aktiválása révén acetil-CoA-val (45, 46). Úgy tűnik azonban, hogy a glükoneogén fluxus oxidatív anyagcserével történő megindulása szigorúan a TCA-ciklus oxidációjára vonatkozik, nem pedig önmagában a β-oxidációra (13). Annak ellenére, hogy az éhezés során fokozódott a β-oxidáció és a masszív ketózis, a TCA-ciklus aktivitásának elnyomása (3D. Ábra) a PC-PEPCK fluxus csökkenésével járt (3A. És 3C. Ábra). 3C). Csak a piruvát ciklus egyidejű csökkenése akadályozta meg a glükoneogenezis csökkenését. A piruvát ciklus hozzájárul az almasav enzimtől és/vagy a piruvát kináztól (21). Mindkettő fontos a májban, de az almas enzimaktivitás nem reagál a táplálkozási állapotra (47), míg a piruvát-kináz aktivitása az éhezés során négyszer elnyomódik (48). Ettől függetlenül a szubsztrát ciklus a metabolikus szabályozás fontos formáját biztosítja a gyorsan változó környezeti körülmények között (49). Ebben az esetben az éhező embereknél a csökkent máj piruvát-ciklus támogathatja az anyagcsere-puffer rendszert, hogy biztosítsa a PEP bőséges rendelkezésre állását, és ezáltal a glükoneogén potenciált táplálkozási állapottól függetlenül.
Összegzésképpen elmondható, hogy a sovány szövet TG-tartalma szexuálisan dimorf módon, rövid távú éhezéssel nőtt. A nőknek az éhgyomri okozta máj TG-tartalom növekedésével szembeni ellenállása összefüggésben lehet a plazma-mentes FA tompa indukciójával az elhúzódó koplalás során, valamint a plazma-FA-k vázizmok általi felvételére és tárolására való fokozott hajlandósággal. Eredményeink a férfiak nagyobb érzékenységét jelezhetik a máj TG-k patológiás felhalmozódása iránt, amely potenciális magyarázatot adhat a máj steatosisának nagyobb gyakoriságára a férfiak körében (35). Hasonlóképpen, ezek az eredmények segíthetnek megmagyarázni a nem oxidatív FA metabolizmus (3) közötti különbségeket a nők és a férfiak között. Ezzel szemben nem figyeltek meg nemi különbségeket a máj és az egész test glükóz- vagy energia-anyagcseréjében. Ez a megállapítás arra enged következtetni, hogy a máj FA metabolizmusában a fő nemi különbségek a reészteráció és/vagy a lipoprotein export szintjén vannak. A rövid távú éhezés nem vezetett a glükoneogenezis megnövekedett sebességéhez, és a teljes endogén glükóztermelés csökkent a böjt alatt csökkent glikogenolízis következtében. Az éhomi ketózis során a csökkent TCA ciklus fluxus korlátozni látszik a PC-PEPCK fluxust, de a glükoneogenezist megkímélte a csökkent piruvát ciklus, amely a glükoneogenezis potenciálisan fontos metabolikus kontrollpontja.
Köszönetnyilvánítás
A szerzők köszönetet mondanak Sonya Riosnak, Carol Parcelnek és Janet Jerrow-nak az UT Southwestern Fejlett Képalkotó Kutatóközpontjától, akik kritikus támogató munkatársak voltak a tanulmány elvégzésében, valamint Jay D. Hortonnak a kézirat kritikai felülvizsgálatáért.
- Az étcsokoládé-fogyasztás hatása a lipidprofilra, az éhomi vércukorszintre, a májenzimekre,
- A ketogén étrend az egészségért A ketogén étrend hatása a kortizol anyagcserére
- Az elhízás kódja Böjtölheti vissza az anyagcserét Jane Langille
- Az elhízással és diszlipidémiával járó károsodott éhomi glükóz jellemzői a
- A CUKORBETEGSÉGRE VONATKOZÓ ÚTMUTATÓ AZ INTERMETTENT FASTING Diabetic Izom; Fitness