A sarlósejtek génterápiája közelebb kerül, ahogy a tudósok tisztázzák a váratlan akadályokat
2016. szeptember 7
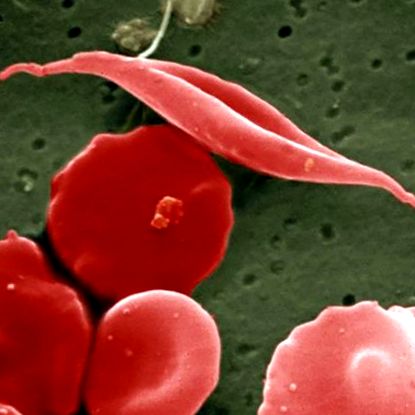
Sarlósejtes betegségben szenvedő betegeknél a vörösvérsejtek betegesen félholdra görbülnek. UCL Medical School/Wellcome Images
A kutatók felszámolták a génterápia klinikai vizsgálatának utolsó tudományos akadályát a sarlósejt-betegség gyógyítása érdekében - jelentették kedden, remélve, hogy a jövő év elején megkezdik a betegek beíratását. De kitértek egy golyó elől.
Az új, egereken végzett tanulmány a génterápia néha vészterhes kockázatával foglalkozott: a nehézség csak egyetlen dolog megváltoztatására vonatkozik, amikor egy sejt DNS-ét módosítják. A hibás változattal rendelkező betegekbe egy egészséges gén beillesztésére irányuló korábbi erőfeszítések olyan tragédiákhoz vezettek, mint egy fiú, aki ritka leukémiás formát kapott, miután egy gén immunrendszeri betegségének gyógyítására irányult, és akaratlanul aktiválta a rákot okozó DNS-t. És egy gén kiütése a betegség okozó hatásainak kiküszöbölésére szintén feltételezheti az egészséges sejtek működését.
A Dana-Farber/Bostoni Gyermekrák és Vérbetegségek Központjának kutatói felfedezték, hogy nekik is komoly, nem szándékos következményekkel járó probléma merült fel, amikor megpróbáltak kifejleszteni egy génterápiát a sarlósejt számára, amely évente mintegy 300 000 csecsemőt érint világszerte. Ebben az örökletes betegségben a vörösvérsejtek betegesen félholdra görbülnek, és hemoglobinmolekuláik nem tudják jól szállítani az oxigént. A betegek vérszegénységben, fertőzésekben, szövetkárosodásokban, stroke-ban, gyötrő fájdalomban, sőt végzetes szervi elégtelenségben szenvednek.
Az ötlet az volt, hogy egy gént célozzanak meg, hogy a betegek folyamatosan termelhessék az emberi magzatok és újszülöttek által termelt hemoglobin formát. Normális esetben az emberek születésük után abbahagyják ennek a magzati hemoglobinnak a gyártását. De a sarlósejteket okozó mutációval rendelkező embereknek valójában nem alakul ki a betegség; testük továbbra is a magzati hemoglobint termeli, amely egészséges és hozzáértő az oxigén szállításához, ahelyett, hogy felnőttkori hemoglobinra váltanának,.
A megoldás egyértelműnek tűnt: blokkolja a magzati hemoglobin-felnőtt hemoglobin kapcsolót, amelyet egy 2008-ban felfedezett BCL11A nevű gén vezérel, és a sarlósejtes mutációval rendelkező emberek nem kapják meg a betegséget.
50 éve tudjuk, hogy mi okozza a sarlósejtes betegséget. Hol a gyógymód?
Évtizedek után, amikor a sarlósejtekkel szemben nem történt előrelépés, a tudósok jó úton haladtak ebben. A BCL11A letiltása laboratóriumi egerekben hagyta, hogy az állatok továbbra is magzati hemoglobint termeljenek. A Dana-Farber/Children’s Dr. David Williams által vezetett tudósok ezután további egérkísérleteket indítottak egy olyan génterápia klinikai vizsgálata előtt, amely bekapcsolta az egészséges magzati hemoglobin termelését.
Csapatával eltávolította az egerekből a vér őssejtjeit (amelyek mindenféle vérsejtet termelnek), majd a genetikailag megváltozott sejteket visszahelyezték az állatokba. Ha minden jól menne, a megváltozott egérsejtek előállítanák természetes otthonukat - a csontvelőt -, és ott üzletet létesítenének, és végtelen mennyiségű vörösvérsejtet termelnének egészséges magzati hemoglobinnal, nem pedig abnormális felnőtt hemoglobinnal.
Három évvel ezelőtt Williams azonban sokkot kapott: a BCL11A kiütése nem csak a magzat-felnőtt hemoglobin-kapcsolót blokkolta. A vér őssejtjeit is megakadályozta abban, hogy sikeresen „beültessék” magukat vagy megfogják a velőt. "Amikor lebuktattuk a BCL11A-t, az állatok nagyon gyorsan elvesztették ezt a beültetést" - mondta Williams. - Teljesen váratlan volt.
És ez nagy probléma volt. Ez azt jelentette, hogy a magzati-felnőtt hemoglobin BCL11A gént letiltó génterápiát kudarcra ítélték. A géntechnológiával módosított vér őssejtjei valóban egészséges magzati hemoglobint termelnek. De miután a csontvelőben telepedtek le, elsorvadtak, mint egy orchidea, amelyet a Szahara homokjába ültetnek át. Ez azonban nem csak magát a génterápiát veti végbe. Ez súlyos problémákat is okozhat a vér fejlődésében, és ezt a toxikus hatást senki sem látta előre.
Kiderült, hogy a BCL11A-nak a magzati hemoglobin termelésének kikapcsolásán túl sok munkája van. Ez a gén egy transzkripciós faktor, vagyis más géneket kapcsol be. Attól függően, hogy milyen más molekulákkal társul, a BCL11A aktiválja az őssejt beültetéséhez elengedhetetlen géneket is. A Journal of Clinical Investigation folyóiratban megjelent új tanulmány előtt „egyáltalán nem volt utalás erre a szerepre” - mondta Williams. A fogyatékkal élő BCL11A-val rendelkező őssejtek, amikor visszaültették őket egerekbe, "két-négy hét alatt eltűntek ahelyett, hogy örökké tartottak volna".
A génterápia, amely olyan transzkripciós faktorra irányul, mint a BCL11A, „egy kicsit a Pandora doboza, mivel nem tudja, milyen egyéb funkciókra fog hatni” - mondta Dr. Mitchell Weiss, a St. Jude Gyermekkutató Kórház, aki nem vesz részt az új tanulmányban.
Legalább egy vezető génterápiás vállalat haladt egy olyan klinikai vizsgálat felé, amely letiltotta a BCL11A-t; szinte biztosan kudarcot vallott volna. Williams rábeszélte a vállalatot, hogy vonuljon vissza, valószínűleg elhárítva egy újabb sikertelen génterápiás vizsgálatot.
A génterápia nagy reményei egyenetlen klinikai eredményekből fakadnak
Az elmúlt három évben Williams csapata azon dolgozott, hogy megteremtse a BCL11A elnémításának módját csak a vörösvérsejtek prekurzoraiban, és nem minden vérsejtben. Sikerült nekik. Négy sarlósejtes páciens sejtjei elnémították a BCL11A-t (a „rövid hajtű RNS” nevű molekulán keresztül), és folyamatosan termelték a magzati hemoglobint, kiszorítva a sarló felnőtt verziót.
A BCLA11A-némító terápiával kezelt egerek vörösvérsejteket termeltek, amelyek legalább 80% -ban egészséges magzati hemoglobinnal rendelkeztek, nem pedig sarló felnőtt hemoglobinnal. Ez több mint elegendő a sarlósejt gyógyításához. És ami kulcsfontosságú, mivel a BCL11A csak az egerek egyes sejtjeiben volt KO, a vér őssejtjei sikeresen felállították az egerek csontvelőjét.
Weiss szerint Williams eredményei "megmutatták, hogy pontos lehetsz a [BCL11A] szuppressziójának célzásában", nyilvánvalóan kiküszöbölve a toxikus mellékhatásokat. "Közeledünk a sikerhez" a sarlósejt génterápiájának megtalálásában - mondta. A versenyző csapatok legalább három különböző megközelítést követnek - tette hozzá, beleértve a CRISPR genomszerkesztést is, amint kollégáival a múlt hónapban beszámoltak.
"Úgy gondoljuk, hogy ezek az adatok lehetővé teszik számunkra, hogy bekerüljünk a sarlósejtek első emberi génterápiás vizsgálatába" ezzel a megközelítéssel - mondta Williams. Az Élelmiszer- és Gyógyszerügyi Hivatal előzetes rendben megadta a BCL11A génterápia biztonságosságát felmérő próbát, és Williams arra számít, hogy a jövő hónapban az FDA végső jóváhagyását kéri.
A BCL11A-elnyomó molekulát a Bluebird Bio engedélyezte, amely fizeti annak előállítását. Williams támogatást kért az Országos Egészségügyi Intézettől a tárgyalás lebonyolításához, és reméli, hogy egy emberbarát lép fel a szükséges további finanszírozás biztosítása érdekében.
- Diéta és sejtterápia
- A Helicobacter pylori fertőzés és a nyugati étrend hatása a migrén génjére, a sejtekre és a szövetekre
- Exkluzív enterális táplálkozás (EEN) képletalapú étrend NiMBAL NIMBAL Therapy Az IBD-t diétával kezelik
- A testmozgás felülkerekedhet az elhízás génjén
- Coronavirus Hogyan vásároljunk egészséges ételeket, amelyek két hétig tartanak