A zsírszövet-változatlan NKT sejtek a szabályozó citokintermelés révén védenek az étrend okozta elhízás és anyagcserezavarok ellen.
Lydia Lynch
1 Hematológia/Onkológia, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
2 Oktatási Kutatóközpont, St. Vincent Egyetemi Kórház, Dublin, Írország
6 Biokémiai és Immunológiai Iskola és Egészségtudományi Iskola, Dublin, Trinity College, Írország
Michael Nowak
1 Hematológia/Onkológia, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Bindu Varghese
1 Hematológia/Onkológia, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Clark igazságszolgáltató
1 Hematológia/Onkológia, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Andrew E. Hogan
2 Oktatási Kutatóközpont, St. Vincent Egyetemi Kórház, Dublin, Írország
Vasillis Toxavidis
1 Hematológia/Onkológia, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Steven P. Balk
1 Hematológia/Onkológia, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Donal O’Shea
3 Endokrinológiai Osztály, St. Vincent Egyetemi Kórház, Dublin, Írország
4 Conway Intézet, University College Dublin, Írország
Cliona O’Farrelly
6 Biokémiai és Immunológiai Iskola és Egészségtudományi Iskola, Dublin, Trinity College, Írország
Mark A. Exley
1 Hematológia/Onkológia, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA
Társított adatok
Összegzés
Az invariáns Natural Killer T (iNKT) sejtek evolúciósan konzervált veleszületett T-sejtek, amelyek befolyásolják a gyulladásos reakciókat. Kimutattuk, hogy az iNKT sejtek, amelyeket korábban ritkának gondoltak a huamns-ban, erősen gazdagodtak az emberi és az egér zsírszövetében, és hogy a zsírszövet elhízás során tágul, az iNKT sejtek kimerültek, korrelálva a proinflammatorikus makrofág infiltrációval. Az egerek és az emberek súlycsökkenése után helyreállt az iNKT sejtek száma. Azoknál az egereknél, amelyekből hiányzott az iNKT sejt, nagyobb volt a súlygyarapodás, nagyobb az adipociták száma, a zsíros máj és az inzulinrezisztencia volt a magas zsírtartalmú étrendben. Az iNKT sejtek adoptív transzferje elhízott egerekbe, vagy az iNKT sejtek in vivo aktiválása lipid ligandumukkal, alfa-galaktocilceramiddal csökkent a testzsír, a trigliceridek, a leptin, a zsírmáj és javult az inzulinérzékenység a Th2 sejt típusú citokin termelés révén, zsírszármazékokból származó iNKT sejtek révén . Ez a megállapítás rávilágít az iNKT sejt-célzott terápiákban rejlő lehetőségekre, amelyek korábban emberekben bizonyítottan biztonságosak, az elhízás és következményeinek kezelésében.
Bevezetés
Az a felfedezés, miszerint a TNFα fokozottan elhízott és korrelált az inzulinrezisztenciával, alapvető jelentőségű megállapítás volt, amely 1993-ban indította el a gyulladás és az immunmetabolizmus területét (Hotamisligil et al., 1993). Ma elfogadott, hogy a gyulladás, különösen magában a zsírszövetben (Hotamisligil, 2006; Hotamisligil és mtsai, 1993; Nishimura és mtsai, 2008; Shoelson és mtsai, 2006), kritikusan összefügg az elhízással és az azt kísérő anyagcserezavarokkal, ideértve a csökkent glükóz toleranciát, az inzulinrezisztenciát, a máj steatosisát, a dyslipidaemiát és végül a 2-es típusú cukorbetegséget (Reaven, 1988). A zsírszövet immunológiailag dinamikus, rezidens CD4 + (Winer et al., 2009) és CD8 + T sejtekkel (Nishimura et al., 2009), T szabályozó (Treg) sejtekkel (Feuerer et al., 2009), B sejtekkel ( Winer és mtsai, 2011) és makrofágok (Lumeng és mtsai, 2007; Weisberg és mtsai, 2003; Wentworth és mtsai, 2010), amelyek mindegyikéről kimutatták, hogy pozitív vagy negatív szerepet játszanak a metabolikus diszregulációban és a fejlődésben az elhízás (Feuerer et al., 2009; Lumeng et al., 2007; Nishimura et al., 2009; Wentworth et al., 2010; Winer et al., 2011; Winer et al., 2009).
Eredmények
Az iNKT sejtek zsírban és májban fogynak az elhízás kialakulása során
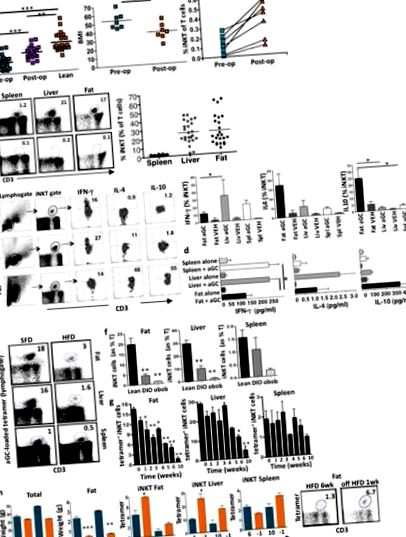
Korábban kimutattuk, hogy az iNKT sejtek emberi zsírban gazdagodnak, de elhízás miatt kimerültek (Lynch et al., 2009). Mivel a bariatriás műtét után több időpontban nem lehetett zsírszövetet kapni a betegektől, megvizsgáltuk az emberi perifériás vért és megállapítottuk, hogy az elhízott betegek keringésében az iNKT-sejtek is csökkentek a sovány, egészséges, életkornak megfelelő kontrollokhoz képest (ábra (1a). A keresztmetszeti elemzés azt mutatta, hogy a keringő iNKT sejtek száma megnövekedett azokban az elhízott betegeknél, akik fogyást szenvedtek a Roux-en-Y gyomor bypass (RYGB) műtét után, szemben az elhízott betegek RYGB előtti műtétjével, bár az iNKT sejtek továbbra is csökkentek a soványhoz képest kezelőszervek (1a. ábra). Ezután a betegek egy csoportját (n = 7) követtük hosszanti irányban az RYGB előtti és utáni műtét során, akiknek a testtömeg-indexe (BMI) a III. Fokozatú elhízásról (átlagos BMI> 50 kg/m 2) a II. Fokozatú elhízásra (átlagos BMI) csökkent. 35–40 kg/m 2) 18 hónappal a műtét után (1a. Ábra). A perifériás iNKT sejtek száma minden egyes betegnél növekedett súlycsökkenés után. (1a. Ábra).
A HFD-t 6 hét vagy 10 hét elteltével egy hétig standard zsírtartalmú étrend (SFD) váltotta fel, ami csak csekély csökkenést okozott az össztömegben, de a zsírpárna súlyának drámai csökkenését okozta (1h ábra). Miután 6 hét HFD után SFD-re váltott, a zsírban és a májban jelentősen megnőtt az iNKT sejtek száma; Az iNKT szintek is növekedni kezdtek, miután 10 hét HFD után átálltak az SFD-re (1h ábra). Ezek az eredmények azt mutatják, hogy az egér és az emberi iNKT válasza az elhízásra és a fogyásra hasonló.
Az iNKT sejtek hozzájárulása az elhízás kialakulásához
Ezt követően feltártuk azt a hipotézist, miszerint az iNKT sejtek megvédhetnek az elhízástól és a kapcsolódó metabolikus következményektől. Jα18-hiányos egereket, amelyekből hiányoznak az iNKT sejtek, de egyébként normális immunrendszerrel rendelkeznek, HFD-vel etették HFD-vel vagy SFD-vel az életkornak megfelelő súlyú egerek mellett. A Jα18-hiányos egerek szignifikánsan nagyobbak voltak a HFD-fertőzés előtt. Szintén lényegesen nagyobb súlyt kaptak, mint a súlyú egerek HFD-n, és lényegesen nagyobb zsírpárnákkal rendelkeztek, míg a sovány tömeg változatlan volt (2a. Ábra) A táplálékbevitel hasonló volt a Jα18-hiányos és a tömeges egerek között (2b. Ábra). Az adipociták nagyobbak voltak a Jα18-hiányos egerekben, mint a HFD-ben lévő tömeg (2c. Ábra, d). Ezenkívül a HFD-n lévő Jα18-hiányos egereknél nagyobb volt a zsírlerakódás a májban (2e. Ábra), megemelkedett az éhomi vércukorszint, csökkent a GTT és megnövekedett inzulinrezisztencia volt a HFD-nél mért tömeghez képest (2f. Ábra). A szérum leptin koncentrációja ekvivalens volt a tömeg és a Jα18-hiányos egerekben HFD-n az SFD-vel összehasonlítva (2g. Ábra).
Az iNKT sejtek száma fordítottan korrelál a zsírszövet makrofág infiltrációjával
Az iNKT sejtek toborozhatnak és szabályozhatnak más immunsejteket (Cerundolo et al., 2009). Vizsgáltuk a zsírszármazékokból származó iNKT sejtek makrofág infiltrációra és aktivációra gyakorolt hatását. A várakozásoknak megfelelően a gyulladáscsökkentő makrofágok (F4/80 + CD11c +) növekedtek a zsírszövetben az elhízás kialakulása során, és jelentős növekedés már 1 héten belül kimutatható volt a HFD-ben. A HFD 1 hetes leállítása után a proinflammatorikus makrofágok jelentősen csökkentek a zsírban (3a. Ábra). Erős inverz korrelációt találtunk az iNKT sejt szintje között a zsírban és a proinflammatorikus makrofágokban (3a. Ábra).
Az egerek, amelyekből hiányzik az iNKT sejt, metabolikus rendellenességet mutat az SFD-n
Mind a Jα18-hiányos, mind a Cd1d1 -/- egereknek nyíltan normális immunrendszere van, patológiás érzékenység nélkül, hacsak bizonyos kórokozókkal vagy tumorokkal nem kezeljük őket. Megvizsgáltuk, hogy volt-e bizonyíték metabolikus szindrómára a Jα18-hiányos és a Cd1d1 -/- egerekben 4–5 hónapig ad libben táplált SFD-vel. Mind a Jα18-hiányos egerek, mind a Cd1d1 -/- egerek súlya folyamatosan nagyobb volt (4a. Ábra), és az SFD-nél nagyobb adipociták voltak az öregedő párosított egerekhez képest (4b. Ábra). A zsírszöveti makrofágok jelentősen megnőttek mind az iNKT-hiányosakban, de hasonló proinflammatorikus (nem ábrázolt) és gyulladáscsökkentő fenotípusok voltak az SFD minden csoportjában (4c. Ábra). Ezekkel a megállapításokkal összhangban mind a Jα18-hiányos, mind a Cd1d1 -/- egereknél jelentősen megemelkedett a szérum trigliceridszint, a TNFα koncentráció és némileg megemelkedett az IL-6 koncentráció (4d. Ábra). A Jα18-hiányos egerek és az SFD-n lévő Cd1d1 -/- egerek éhomi glükózszintje megemelkedett, a GTT pedig kissé károsodott a Cd1d1 -/- egerekben, bár ezek a különbségek nem voltak szignifikánsak (4e. Ábra).
Emberben az iNKT sejtek szintje negatívan korrelál a súlygyarapodással (Lynch et al., 2009). Az egerekben az SFD-hez való visszatérést vagy az embereknél a testsúlycsökkenést követően az iNKT szintek megemelkednek, bizonyítva az iNKT sejthibák reverzibilitását. Hasonlóképpen, a súlyos numerikus hibák ellenére a redukált iNKT sejtkészlet egér elhízás esetén még mindig képes jelentős gyulladásgátló citokinek terjeszkedésére és termelésére, ami drámai pozitív hatásokat eredményez az adipocitákra és az anyagcserére. Azt, hogy az iNKT sejteket növelő vagy aktiváló kezelések jótékony hatással lesznek-e a metabolikus szindrómában szenvedő emberekre, azt még meg kell határozni. Az αGC alkalmazását az iNKT sejtek aktiválására emberben több rákos környezetben alkalmazták. Biztonságosnak bizonyult, hepatotoxicitásról nem számoltak be, ellentétben az egerekkel, ahol az idősebb állatok ismételt nagyobb dózisa hepatotoxicitást okozhat (Exley et al., 2011). Az a megfigyelés, miszerint az iNKT sejtrendszer egerek αGC-vel történő célzása nem okozott hypocglykaemiát a diabéteszes vagy euglykaemiás modellben, a fiziológiai egyensúly helyreállítására utal. Ez terápiás szempontból potenciálisan nagyon vonzó.
Az elhízás immun-metabolikus kölcsönhatása mára kulcsfontosságú tényező a zsírszöveti gyulladásban és a 2-es típusú cukorbetegség későbbi kialakulásában. Izgalmas lehetőségeket rejt magában ennek a rendellenességnek egy új kezelési paradigmájának kidolgozásában, amely jelenleg járványos. Vizsgálatunk alátámasztja azt a nézetet, miszerint a T-sejtek és a makrofágok fontos szerepet játszanak a zsírszövet működésében, és az iNKT-sejteket a zsírban lévő fő szabályozó T-sejt-populációként azonosítja. További vizsgálatok indokolttá teszik az iNKT sejtek elhízás és metabolikus szindróma terápiás lehetőségeinek feltárását.
Kísérleti eljárások
A hím (és ahol jelezték, nőstény) C57BL/6 és ob/ob egereket a Jackson Laboratories-tól (Bar Harbor, ME) vásároltuk. Ja18-hiányos egereket és C57BL/6J CD1d1// - egereket írtak le (Exley és mtsai, 2003). A Jα18-hiányos (F9) és a CD1d1 -/- (F12) keresztbe kereszteztük a C57BL/6 háttérrel. Az egereket születésüktől fogva szomszédságukban tartották, és ugyanazzal az állattal etették őket (SFD vagy HFD). A kísérletek általában hat hét hetes hím egerekkel kezdődtek. A metabolikus vizsgálatokhoz az egerek SFD-t vagy HFD-t (Research Diets, 60 kcal% zsír a HFD-hez) kaptak, 6 hetes kortól 6 hétig, vagy 12 hétig, ha szükséges. Az egereket meghatározott kórokozóktól mentes körülmények között helyeztük el. Az állatkísérleteket az Intézményi Állattenyésztési és Felhasználási Bizottság által jóváhagyott protokolloknak megfelelően hajtották végre.
Tárgyak
10 ml perifériás vért nyertünk 26 egymást követő elhízott alanyból, akiket kórházi székhelyű súlyszabályozó klinikánkra irányítottak (47 éves átlagéletkor, 24–60 év; átlagosan BMI 48), és 18 betegnél, akik 18 hónapos súlykezelő klinikán vettek részt bariatrikus műtét után (átlagéletkor 46, tartomány 36–54 év; átlagos BMI 38) és 22 sovány egészséges kontrollnál (átlagéletkor 39, 23–54 év; átlag BMI 24). Az összes vérmintát írásos tájékoztatáson alapuló beleegyezéssel vettük. A dublini St. Vincent Egyetemi Kórház etikai bizottsága jóváhagyta ezt a tanulmányt.
Reagensek
Az αGC analóg PBS-57-tel töltött vagy üres CD1d-tetramereket az NIH tetramer létesítmény (Emory Vaccine Center, Atlanta, GA) biztosította. Az αGC-t (7000 KRN) a Kirin Ltd, Japán biztosította. Az immunsejteket RPMI-1640-ben, a zsírszövetből származó sejteket Dulbecco's Modified Eagle Media (DMEM) -ben tenyésztettük, penicillinnel, sztreptomicinnel (Mediatech, Manassas, VA) és 5% FBS-sel (Hyclone, Logan, UT) kiegészítve.
Diéta és anyagcsere vizsgálatok
A Wt, Jα18-hiányos és a CD1d1 -/- értékeket hetente lemértük, és az élelmiszer-bevételt HFD-vel monitoroztuk. A testzsírtartalmat röntgensugárzó DEXA-vizsgálattal mértük, miután egereket feláldoztunk. A herék és a nyirokcsomók kimetszése után az egész hasi zsírzsírokat lemérjük. HFD-n 6 hét után mértük az éhomi vércukorszintet (OneTouch Ultra) és az inzulin koncentrációt (Crystal Chem ELISA). A glükóztolerancia tesztekhez az éheztetett (10 órás) egerek 1 g glükózt/testtömeg-kg-ot kaptak intraperitoneálisan (i.p.), és a glükózszintet 15 percenként 90 percig mértük. Az inzulinrezisztencia esetében az inzulinrezisztencia értékelésének homeosztázisos modelljét (HOMA-IR) (Matthews et al., 1985) alkalmazták: éhomi vércukorszint x éhomi inzulin/22,5. Két 5 mm-es májmintát gyűjtöttünk és egy éjszakán át formalinban rögzítettünk, mielőtt a paraffinra szereltük volna, és a H&E vagy OIL Red O festett tárgylemezeket előállítottuk a zsírmáj mérésére. A H&E és az Olajvörös O festésnél a biopsziákat a 20x-os cél felhasználásával vizsgáltuk. A zsírmáj mértékét csúszónként 5 portális traktus területe körüli olajvörös O festési intenzitással mértük.
Adipocita mérete
Az adipocita méretét és számát ozmiummal és immunhisztokémiával mértük. Egérenként két, 20-30 mg zsírszövetből álló mintát azonnal rögzítettünk ozmium-tetroxidban (3% -os oldat 0,05 M kollidinben), 1 mm-es darabokra daráltuk és sötétben, szobahőmérsékleten 48 órán át inkubáltuk. A zsírsejtek méretét és számát Beckman Coulter Multisizer III készülékkel határoztuk meg, 400 μm-es nyílással. A zsírszövetet egy éjszakán át formalinban is rögzítették, a paraffin rögzítése és a H&E tárgylemezek előkészítése előtt. Az adipocita számot látómezőnként, mintánként tíz mezőben számoltuk, és az egyes zsírpárnák eredeti súlyához viszonyítottuk.
Lép-, máj- és zsírszövet, valamint emberi vérkészítmények
Áramlási citometria
A lépsejtek, az LMNC-k és az SVF-zsír egysejtű szuszpenzióit anti-CD16/32 mAb-vel blokkoltuk, és 30 percig 4 ° C-on sötétben PBS-57-tel töltött vagy üres CD1d-tetramer-PE-vel (NIH-tetramer-létesítmény) és CD3-mal festettük. (1: 150 dulúció, eBiosciences). A makrofágokat phykoeritrinnel konjugált F4/80 (1: 100-ból), valamint CD11c-re (1: 200-ban) és CD206-ra (1: 200-ból) antitesttel jelöltük, hogy megkülönböztessük az M1-et az SVF-ben lévő M2-makrofágoktól, ahogy azt korábban leírtuk (Fujisaka et al., 2009) . Az emberi perifériás vérhez egér anti-humán CD3-at, iNKT TCR-rel kombinálva (6B11) és izotípus-egyeztetett kontrollokat alkalmaztunk (BD Biosciences). Az iNKT sejteket Vα24 és Vβ11 TCR láncokkal is festettük a Coulter Immunotech-től (Marseilles, Franciaország). A sejteket 1% PFA-ban mossuk és fixáljuk, és LSR II áramlási citométeren (BD Bioscience), valamint FlowJo és Kaluza szoftverrel szerezzük be.
iNKT sejtek izolálása és örökbefogadó transzfer
A máj mononukleáris sejteket CD1d tetramer-PE-vel festettük, és a FacsAriaII (Becton Dickinson, CA) alkalmazásával 95% -os tisztaságig rendeztük. Tisztított iNKT sejteket (5x105) injektáltunk i.p. 8 hétig HFD-n lévő Jα18-hiányos egerekbe. A metabolikus paramétereket 4 nap múlva elemeztük, egereket leöltünk, a zsírszövetet lemértük, és az adipocitákat ozmiummal és immunhisztokémiával mértük.
Az iNKT sejtek in vivo stimulálása és intracelluláris citokin festés
Az egereket i.p. 2 μg αGG-vel vagy önmagában vivőanyaggal, az egereket pedig 5 óra vagy 4 nap múlva, a metabolikus elemzés idején feláldoztuk. A splenociták, a máj mononukleáris sejtjeinek és a zsírszövet stromovaszkuláris frakcióinak (SVF) egysejtű szuszpenzióját a korábbiakhoz hasonlóan kaptuk, de a Brefeldin A-t minden táptalajba bevittük. Először is, a splenociták vagy a máj mononukleáris sejtjeinek egysejtes szuszpenzióit anti-CD3 mAb-vel és αGC-vel töltött CD1d tetramerrel jelölt sejtfelületen festettük. Ezután a sejteket rögzítettük, permeabilizáltuk és intracellulárisan festettük az IL-4, IL-10 és IFN-y esetében Cytofix/citoperm (BD Biosciences) alkalmazásával, a gyártó utasításainak megfelelően. A citokinek semlegesítésére az aGC-kezelés előtt anti-IL-4-et (11B11) vagy anti-IL-10-et (JES5-2A5) injektáltunk i.p. az αGC injekció beadása előtt.
statisztikai elemzések
A hibasávok az átlag standard hibáját jelentik. A két csoport közötti különbségek statisztikai szignifikanciáját Mann-Whitney vagy Student t-tesztjeivel határoztuk meg, adott esetben az adatok Gauss-eloszlásának meghatározását követően. Az egércsoportok közötti különbségeket (> 2) egy- vagy kétirányú ANOVA alkalmazásával értékeltük, majd post hoc Tukey teszteket alkalmaztunk. P értékei (3,6 M, pdf)
Köszönetnyilvánítás
Köszönettel tartozunk Prof. B. Kahnnak, Dr. Odile Peroninak és a bostoni Metabolikus Fiziológiai Magnak a DEXA képalkotáshoz és az adipocita méréshez nyújtott segítségért. Köszönetet mondunk Prof. Gokhan Hotamisligilnek, a Harvard Közegészségügyi Iskolájának, Ulrich von Andrian professzornak, a Harvard Medical School-nak a gyümölcsöző beszélgetésekért, és Michael Brennernek, profi segítségért és a kézirat megbeszéléséért. Hálásan köszönjük Dr. F. Scheupleinnek és S. Jordan asszonynak az egérgondozást. Köszönetet mondunk a BIDMC áramlási citometriás magnak, különösen John Tigges-nek, és a BIDMC szövettani magnak, különösen S. White asszonynak és Dr. LH-nak. Ang. Ezt a tanulmányt az NIH R01 DK066917, U19> AI066313 (MAE), az USA DOD W81XWH-09-1-0156 (SPB), az UNESCO-L'Oreal Fellowship (LL), az Európai Bizottság Marie Curie Fellowship (LL), a Science Foundation támogatta. Írország (CO'F) és az Egészségügyi Kutatási Testület, Írország (LL, AEH, DOS). Dr. Balk és Exley konzultációs kapcsolatban állnak az NKT Therapeutics Inc-vel.
Lábjegyzetek
A többi szerzőnek nincsenek ellentmondó pénzügyi érdekei.
Kiadói nyilatkozat: Ez egy szerkesztetlen kézirat PDF-fájlja, amelyet kiadásra elfogadtak. Ügyfeleink számára nyújtott szolgáltatásként a kéziratnak ezt a korai változatát biztosítjuk. A kézirat átmásolásán, szedésén és a kapott bizonyíték felülvizsgálatán átesik, mielőtt a végső hivatkozható formában közzétennék. Felhívjuk figyelmét, hogy a gyártási folyamat során olyan hibákat fedezhetnek fel, amelyek befolyásolhatják a tartalmat, és a naplóra vonatkozó minden jogi felelősségvállalás vonatkozik.
- A borbolya az elhízás és a metabolikus szindróma kezelésében lehetséges hatásmechanizmusok
- Megtörve az elhízás ördögi körét, a metabolikus szindrómát és az alacsony tesztoszteront
- A béta-adrenerg receptorok kritikus fontosságúak a fogyás szempontjából, de a más anyagcsere-adaptációk szempontjából nem
- A zsírsejtek örökké vannak A New York Times
- 10 legjobb homeopátiás gyógyszer elhízás, túlsúly és fogyás ellen