Az alacsony zsírtartalmú étrend megváltoztatja az intramuszkuláris szubsztrátumokat, és csökkenti a lipolízist és a zsír oxidációját edzés közben
1 Emberi teljesítmény laboratórium, Kineziológiai és Egészségügyi Oktatási Tanszék, Texasi Egyetem, Austin, Austin, Texas 78712
1 Emberi teljesítmény laboratórium, Kineziológiai és Egészségügyi Oktatási Tanszék, Texasi Egyetem, Austin, Austin, Texas 78712
1 Emberi teljesítmény laboratórium, Kineziológiai és Egészségügyi Oktatási Tanszék, Texasi Egyetem, Austin, Austin, Texas 78712
1 Emberi teljesítmény laboratórium, Kineziológiai és Egészségügyi Oktatási Tanszék, Texasi Egyetem, Austin, Austin, Texas 78712
1 Emberi teljesítmény laboratórium, Kineziológiai és Egészségügyi Oktatási Tanszék, Texasi Egyetem, Austin, Austin, Texas 78712
Absztrakt
Megalapozott tény, hogy azoknak az aktív embereknek, akik alacsony szénhidráttartalmú étrendet fogyasztanak, jelentősen csökkent az izomban és a májban a glikogénkészlet, és ennek megfelelően károsodott szénhidrát-oxidációval járnak edzés közben, és csökkentik az intenzív testedzés képességét hosszabb ideig Az étkezési zsírnak és kisebb mértékben az étkezési fehérjéknek ugyanis korlátozott a glükoneogén képessége, ezért képtelenek fenntartani a glikogénkészleteket (31). Ez a klasszikus felfogás olyan étrend kifejlesztéséhez vezetett aktív emberek számára, amelyek előírt mennyiségű szénhidrátot tartalmaznak a glikogénkészletek optimális feltöltéséhez és ezáltal a szénhidrát-oxidáció és az intenzív testmozgás képességének fenntartásához (4).
Általában úgy gondolják, hogy a testmozgás során a zsír oxidációját nem befolyásolja a test trigliceridtartalma egyetlen szövetben sem, mert a sovány egyéneknél is sokkal nagyobb energia van trigliceridként tárolva, főleg a zsírszövetben, ahhoz képest, amit el lehet költeni még hosszan tartó testmozgás során is . Tudomásunk szerint nem végeztek szisztematikus vizsgálatokat a minimális étrendi zsírbevitelről, amely szükséges a zsír oxidációjának fenntartásához a testmozgás során és az IMTG koncentráció fenntartásához, vagy akár minimális szükségességre. Ezek az adatok fontosak lehetnek annak a vitának a fényében is, hogy a súlystabil emberek mennyire tudják aktiválni a lipogenezist az étrendi szénhidrátból (2, 15, 16, 26). Bár köztudott, hogy az emberek több napig pozitív kalóriaegyensúlyúak, az étrendi szénhidrátokból jelentős lipogenezist mutatnak (1), bebizonyosodott, hogy a testsúlystabil emberek, akik kalóriaegyensúlyban vannak, elhanyagolható lipogenezist mutatnak az étrendi szénhidrátok és fehérjék hatására (16, 26 ). Ezek a megfigyelések alátámasztják azt az elképzelést, miszerint a test-triglicerid és a glikogén forgalma (azaz tárolása és oxidációja) súlystabil embereknél általában függetlenek egymástól (11).
A jelen vizsgálat állóképességgel edzett sportolókat alkalmazott, akik naponta 2 órán át intenzíven sportolnak, és így általában napi nagyon nagy mennyiségű trigliceridet oxidálnak. Az anyagcserét az eukalórikus étrend után egy hétig tartó éhgyomorra végzett edzés közben tanulmányozták az anyagcserét. Ez idő alatt ezek a sportolók csökkentették a szokásos étrendi zsírbevitelt (a kalóriák 32% -a) a zsírból származó kalóriák 22 és 2% -ára. A tanulmány fő célja annak meghatározása volt, hogy a nagyon alacsony zsírtartalmú étrend (a zsírból származó kalóriák 2% -a) milyen mértékben csökkenti a zsír oxidációját edzés közben, és ennek a hatásnak a lehetséges mechanizmusát. Feltételeztük, hogy a nagyon alacsony zsírtartalmú étrend csökkenti az IMTG-raktárak újraszintézisét, amely a testmozgás során a zsír oxidációjának jelentős forrása (9, 27), és ezután csökkenteni fogja az egész test lipolízisét a testmozgás során. Az ilyen alacsony étrendi zsírbevitel és a magas kalóriakiadás együttesen ez a tanulmány lehetőséget nyújtott az emberek tanulmányozására is a tartósan negatív zsíregyensúly időszakában, ha a napi zsíroxidáció meghaladta az étrendi bevitelt. Másodlagos cél annak meghatározása volt, hogy az alacsony zsírtartalmú és magas szénhidráttartalmú étrend a lipogenezis jeleit okozza-e a súlystabil, fizikailag nagyon aktív embereknél.
Tárgyak.
Hét állóképességgel edzett férfi kerékpáros vett részt ebben a kísérletben. Legmagasabb oxigénfogyasztásuk (V˙ o 2 csúcs) testtömegük, testzsírszázalékuk és életkoruk 4,69 ± 0,24 l/perc, 71,9 ± 4,1 kg, 13 ± 4% és 25 ± 2 év volt. Az alanyokat tájékoztatták a lehetséges kockázatokról, és mindegyik aláírta az Austini Texasi Egyetem Belső Ellenőrző Testülete által jóváhagyott hozzájárulási űrlapot.
Előzetes tesztelés.
A V˙ o 2 csúcsot 7–10 percig tartó inkrementális protokoll segítségével határoztuk meg, miközben az alanyok ergométeren (Excalibur Sport, Lode, Groningen, Hollandia) keringtek. Ezenkívül azonosították a testmozgás intenzitását és a pulzusszámot a vér laktátküszöbéhez (LT, 1 mM növekedés a kiindulási érték fölé) viszonyítva.
1. táblázat: A diéták összetétele és a testtömeg
Az értékek átlag ± SE; n = 7. 32% FAT, 22% FAT és 2% FAT, étrend 32, 22, illetve 2% zsírból származó energiával.
* Mindhárom étrendet úgy tervezték, hogy különbözzen a zsír és a szénhidrát relatív (%) és abszolút (g/nap) mennyiségében.
Testedzés.
Alatt 1. nap az egyes diétás időszakokban az alanyok nem gyakoroltak; alkalmazkodtak az étrendhez, és végső ételeket választottak a biztosított étrend ad libitum mennyiségének elfogyasztásával. Tovább nap 2–6, az alanyok egy éjszakai böjt után reggel 2 órán át kerékpároztak, 10% -kal alacsonyabb teljesítmény mellett. 30 perces edzés után az alanyoknak 6% -os szénhidrát- és elektrolitoldatot biztosítottak inni. A kerékpározást a laboratóriumban felügyelték 2., 4. nap, és 6., mivel a kerékpározást általában a szabadban végezték 3. nap és 5., pulzusmonitorozással igazolt intenzitással. Tovább 7. nap, az anyagcserét az alábbiakban leírtak szerint egy 2 órás testmozgás 1. órájában tanulmányoztuk.
kísérleti eljárás.
Az alanyok reggel megérkeztek a laboratóriumba, és a testmozgás 10 órával a fent leírt szokásos szénhidrát étkezés után kezdődött. Érkezés után a teflon katétereket mindkét kar egyik antecubitalis vénájába illesztik infúziós és vérmintavétel céljából. Az artériás vér megszerzéséhez a mintavevő alkarra melegítő betétet helyeztek. 60 perces pihentető izotóp infúzió után (lásd Izotóp infúzió), az alanyok 60 percig pedáloztak egy kerékpár-ergométert 67% V2 o 2 csúcson, ami az LT alatti munkaráta 10% -ának felel meg. Körülbelül 40 perccel a testmozgás megkezdése előtt a vastus lateralis izom biopsziáját nyertük az izom-glikogén (6) és az izom-triglicerid-koncentráció (12) meghatározására.
Izotóp infúzió.
Katéterezés után vért vettünk (6 ml) a háttér izotóp dúsításának meghatározása céljából. Ezután alapozott állandó sebességű [1,1,2,3,3-2 H5] glicerin infúzió (elsődleges = 3,7 μmol/kg; állandó = 0,25 μmol · kg -1 -1 perc -1; Isotec, Miamisburg, OH ) és a [6,6–2 H2] glükózt (0,39 μmol · kg –1 · min –1; első = 33 μmol/kg) kalibrált fecskendőpumpákkal (Harvard Apparatus, South Natick, MA) kezdtük meg. Ezenkívül 5% humán albuminnal kötött [1–13 C] palmitátot (Cambridge Isotope Lab, Andover, MA) infúzióban (0,04 μmol · kg –1 · min –1; nincs prim). Ezeket a stabil izotóp infúziókat 60 perc pihenő alatt adtuk be, hogy elérjük az izotóp egyensúlyt, és állandó ütemben tartottuk az edzés során.
Vérminta és elemzés.
Izotópdúsító minta előkészítése.
Plazmamintákat (300 μl) adunk 3 ml kloroform-metanol (3: 1) elegyhez. Ezután mindegyik csövet erőteljesen rázzuk, és 3000 fordulat/perc sebességgel 10 percig 4 ° C-on centrifugáljuk. A felülúszót tiszta csövekbe helyeztük, és 3 ml metanolt és 1 ml desztillált vizet (pH 2) adtunk hozzá a lipidek extrahálásához. A csöveket ezután ismét 3000 fordulat/perc sebességgel 10 percig 4 ° C-on centrifugáltuk. A felső (vizes) réteget eltávolítottuk, külön csövekbe helyeztük és nitrogénatmoszférában szárítottuk a glükóz és glicerin 2H dúsításának további elemzéséig. Az alsó részt szintén szárítottuk és szobahőmérsékleten tároltuk a [13 C] palmitát dúsítás elemzéséig.
A glicerin és a glükóz HFBA-származékait úgy állítottuk elő, hogy 200 μl heptafluor-vajsav (Supelco) -etanolt (1: 3) adtunk a csövekhez, és a csöveket 70 ° C-on 10 percig inkubáltuk. A mintákat nitrogénatmoszférában szárítottuk, és 100 μl etil-acetátot adtunk az injekció beadása előtt (1 μl) a GC-MS-be a glicerin-dúsulás mérése céljából. A mintákat nitrogénatmoszférában ismét szárítottuk, és 150 μl HFBA-etil-acetátot (1: 3) adtunk hozzá, majd 1 μl-t injektáltunk a GC-MS-be a glükózdúsulás elemzéséhez.
A lipidkivonatokat 250 μl jodometán-oldat (500 μl jodometán 10 ml diklór-metánban) és 250 μl 0,2 M tetrabutil-ammónium-hidrogén-szulfát hozzáadásával derivatizáltuk. 10 perc rázás és 30 perc ultrahanggal történő kezelés után minden csőbe 3 ml hexánt adunk. Ezután a csöveket vortexeljük és 3000 fordulat/perc sebességgel 10 percig 4 ° C-on centrifugáljuk. A felülúszót szilikagél szilárd fázisú extrakciós oszlopon (2 g; Supelco) engedtük át, az eluenst nitrogénatmoszférában megszárítottuk és 50 μl heptánnal helyreállítottuk. Egy mikrolitert injektáltunk a GC-be. A stabil izotópdúsulást a GC-MS elektronütközéssel mértük a (m/z) a palmitát 270, 271 és a glicerin 253 és 257, a glükóz esetében 519 és 521 molekuláris ionok.
A gázcsere mérései.
Nyugalmi állapotban és gyakorlás közben (20–30 és 50–60 perc) az alanyok kétirányú Daniels-szelepen keresztül lélegeztek be, míg a belélegzett levegő mennyiségét egy Parkinson-Cowan CD4 szárazgázmérővel (Rayfield Equipment, Waitsfield, VT) mértük. A lejárt gázokat keverőkamrából folyamatosan vettük mintát, és oxigént (Applied Electrochemistry, SA3, Ametek, Pittsburgh, PA) és szén-dioxidot (Beckman LB2; Schiller Park, IL) elemeztünk. Ezeket a műszereket a számítógéphez illesztettük a V2 és V2 kO 2 kiszámításához.
Számítások.
A plazma glicerin-, glükóz- és palmitát kinetikáját Steele (29) nem stabil állapotú, stabil izotópokkal való felhasználásra módosított, egy-pool modelljével számítottuk ki.
Az Ra FFA-t úgy számítottuk ki, hogy az Ra palmitátot elosztottuk a palmitát frakcionális hozzájárulásával az összes FFA koncentrációhoz, amelyet gázkromatográfiával határoztak meg (GC-FID; Varian 3400). A nem fehérje légzési hányados képleteit alkalmazták a zsírsav- és szénhidrát-oxidáció kiszámításához (22). Végül a raglicerint 3-zal megszoroztuk a triglicerid molekula teljes hidrolíziséből felszabadult három zsírsav figyelembevételével. A nem plazma zsírsav (FA) oxidációját a teljes FA oxidáció és az eltűnési sebesség (Rd) FFA közötti különbségként számítottuk, amely azt feltételezi, hogy az összes Rd FFA oxidálódik, míg a korábbi közvetlen intézkedések szerint az Rd 88% -a oxidálódott a éhomi állapot (7). Feltételezzük továbbá, hogy a nem plazma FA oxidációja főleg az IMTG-ből származik (7, 9, 27), bár a plazma triglicerid mennyiségi jelentősége nem egyértelmű.
Statisztikai analízis.
Mivel először 32% FAT-ot mutattak be, majd 22% FAT-ot és 2% FAT-t randomizáltak, ezt a vizsgálatot a tervezett összehasonlításra tervezték, 2% FAT és 22% FAT átlagos kontrasztok alkalmazásával. Az idő interakciók szerinti kezeléseket varianciaanalízissel azonosítottuk, ismételt mérésekkel, az egyéneken belüli teljes tervben (SuperAnova; Abacus, Berkeley, Kalifornia). A statisztikai szignifikanciát a következők szerint határoztuk meg P 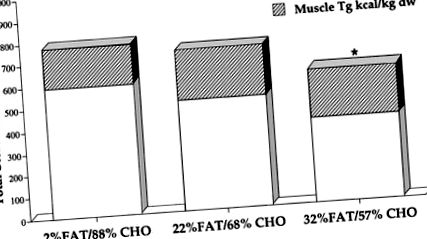
1. ábra.Az izomban tárolt energiamennyiség (kcal/kg száraz tömeg) a glikogén és az intramuszkuláris triglicerid (Tg) összegeként. CHO, szénhidrát. * Azt jelzi, hogy a 32% zsírtartalmú étrendet tartalmazó étrend (32% FAT) lényegesen alacsonyabb, mint a 2 vagy 22% zsírenergiát (2% FAT vagy 22% FAT) tartalmazó étrend, P
Plazma szubsztrát és inzulin koncentráció.
A 2. ábra azt mutatja, hogy a plazma glükóz- és FFA-koncentrációja hasonló volt nyugalmi állapotban és 60 perc edzés alatt 2% FAT és 22% FAT mellett. A Preexercise plazma inzulin nyugalmi állapotban (4,6–5,6 μU/ml) és edzés közben (2–4 μU/ml) is hasonló volt 2% FAT és 22% FAT tartalommal; a plazma laktát is hasonló volt. A plazma glicerin-koncentrációja azonban a testmozgás 30–60 perces periódusában csökkent (P
2. ábra.A glicerin plazmakoncentrációja (A), a plazma szabad zsírsav (FFA) koncentrációja (B) és a plazma glükózkoncentrációja (C) nyugalmi állapotban és 60 perc edzés alatt 1 hét 2% FAT vagy 22% FAT után. * 2% FAT lényegesen alacsonyabb, mint 22% FAT; P
A hordozó oxidációja edzés közben.
Kezelésenkénti interakciók nem voltak, így a testmozgás 60 percének értékét a 20-30, illetve 50-60 perc átlagaként jelentik. A 2% -os zsírtartalom legszembetűnőbb hatása a 22% -os zsírtartalomhoz képest az volt, hogy edzés közben 19% -kal csökkentette az egész test glicerin megjelenését (P
3. táblázat: Szubsztrát kinetika és oxidáció 1 óra edzés közben 32% FAT, 22% FAT és 2% FAT
Az értékek a 20–30 és 50–60 perc értékek ± SE középértékei ± μm · kg −1 · min −1. Ra, a megjelenés sebessége; Rd, eltűnési sebesség; FFA, szabad zsírsavak.
F3-150 2% FAT jelentősen eltér a 22% FAT-tól; P F3-151 A 32% -os FAT kontroll étrendet a többi étrenddel összehasonlító statisztikát nem végeztük el, mert először adták be és nem randomizálták.
A plazma glükóz kinetikája nem különbözött nyugalomban vagy edzés közben; mégis az összes szénhidrát oxidációja 17% -kal magasabb volt (P
2. táblázat: Izomszubsztrát koncentrációjának gyakorlása a különféle étrendekkel
- Az in vitro lipolízis az egész test lipidjeinek oxidációjával és súlygyarapodással jár emberben - Frankl
- Alacsony zsírtartalmú vagy alacsony szénhidráttartalmú étrend, amely jobb a fogyás érdekében
- Alacsony zsírtartalmú étrend Miért nem zsírmentes a zsírmentes
- Természetesen élő fogyás a lipolízis diéta révén
- A májglikogén csökkenti a táplálékfelvételt és gyengíti az elhízást egy magas zsírtartalmú étrenddel táplált egérmodellben